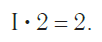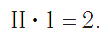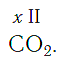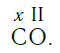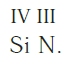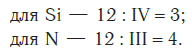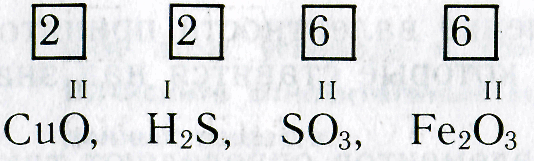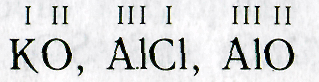что такое общее число единиц валентности
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
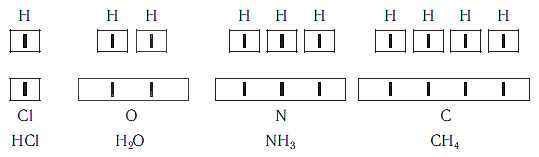
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
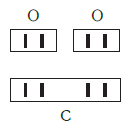
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
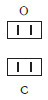
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
Постоянная и переменная валентность
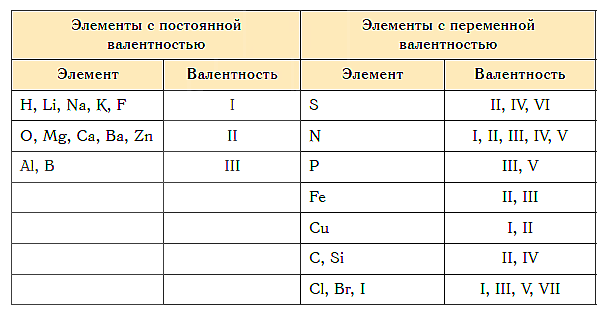
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Валентность элементов.
Валентность элементов – первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Обозначают валентность элемента всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Все вещества, которые обладают валентностью, характеризуются тем, что она у них или постоянна (во всех связях), либо переменная. Постоянная валентность – характеристика очень небольшой группы веществ (водорода, фтора, натрия, калия, кислорода и др. Намного больше в мире атомов, которые обладают переменной валентностью. В разных реакциях, взаимодействуя с разными атомами, они становятся разновалентными. Например, азот в соединении NH3 имеет валентность – III, так как связан с тремя атомами, а в природе он бывает с валентность от одного до четырех. Еще раз повторю, что разная валентность – более распространенное явление.
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента» пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Выглядит это так: используя знание, что валентность кислорода всегда равна двум, мы можем с легкостью высчитать валентность всего кислотного остатка. Например, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов» связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Необычные способы определения валентности элементов.
Есть и более нестандартные, но интересные способы определения валентности вещества. Если хорошо знать свойства элемента, то определить валентность можно даже визуально. Например, медь. Ее оксиды будут красными и черными, а гидроксиды – желтыми и синими.
Наглядность.
Для того, чтоб валентность элемента была более понятна рекомендуют писать структурные формулы. Создавая их, мы пишем условные обозначения атомов, а потом рисуем черточки, опираясь на валентность. Там каждая черточка обозначает связи каждого из элементов и получается очень наглядно.
Валентность.
Валентность – свойство атомов одного химического элемента присоединять или замещать определённое количество атомов другого.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Таблица элементов с постоянной валентностью.
Валентности
Элементы
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
Формулы веществ можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно составить из них химическую формулу.
Алгоритм составления формул веществ по валентности.
1. Записать символы элементов.
2. Определить валентности входящих в формулу элементов.
3. Найти наименьшее общее кратное численных значений валентности.
4. Найти соотношения между атомами элементов путём деления найденного наименьшего общего кратного на соответствующие валентности элементов.
5. Записать индексы элементов в химической формуле.
Пример: составим химическую формулу оксида фосфора.
2. Определим валентности:
3. Найдём наименьшее общее кратное:
4. Найдём соотношения между атомами:
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Как определить валентность.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. Как определить валентность по таблице Менделеева поможет понять знание видов валентности.
Виды валентности
Постоянная (у металлов главных подгрупп)
Переменная (у неметаллов и металлов побочных подгрупп)
Высшая (равна номеру группы)
Низшая (равна разности между числом 8 и номером группы)
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов.
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Как определить валентность если она переменная. Что такое валентность
1. Постоянная валентность
2. Переменная валентность
§ 11. Валентность химических элементов
НС1 Н 2 О NH 3 СН 4
Хлороводород вода аммиак метан
Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Понятию «валентность» можно дать следующее определение:
(Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.)
Ответьте на вопросы 1-3 (с. 32).
§12. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Определение валентности элементов по формулам их соединений.
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например, если дана формула оксида меди СuО, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится один атом меди. Следовательно, валентность меди тоже равна двум.
При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Итак, валентность элементов по формулам можно определить следующим образом:
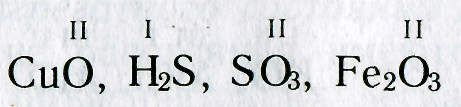
2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента:
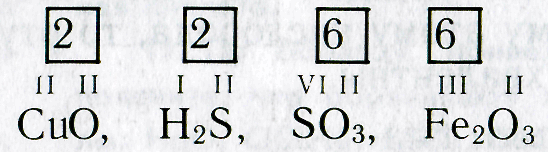
Составление химических формул по валентности. Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице 3.
Таблица 3. Валентность некоторых элементов в химических соединени
При составлении химических формул можно соблюдать следующий порядок действий:
1. Пишут рядом химические знаки элементов, которые входят в состав соединения:
2. Над знаками химических элементов проставляют валентность:
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов: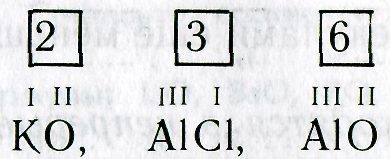
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут):
Однако относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие ча c тицы (с. 14). Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Ответьте на вопросы 8-12 (с. 33).
1. Что такое валентность химических эле ментов? Поясните это на конкретных примерах.
2. Почему валентность водорода принята за единицу?
3. В реакции железа с соляной кислотой один атом металла вытесняет два атома водорода. Как это можно объяснить, пользуясь понятием о валентности?
5. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III I
LiO, ВаО, РО, SnO, КО, РН, MnO, FeO, BO, HS, NO, CrCI.
6. Пользуясь данными таблицы 3 (с. 30), составьте химические формулы соединений с кислородом следующих химических элементов: Zn, В, Be, Co, РЬ, Ni. Назовите их.
7. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
8. Изложите сущность основных положений атомно-молекулярного учения.
9. Какие явления подтверждают: а) движение молекул; 6) наличие между молекулами промежутков?
10. Чем отличается движение молекул в газах, жидкостях, твердых веществах?
11. Чем отличаются по своим физическим свойствам твердые вещества с молекулярным и немолекулярным строением?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1. Вычислите относительные молекулярные массы: а) оксида железа (III); б) оксида фосфора (V); в) оксида марганца (VII).
2. Определите массовые доли элементов в оксиде меди (I) и в оксиде меди (II). Найденные массовые доли выразите в процентах.
1. Что такое валентность химических эле- рода. Как это можно объяснить, пользуясь ментов? Поясните это на конкретных примерах. понятием о валентности?
2. Почему валентность водорода принята 4. Определите валентность элементов по за единицу? формулам: HgO, K 2 S, B2O3, ZnO, МпОг, NiO,
один атом металла вытесняет два атома водо- 5. Даны химические символы элементов и
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии
Ковалентность равна числу неспаренных электронов атома, участвующих в образовании связи, и часто может принимать все значения от 1 до максимальной, которая для большого числа элементов совпадает с номером их группы в периодической системе Менделеева (подробно см. разделы 2 и 3).
Однако по своему определению ОЧ, в отличие от ковалентности и ионной В., имеющих чёткий физический смысл, носит в общем случае условный характер и, за исключением весьма ограниченного класса соединений с чисто ионной связью, не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим количеством связей, которые атом образует. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки и связь между ними имеет почти чисто ковалентный характер, возникает неопределённость, к какому из них следует целиком относить электронную пару (см. Окислительное число).
2. Эволюция понятия «валентность» и его роль в истории химии
Первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Обозначают валентность элемента всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента » пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов » связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Необычные способы определения валентности элементов.
Наглядность.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в CaH2 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – H2SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами