что такое нисходящие пути
Что такое нисходящие пути
Существуют следующие нисходящие проводящие пути:
• корково-спинномозговой проводящий путь (пирамидный проводящий путь);
• ретикуло-спинномозговой проводящий путь (экстрапира-мидный путь);
• преддверно-спинномозговой проводящий путь;
• покрышечно-спинномозговой проводящий путь;
• шовно-спинномозговой проводящий путь;
• проводящие пути аминергических систем ЦНС;
• проводящие пути вегетативной нервной системы.
Корково-спинномозговой проводящий путь
Корково-спинномозговой проводящий путь представляет собой крупный проводящий путь произвольной двигательной активности. Около 40 % его волокон начинается из первичной моторной коры прецентральной извилины. Остальные волокна берут начало из дополнительной моторной области на медиальной стороне полушария, премоторной коры головного мозга на латеральной стороне полушария, соматической сенсорной коры, коры теменной доли и коры поясной извилины. Волокна от двух вышеупомянутых сенсорных центров заканчиваются на чувствительных ядрах ствола головного мозга и спинного мозга, где они регулируют передачу чувствительных импульсов.
Корково-спинномозговой проводящий путь спускается вниз через лучистый венец и заднюю ножку внутренней капсулы к стволу головного мозга. Затем он проходит в ножке (головного мозга) на уровне среднего мозга и базилярной части моста, достигая продолговатого мозга. Здесь он образует пирамиду (отсюда название — пирамидный проводящий путь).
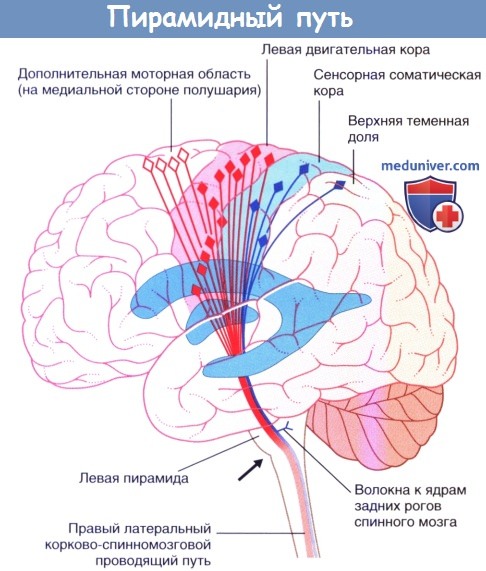
Дополнительная моторная область на медиальной стороне полушария.
Стрелкой показан уровень перекреста пирамид. Чувствительные нейроны выделены синим цветом. 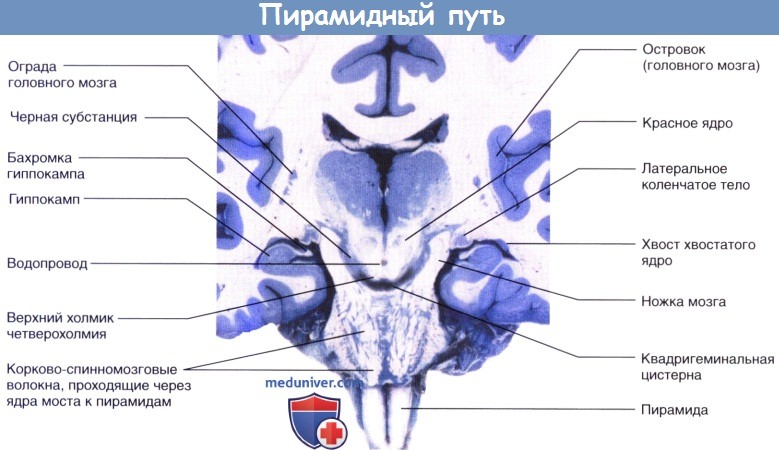
демонстрирующий неокрашенные корково-спинномозговые волокна, идущие через ядра моста в сторону пирамид.
Характеристика волокон корково-спинномозгового пути выше уровня спинномозгового перехода:
• около 80 % (70-90 %) волокон переходят на противоположную сторону на уровне перекреста пирамид;
• эти волокна спускаются по противоположной стороне спинного мозга и составляют латеральный корково-спинномозговой проводящий путь (перекрещивающийся корково-спинномозговой проводящий путь); оставшиеся 20 % волокон не перекрещиваются и продолжают спускаться вниз в передней части спинного мозга;
• половина из этих неперекрещивающихся волокон вступает в передний/вентральный корково-спинномозговой проводящий путь и располагается в вентральном/переднем канатике спинного мозга на шейном и верхнем грудном уровнях; данные волокна переходят на противоположную сторону на уровне белой спайки и иннервируют мышцы передней и задней стенок брюшной полости;
• другая половина вступает в латеральный корково-спинномозговой проводящий путь на своей половине спинного мозга.
Считают, что корково-спинномозговой проводящий путь содержит около 1 млн. нервных волокон. Средняя скорость проведения импульса составляет 60 м/с, что указывает на средний диаметр волокна, равный 10 мкм («правило шести»). Около 3 % волокон — очень крупные (до 20 мкм); они отходят от гигантских нейронов (клетки Беца), расположенных в основном в области двигательной коры, отвечающей за иннервацию нижних конечностей. Все волокна корково-спинномозгового пути — возбуждающие и в качестве медиатора используют глутамат.
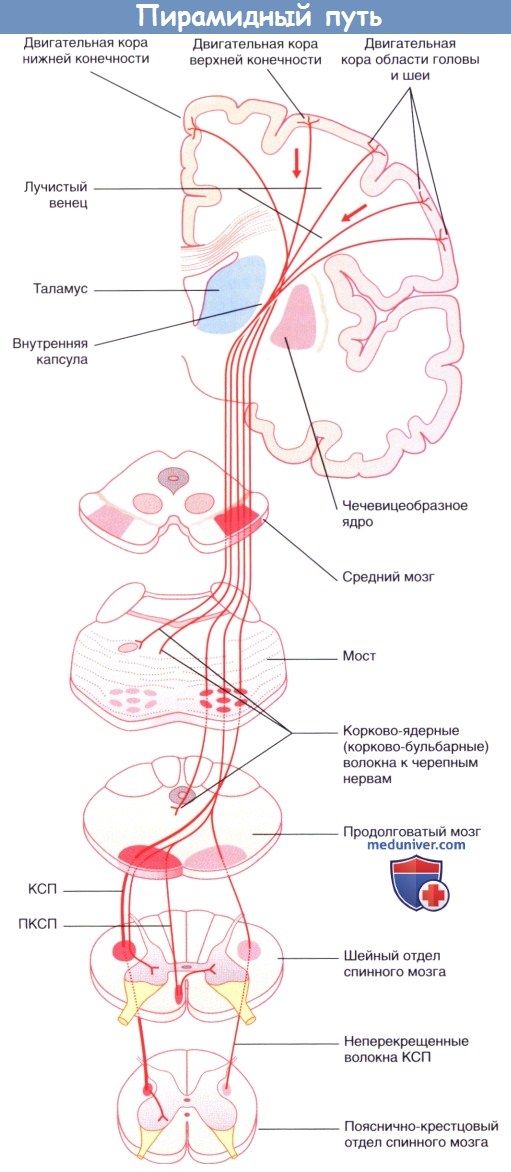
КСП — корково-спинномозговой проводящий путь;
ПКСТ — передний корково-спинномозговой проводящий путь;
ЛКСП — латеральный корково-спинномозговой проводящий путь.
Обратите внимание: показан только двигательный компонент; компоненты теменной доли опущены.
Клетки-мишени латерального корково-спинномозгового пути:
а) Мотонейроны дистальных отделов конечностей. В передних рогах серого вещества спинного мозга аксоны латерального корково-спинномозгового пути могут непосредственно образовывать синапсы на дендритах α- и γ-мотонейронов, иннервирующих мышцы конечностей, особенно верхних (однако, как правило, это происходит через интернейроны в пределах серого вещества спинного мозга). Отдельные аксоны латерального корково-спинномозгового пути могут активировать «большие» или «малые» двигательные единицы.
Двигательная единица — это комплекс, состоящий из нейрона переднего рога спинного мозга и всех мышечных волокон, которые этот нейрон иннервирует. Нейроны малых двигательных единиц избирательно иннервируют небольшое количество мышечных волокон и участвуют в выполнении тонких и точных движений (например, при игре на пианино). Нейроны переднего рога, иннервирующие крупные мышцы (например, большую ягодичную мышцу), способны по отдельности вызвать сокращение сотни мышечных клеток сразу, так эти мышцы отвечают за грубые и простые движения.
Уникальное свойство этих корковомотонейронных волокон латерального корково-спинномозгового пути демонстрирует понятие «фракционирования», относящееся к переменной активности интернейронов, в результате чего небольшие группы нейронов могут быть избирательно активированы для выполнения конкретной общей функции. Это легко показать на указательном пальце, который может быть согнут или разогнут независимо от положения других пальцев (хотя три из его длинных сухожилий имеют общее начало с мышечным ложем всех четырех пальцев).
Фракционирование имеет большое значение при выполнении привычных движений, таких как застегивание пальто или завязывание шнурков. Травматическое или другое повреждение корковомотонейронной системы на любом уровне влечет за собой утрату навыков выполнения привычных движений, которые затем редко поддаются восстановлению.
При выполнении данных движений α- и γ-мотонейроны активируются совместно через латеральный корково-спинномозговой проводящий путь таким образом, что веретена мышц, первично задействованных в движении, посылают импульсы об активном растяжении, а веретена мышц-антагонистов — о пассивном растяжении.
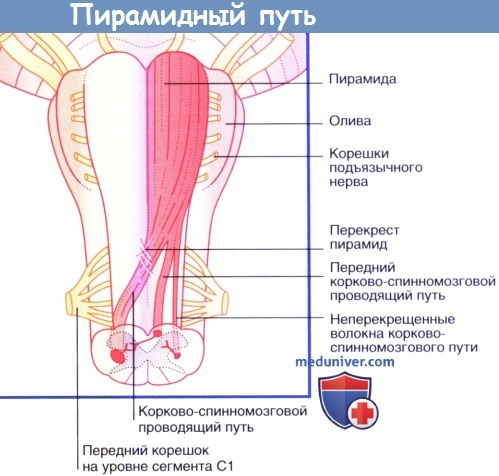
Продемонстрированы три группы нервных волокон левой пирамиды.
б) Клетки Реншоу. Функции синапсов латерального корково-спинномозгового пути на клетках Реншоу довольно многочисленны, так как торможение на некоторых клеточных синапсах главным образом происходит за счет интернейронов типа Iа; на других синапсах данную функцию выполняют клетки Реншоу. Вероятно, наиболее важная функция — контроль совместного сокращения основных движущих мышц и их антагонистов для фиксации одного или нескольких суставов, например при работе с кухонным ножом или лопатой. Совместное сокращение происходит за счет инактивации ингибирующих интернейронов Iа клетками Реншоу.
в) Возбуждающие интернейроны. Латеральный корково-спинно-мозговой проводящий путь влияет на деятельность двигательных нейронов, расположенных в средней части серого вещества и в основании переднего рога спинного мозга, иннервирующих осевые (позвоночные) мышцы и мышцы проксимальных отделов конечностей посредством возбуждающих интернейронов. г) la-ингибирующие интернейроны. Эти нейроны также расположены в средней части серого вещества спинного мозга и активируются латеральным корково-спинномозговым путем в первую очередь при совершении произвольных движений.
Активность Ia-интернейронов способствует расслаблению мышц-антагонистов до того, как начнут сокращаться мышцы-агонисты. Кроме того, они вызывают рефрактерность мотонейронов мышц-антагонистов к стимуляции афферентами нервно-мышечного веретена при их пассивном растяжении во время движения. Последовательность процессов при произвольном сгибания коленного сустава показана на рисунке ниже.
(Обратите внимание на терминологию: в спокойном положении стоя колени человека «закрыты» в небольшом переразгибании, а четырехглавая мышца бедра находится в неактивном состоянии, о чем свидетельствует «свободное» положение надколенника. При попытке сгибания одного или обоих колен происходит подергивание четырехглавой мышцы бедра в ответ на пассивное растяжение в ней десятков мышечных веретен. Поскольку таким образом происходит сопротивление сгибанию, рефлекс называют рефлексом сопротивления.
С другой стороны, во время произвольного сгибания коленного сустава мышцы способствуют данному движению с помощью такого же механизма, но уже через рефлекс помощи. Изменение знака с отрицательного на положительный называют рефлексом перемены направления.)
д) Пресинаптические ингибиторные нейроны, обеспечивающие рефлекс растяжения. Рассмотрим движения спринтера. На каждом шаге сила тяжести тянет его тело вниз, на выпрямленное четырехглавой мышцей колено. В момент соприкосновения с землей все нервно-мышечные веретена в сокращенной четырехглавой мышце резко растягиваются, в результате чего возникает опасность разрыва мышцы. Сухожильный орган Гольджи обеспечивает некоторую защиту посредством внутреннего торможения, однако основной защитный механизм обеспечивает латеральный корково-спинномозговой путь через пресинаптическое торможение афферентов веретен вблизи их контакта с мотонейронами.
В то же время удлинение паузы до ахиллового рефлекса служит преимуществом в этой ситуации, так как происходит восстановление мотонейронов, иннервирующих заднюю часть голени, для следующего рывка. Предполагают, что степень подавления рефлекса растяжения со стороны латерального корково-спинномозгового пути зависит от конкретных движений.
е) Пресинаптическое ингибирование чувствительных нейронов первого порядка. В заднем роге серого вещества спинного мозга существует некоторое подавление передачи чувствительных импульсов в спиноталамический проводящий путь при совершении произвольных движений. Это происходит путем активации синапсов, образованных ингибирующими вставочными нейронами и первичными чувствительными нервными окончаниями.
Еще более тонкую регуляцию наблюдают на уровне тонкого и клиновидного ядер, где волокна пирамидного пути (после пересечения) способны усиливать передачу чувствительных импульсов во время медленных аккуратных движений или ослаблять ее во время совершения быстрых движений.
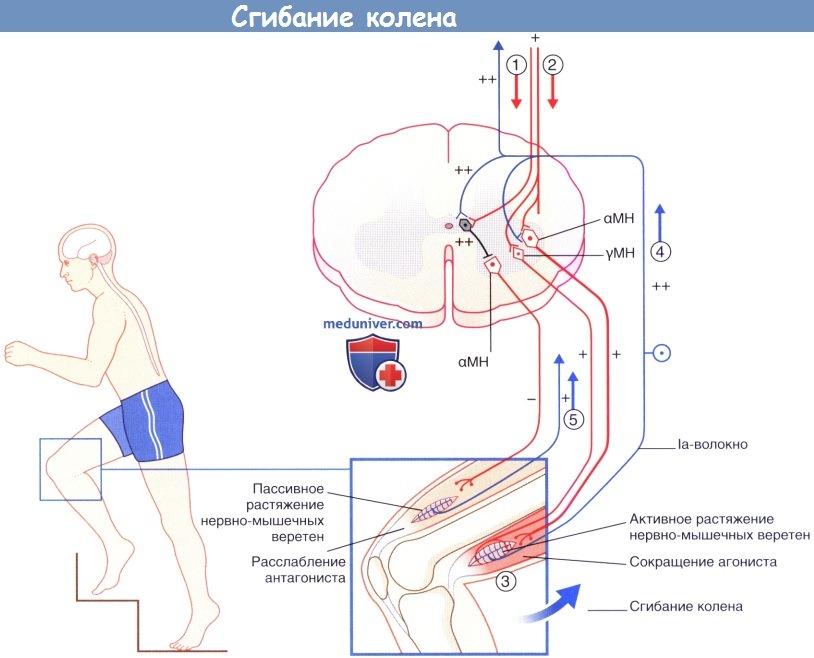
(1) Активация la интернейронов ингибирует их антагонисты-α-мотонейроны.
(2) Активация агонистов α- и γ-мотонейронов.
(3) Активация экстрафузальных и интрафузальных мышечных волокон.
(4) Импульсация от активно растянутых нервно-мышечных веретен увеличивает активность агониста а-мотонейрона и снижает активность его антагонистов.
(5) Iа-волокна от пассивно растянутых нервно-мышечных веретен-антагонистов направляются к соответствующим рефрактерным а-мотонейронам.
Обратите внимание: последовательность «γ-мотонейронон—Ia-волокно—α-мотонейрон» образует γ-петлю.
Редактор: Искандер Милевски. Дата публикации: 15.11.2018
Физиологические аспекты
Спинномозговая жидкость
Спинномозговая жидкость (СЖ) является прозрачной бесцветной жидкостью, чьи физико-химические свойства показаны в таблице 2.1.
Таблица 2.1 Физико-химические свойства СМЖ
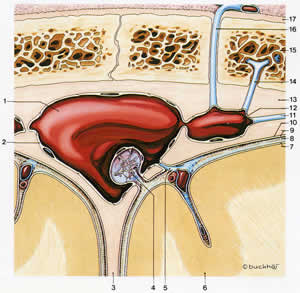
Девяносто процентов СЖ формируется в сосудистых сплетениях (небольших красноватых пучках или участках тканей) в боковых, третьем и четвертом желудочках (рис.1.38), тогда как 10 процентов образуется в веществе мозга. Кровь и СЖ разделяются непроницаемыми “плотными соединениями” между эпителиальными клетками (рис.2.1).
| Рис.2.1. Основные нутриенты достигают нейронов и глиальных клеток головного мозга, проходя или через гематоэнцефалический барьер (кровь-СМЖ), который регулируется сосудистым сплетением, или через барьер церебральных капилляров. Водорастворимые молекулы не могут свободно диффундировать между кровью и спинно-мозговой жидкостью из-за непроницаемых жестко связанных соединений между эпителиальными клетками сосудистых сплетений, вместо этого эпителиальные клетки переносят определенные молекулы с одной стороны барьера на другую. Как только молекулы попадают в СМЖ, они диффундируют через «протекающий» эпителиальный слой и достигают интерстициальной жидкости, окружающей нейроны и глиальные клетки. | |
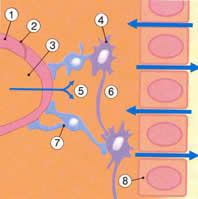 | 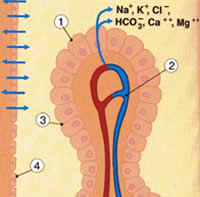 |
| Рис. 2.1а. 1.Эндотелиальная клетка 2.Плотное соединение 3.Церебральный капилляр 4.Нейрон 5.Глюкоза 6.Интерстициальная жидкость 7.Глиальная клетка 8.Эпендимный слой | Рис.2.1б. 1.Хориоидальное сплетение, эпителиальная клетка 2.Капилляр 3.Плотное соединение 4.Эпендимный слой |
Эпителиальные клетки переносят определенные молекулы из капилляров внутрь желудочков головного мозга (рис.2.2). Молекулы воды в эпителиальных клетках диссоциируют на ионы водорода и гидроксильные ионы. Гидроксильные ионы комбинируются с двуокисью углерода, которая является продуктом клеточного метаболизма. На поверхности базолатеральных клеток ионы водорода обмениваются на внеклеточные ионы натрия из плазмы. В желудочках мозга ионы натрия активно переносятся через апикальную поверхность клетки. Это сопровождается компенсаторным движением ионов хлорида и бикарбоната в СЖ. Для поддержания осмотического равновесия вода движется в желудочки (рис.2.2).
Рис. 2.2. Поток ионов, пересекающий гематоэнцефалический барьер (кровь-СМЖ) регулируется несколькими механизмами в сосудистом сплетении.
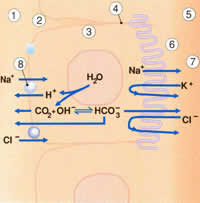
2.Базолатеральная поверхность
3.Эпителиальная клетка сосудистого сплетения
4.Жесткая связь
5.Желудочки
6.Апикальная поверхность
7.СМЖ в желудочке
8.Ионный обмен
Объем СЖ, производимый ежедневно, предположительно равен объему, находящемуся в центральной нервной системе (ЦНС), который составляет приблизительно 150 мл. Однако, при потере СЖ (напр., во время или после люмбальной пункции), значительное количество ее может быть продуцировано, чтобы скомпенсировать потерю.
Скорость абсорбции СЖ зависит от давления и линейно в широком диапазоне. Арахноидальные грануляции, находящиеся в краниальных венозных синусах, дренируют основную часть СЖ. Когда давление СЖ превышает таковое в венозных синусах, тонкие канальцы в грануляциях позволяют СЖ стекать внутрь синусов. И наоборот, когда давление в венозных синусах превышает давление СМЖ, окончания грануляций закрываются, предотвращая обратный отток (рис.2.3). Другие возможные участки абсорбции включают вены в субарахноидальном пространстве и в лимфатических сосудах краниальных и спинальных нервов.
| Рис 2.3. | 1.Верхний сагиттальный синус 2.Эндотелий 3.Мозговой намет 4.Арахноидальная грануляция 5.Верхняя церебральная вена 6.Кора головного мозга 7.Мягкая мозговая оболочка 8.Субарахноидальное пространство и арахноидальная трабекула 9.Арахноидальная мембрана 10.Субдуральное пространство 11.Менингеальная вена 12.Полость вены 13. Твердая мозговая оболочка 14.Вена губчатого вещества (кости) 15.Пристеночная кость (cranium ) 16.Эмиссарная (дренирующая) вена 17. Pericranium |
 |
Помимо физической защиты головного мозга, СЖ обеспечивает ему и химически стабильную окружающую среду. Разделение крови и СЖ регулирует важнейшие биохимические функции в головном мозге. Кроме того, это разделение, вероятно, принимает участие в питании мозга и помогает удалять продукты метаболизма. Более того, оно является важным в распределении и удалении лекарственных средств, введенных в СЖ (напр., местных анестетиков и опиоидов).
Физиология сенсорных афферентных путей
Ноцицепторы и периферические механизмы боли
Ноцицепторы являются специфическими болевыми рецепторами, активируемыми только интенсивной, разрушающей ткань активностью (действием). Структурно ноцицепторы являются свободными нервными окончаниями, локализованными в коже и других чувствительных к боли тканях. А-дельта или С-волокна проводят афферентные импульсы в ответ на болевой стимул и классифицируются в соответствие со стимулом, который их активирует. (Табл.2.2).
Таблица 2.2. Ноцицепторы
Маргинальная зона заднего рога состоит из больших противоположно ориентированных нейронов. Некоторые клетки слоя I направлены непосредственно в таламус через контралатеральные восходящие пути, тогда как другие восходят внутри- и/или межсегментарно через задние и заднебоковые пути. Нейронные клетки слоя I отвечают на:
Слой III-V (Nucleus proprius или magnocellular area)
Дендриты относительно больших нейронов слоя IV распространяются поперечно (крест-накрест) и дорсально в желатинозную субстанцию. Клетки в слое IV отвечают на царапины и прикосновения, но при усилении этих воздействий не увеличивают свою активность. Нейроны широкого динамического диапазона (ШДД) слоя V являются мультирецептивными нейронами, которые отвечают на неповреждающее прикосновение, низкие или высокие механические, термические и химические стимулы (воздействия). Активность ШДД-нейронов возрастает с ростом интенсивности раздражения.
Нейроны слоя V являются важным звеном спинно-таламического, спинно-ретикулярного и спинно-мезэнцефалического путей (см. ниже), поскольку вносят существенный вклад в их функционирование.
Слой Х (Центральный канал)
Слой Х не является частью дорсального рога. Однако, клетки в этой области имеют свойства, такие же как и маргинальные клетки слоя I и активируются воздействием высокой или низкой температуры и повреждающими механическими раздражениями, участвуя в процессе формирования и передачи боли.
Механизмы дорсального рога
Клеточные пересечения в дорсальном роге являются основными в механизме обработки болевого сигнала. Однако, механизмы, ответственные за передачу боли, невероятно сложны. Здесь может быть представлен лишь их краткий обзор.
Клетки в слое I отвечают почти исключительно на повреждающие стимулы. Аксоны этих клеток заканчиваются в более глубоких слоях в дорсальном роге или нисходят к контралатеральному таламусу ( vide infra ). К ШДД-нейронам в слое V подходят как большие, так и малые волокна, многие из которых заканчиваются в контралатеральном ядре таламуса. Ингибиторные интернейроны, локализованные в желатинозной субстанции, широко соединены с другими нейронами дорсального рога, которые также нисходят в таламус.
Эти ингибиторные клетки модифицируют активность ноцицептивных нейронов. Сегментарные и нисходящие неврологические пути ( vide infra ) влияют на ингибиторную активность клеток желатинозной субстанции (ЖС) (рис.2.4).
Неврологическая передача в спинном мозге
Болевые стимулы приводят к высвобождению нейромедиаторов из ноцицептивных нейронов, которые активируют нейроны второго порядка, заканчивающиеся в верхних центрах. Интернейроны в ЖС могут модулировать высвобождение этих нейромедиаторов, активируя ингибиторные пресинаптические рецепторы. Считается, что этими ингибиторными пресинаптическими нейромедиаторами являются энкефалины. Интраспинальные опиоды вызывают сегментарную анальгезию предположительно путем активации тех же пресинаптических ингибиторных рецепторов, что и энкефалины, блокируя, таким образом, высвобождение болевых нейротрансмиттеров (Рис.2.5).
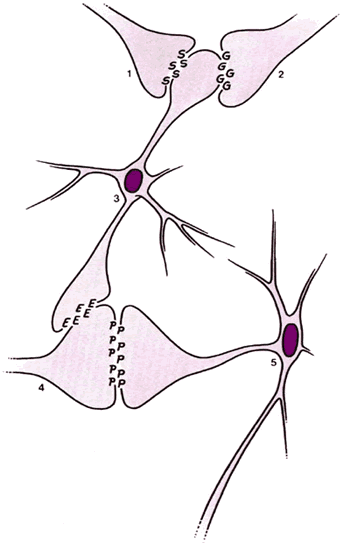 | Рис.2.5 Предложенный механизм ингибирования активации болевых нейронов посредством энкефалин-секреторных интернейронов. Болевые нейроны активируются высвобождением нейротрансмиттерного вещества из ноцицепторов. Ингибиторные интернейроны влияют на тоническое пресимпатическое ингибирование высвобождения болевых нейротрансмиттеров. Ингибирование увеличивается сегментарным, а также нисходящим входом. 1.Нисходящий ингибиторный нейрон из области околоводопроводного серого вещества. G = гамма-аминобутиратная кислота |
5-гидрокситриптамин (5НТ, серотонин) и норэпинефрин также модулируют высвобождение болевых нейротрансмиттеров в ЖС путем активации нисходящих ингибиторных путей ( vide infra ). Неврологическая активность в больших А-бета волокнах в том же сегменте может также подавлять ответ на повреждающие стимулы в ЖС (так называемое закрытие ворот), которые, как полагают, обусловлены высвобождением ГАМК (гамма-аминомасляной кислоты). Это взаимодействие больших и малых волокон в ЖС является базовым элементом теории воротного контроля, предложенной Мелзаком и Уоллом. Были предложены и другие возбуждающие/ингибирующие медиаторы, но их описание выходит за рамки этой публикации.
Восходящие болевые пути
Спинно-таламический тракт (СТТ)
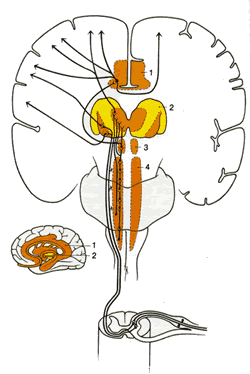 | Рис.2.6. Диаграмма показывает пути вдоль латерального спинно-таламического тракта из спинного в головной мозг. 1.Лимбическая структура переднего мозга |
Спинно-ретикулярный тракт (СРТ)
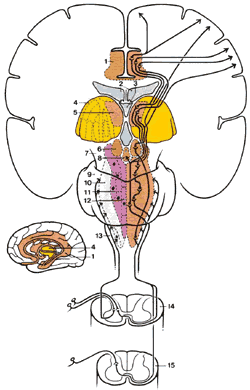 | Рис.2.7. Диаграмма показывает пути вдоль латерального спинно-ретикулярного тракта из спинного в головной мозг. 1.Лимбическая структура переднего мозга |
Спинно-мезэнцефалический тракт (СМТ)
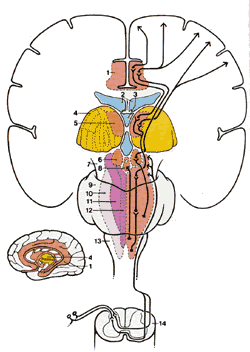 | Рис.2.8. Диаграмма показывает пути вдоль латерального спинно-мезэнцефалического тракта из спинного в головной мозг. 1.Лимбическая структура переднего мозга |
Спинно-цервикальный тракт (СЦТ)
СЦТ локализуется в дорсолатеральном канатике и восходит ипсилатерально, заканчиваясь в латеральном цервикальном ядре (рис.2.9). Затем волокна из латерального цервикального ядра проходят к контрлатеральному таламусу. Полагают, что так же, как и неоспинно-таламический путь, СЦП причастен к пространственному и временному различию болевых стимулов.
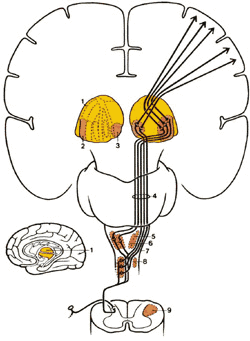 | Рис.2.9. Диаграмма показывает пути вдоль латерального спинно-цервикального тракта из спинного в головной мозг. 1. Таламус |
Нисходящие механизмы болевого контроля
| Рис.2.10. Структуры, вовлеченные в нисходящие механизмы контроля боли |
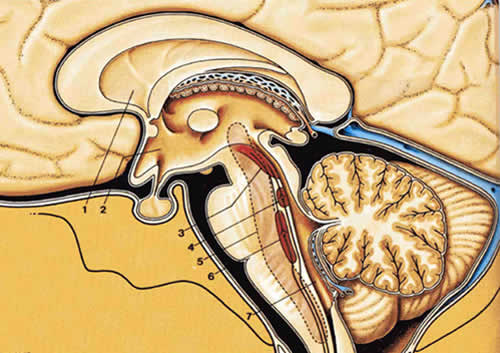 |
| 1.Правый латеральный желудочек 2.Третий желудочек 3.Область околоводопроводного серого вещества 4.Голубоватое место 5.Ретикулярная формация 6.Nucleus raphe magnus 7.Четвертый желудочек |
Висцеральные болевые пути
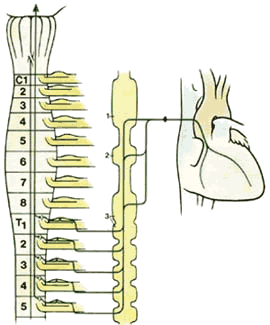 | Рис.2.11. Схематичная диаграмма афферентных симпатических путей от сердца. Заметим, что как и все афферентные нервы, клетки тел лежат в пределах ганглиев дорсальных корешков. 1.Верхний цервикальный ганглий |
Висцеральные афференты сходятся на нейронах дорсального рога так же, как и соматические ноцицептивные афференты. Повреждающие висцеральные стимулы передаются в головной мозг вместе с повреждающими соматическими стимулами посредством спинно-таламических путей. Считается, что висцеральная боль является результатом высокочастотного возбуждения висцеральных афферентов, которые обычно служат посредниками больше в гомеостатических, чем ноцицептивных функциях. Итак, висцеральные афференты могут возбуждаться на низких частотах в ответ на среднее расширение полого органа, но они возбуждаются на очень высоких частотах, когда имеет место чрезмерное растяжение. Эти высокие частоты активируют системы болевой проекции, начинающиеся в дорсальном роге. Результирующая боль, следовательно, воспринимается как происходящая из соматических областей, чьи нейроны проецируются на те же сегменты спинного мозга.
В таблице 2.3 перечислены внутренние органы и их сегментарная ноцицептивная нервная поддержка.
Таблица 2.3. Сегментарное распределение симпатических нервов
| Голова, шея, верхние конечности | Т1-5 |
| Сердце | Т1-5 |
| Легкие | Т2-4 |
| Пищевод | Т5-6 |
| Желудок | Т6-10 |
| Тонкий кишечник | Т9-10 |
| Толстый кишечник | Т11- L 2 |
| Печень и желчный пузырь | T7-9 |
| Поджелудочная железа и селезенка | T6-10 |
| Почки и мочеточник | T10- L 2 |
| Надпочечники | T 8- L 1 |
| Яички и яичники | T10-11 |
| Мочевой пузырь | T11- L 2 |
| Простата | T11- L 1 |
| Матка | T10- L 1 |
Необходимо хорошо различать иннервацию висцеральной структуры при принятии решения об уровне спинальной анестезии, который будет адекватным для хирургического вмешательства на этих структурах. Например, хотя кожная иннервация мошонки начинается с крестца, хирургия, проводимая на яичках, потребует спинальной анестезии, распространенной, по меньшей мере, до дерматома Т10, поскольку висцеральные афференты, ассоциированные с яичками, проходят с симпатическими волокнами, входя в центральную нервную систему на уровне Т10. В качестве другого примера рассмотрим кесарево сечение, которое требует среднегрудного уровня спинальной анестезии для уверенного обеспечения комфорта пациентки. Вероятно, это обусловлено тем фактом, что висцеральный и полосной перитонеум является огромной непрерывной структурой. Например, когда спинальная анестезия не распространена достаточно высоко, чтобы блокировать перитонеальные болевые волокна, входящие в спинной мозг в наиболее краниальной точке, результатом вытяжения (тракции) матки может стать перитонеальное раздражение и боль. Иногда, во время хирургическиъх вмешательств в абдоминальной области, несмотря на высокий уровень анестезии, блок остается неадекватным, поскольку пациент ощущает дискомфорт, тошноту и рвоту. Причиной является неудача в блокировании всех волокон, центрально передающих ощущения, включая блуждающий нерв.
Сердечно-сосудистые эффекты спинальной анестезии
Артериальная гипотония различной степени является обычным физиологическим свидетельством успешного спинального блока. В одном исследовании, которое включало более 11 000 случаев, гипотония наблюдалась у 38% пациентов. Основной причиной артериальной гипотонии во время спинальной анестезии является блокада волокон преганглионарного симпатического нерва (рис.1.31). Степень гипотонии связана с распространением агента местного анестетика в пределах субарахноидального пространства и расширением симпатической блокады (рис.2.12).
Рис.2.12. Сердечно-сосудистые изменения во время спинальной анестезии на различных сегментарных уровнях. Предполагается, что все пациенты положены горизонтально. ПС – периферическое сопротивление, ЧСС – частота сердечных сокращений, СВ – сердечный выброс, ЦВВ – центральный венозный возврат, C – сократимость, САД – среднее артериальное давление, НЕТ – изменения не наблюдались.



Например, низкий блок, ограниченный люмбальными и сакральными дерматомами, обуславливает небольшое изменения артериального давления или полное отсутствие таких изменений. Результатом высокой спинальной анестезии является симпатическая блокада волокон, иннервирующих сердце, а также контролирующих периферическое сосудистое русло и может, следовательно, вызвать выраженную гипотонию. Симпатическая блокада обычно распространяется на спинальные сегменты выше сенсорной блокады. Тогда как общепринято считать, что разница составляет 2 спинальных сегмента, новейшие исследования показывают большую вариабельность в этом отношении. Некоторые находят разницу в шесть сегментов, тогда как другие не показывают ни одного.
Физиологическая регуляция артериального давления
Артериальное давление определяется периферическим сопротивлением сосудов и сердечным выбросом (рис.2.13).
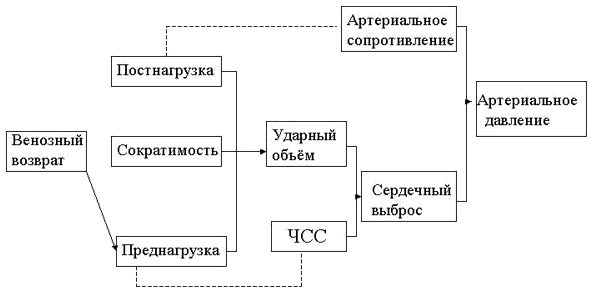 |
| Рис.2.13. Факторы, определяющие сердечную деятельность и артериальное давление. Представлено с разрешения Mark и Steel. |
Сердечный выброс это функция частоты сердечных сокращений и ударного объема. Ударный объем определяется внутренней сократимостью сердечной мышцы, сопротивлением, которое необходимо преодолеть сердцу (постнагрузка) и давлением наполнения в левом желудочке (преднагрузка), которое зависит от венозного возврата. Таким образом, изменения в артериальном давлении непосредственно связаны с изменениями или сосудистого сопротивления, или сердечного выброса, или и того и другого вместе. На сердечный выброс в свою очередь влияет изменения в преднагрузке, постнагрузке, сократимости миокарда и частоте сердечных сокращений. Периферическое сопротивление сосудов контролируется симпатической иннервацией артериол и локальной метаболической средой (рН ткани и крови, концентрациями СО2 и О2 ). Таким образом, артериальная гипотония во время спинальной анестезии связана с распространением симпатической блокады, которая влияет на периферическое сопротивление сосудов и сердечный выброс. Следовательно, величина сердечно-сосудистых изменений зависит от степени симпатического тонуса, который имеет место непосредственно перед спинальной инъекцией.
Периферическое сосудистое сопротивление
Симпатическая блокада, ограниченная нижней грудной и среднегрудной областью, приводит к вазодилятации в нижних конечностях с компенсаторной вазоконстрикцией в верхних конечностях. Таким образом, периферическое сосудистое сопротивление только слегка уменьшается, ограничивая степень гипотонии. По мере расширения блока вверх вазодилятация увеличивается, в то время как возможность компенсировать ее вазоконстрикцией уменьшается.
Сердечный выброс
Спинальная анестезия, которая распространяется только до среднегрудного уровня, не обуславливает значимых изменений в сердечном выбросе, если она проводится у пациента, находящегося в положении лежа или с опущенным головным концом (рис.2.12).
Однако, спинальная анестезия, распространяющаяся до верхнего грудного и шейного уровня, может стать причиной снижения сердечного выброса, обусловленного изменениями частоты сердечных сокращений, венозного возврата и сократимости миокарда.
Частота сердечных сокращений
Симпатические волокна, выходящие из Т1-Т5, контролируют частоту сердечных сокращений. Спинальная анестезия, которая блокирует эти волокна, обуславливает значимую сердечную симпатическую денервацию (рис.2.12). Поскольку в норме, присутствует симпатическая иннервация сердца, эта денервация является причиной умеренного снижения частоты сердечных сокращений. Выраженная брадикардия, наблюдаемая у некоторых пациентов во время высокой спинальной анестезии возможно, объясняется увеличенной вагальной активностью, которая встречается во время вазовагального синкопа или интракардиальных рефлексов.
Ударный объем
Ударный объем может уменьшаться во время высокой спинальной анестезии вследствие снижения венозного возврата и уменьшения сердечной сократимости (рис.2.12).
Венозный возврат
Венозный возврат у пациентов, перенесших симпатэктомию, очень сильно зависит от гравитации и, следовательно, положения. Симпатический контроль венозной системы является основным в поддержании венозного возврата и, следовательно, сердечно-сосудистого гомеостаза во время постуральных изменений. Вены формируют систему низкого давления и содержат наибольшую часть всего объема циркулирующей крови (приблизительно 70%). Когда спинальная анестезия вызывает симпатическую блокаду, этот контроль утрачивается, и венозный возврат становится полностью зависимым от гравитации. Если нижние конечности находятся ниже правого предсердия, денервированные вены будут расширяться, секвестрируя огромный объем крови. Возникающее в результате снижение венозного возврата, а, следовательно, и сердечного выброса, в сочетании с уменьшением периферического сопротивления могут стать причиной серьезной гипотонии.
Сократимость
Блокада симпатической иннервации сердца может стать причиной уменьшения инотропизма, приводящего к небольшому (около 15%) снижению сердечного выброса.
Синкопе
Клиницисты, имеющие опыт в проведении спинальной анестезии, распознают клиническую картину быстро развивающейся гипотонии, обычно сопровождающейся тошнотой и иногда рвотой. Могут иметь место кратковременная (моментальная) остановка сердца и потеря сознания, а также потоотделение и бледность во время восстановления. Это бывает только у пациентов, находящихся в сознании, и никогда не наблюдается у пациентов, которым дается сопутствующая общая анестезия. Сходство с вазовагальным обмороком является поразительным и блуждающий нерв, возможно, играет свою роль в этом случае.
Главной особенностью синкопе является внезапное падение венозного возврата, приводящее к значительному снижению сердечного выброса. Нормальным ответом на это является тахикардия и вазоконстрикция, призванные предотвратить венозную дилатацию.
Во время синкопе имеет место брадикардия, обусловленная быстрым снижением сердечного выброса. К счастью симпатическая активность восстанавливается и при своевременном устранении помех для венозного возврата (напр. таких, как поднятый вверх головной конец или IVC окклюзия), артериальное давление и частота сердечных сокращений увеличиваются. Если имеет место потеря сознания, восстановление часто сопровождается коротким эпилептиформным припадком. Это может быть спутано с токсической реакцией, хотя токсическое воздействие практически невозможно при малых дозах раствора местного анестетика, применяемых для спинальной анестезии.
Роль блуждающего нерва во время синкопе неясна. Синкопе, наблюдаемое у волонтеров после введения вазодилятаторов, все-таки имеет место, несмотря на тахикардию, обусловленную большими дозами атропина, введенного внутривенно. Было установлено, что интракардиальные рефлексы, которые предотвращают избыточную сократимость в не полностью заполненных желудочках, снижают как частоту сердечных сокращений, так и силу сокращения, когда венозный возврат радикально снижается. Полагают, что эти механизмы призваны предупредить механическое повреждение миокарда желудочка и снизить миокардиальное потребление кислорода.
Какими бы ни были механизмы, вовлеченные в синкопе, клиницист должен понимать, что нарушен именно венозный возврат и именно он подлежит восстановлению. Синкопе намного чаще встречается при поздних беременностях, чем у небеременных пациенток, поскольку IVC окклюзия может все-таки иметь место, несмотря на латеральный наклон или смещение матки. На ранней стадии развития гипотонии должен быть введен симпатический вазоконстриктор, предпочтительно с альфа- и бета-активностью, чтобы предотвратить атаку синкопе. С целью улучшения венозного возврата также следует быстро изменить положение пациента и, хотя кажется логичным использовать для лечения брадикардии атропин, от этого следует воздержаться, так как атропин не увеличивает венозный возврат и не влияет на артериальное давление во время синкопе. Сэр Томас Льюис, первым описавший вазовагальное синкопе и его лечение, указывал, что симпатический препарат, такой как эфедрин, обеспечивает как вазоконстрикцию, так и тахикардию, необходимые для быстрого восстановления.
Итак, причины гипотонии во время спинальной анестезии связаны с изменениями периферического сопротивления сосудов и сердечного выброса, которые зависят от изменения венозного возврата (рис.2.12). У большинства пациентов степень артериальной гипотонии обычно клинически не существенна, если венозный возврат поддерживается около нормального значения.
Факторы, влияющие на артериальную гипотонию, вызванную спинальной анестезией
Уровень симпатической блокады
В то время как более высокий блок ассоциируется с более высокой частотой гипотонии, невозможно предсказать степень гипотонии у конкретного пациента на основе уровня спинальной анестезии. Например, у некоторых пациентов гипотония развивается при нижних грудных уровнях анестезии, тогда как у других с уровнями анестезии в верхней грудной и нижней шейной области гипотония незначительна или совсем отсутствует (рис.2.14). Эти индивидуальные различия отражают различия во взаимоотношениях между уровнем симпатической блокады и уровнем сенсорной анестезии, а также степенью симпатического тонуса, имевшего место перед началом спинальной анестезии.
Положение пациента
На гипотонию во время спинальной анестезии существенным образом влияет положение пациента (рис.2.15).
| Рис.2.15. Диаграмма, показывающая влияние уровня блока и положения пациента на изменения различных сердечно-сосудистых показателей. ПС –периферическое сопротивление, СВ – сердечный выброс, САД – среднее артериальное давление, НЕТ – изменения не наблюдались. | |||
| ПС | СВ | САД | |
 | НЕТ | НЕТ | НЕТ |
 |  | 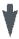 | 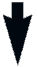 |
 | 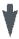 | НЕТ | 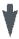 |
У пациентов, помещенных с приподнятым головным концом, во время спинальной анестезии может развиться тяжелая гипотония, обусловленная венозным застоем. Следовательно, пациенты во время проведения спинальной анестезии должны находиться в положении со слегка опущенным головным концом, так как это способствует поддержанию нормального венозного возврата.
Факторы, связанные с состоянием пациента
Степень гипотонии, развивающаяся при одном и том же уровне спинальной анестезии может варьировать в зависимости от физического состояния пациента, что связано с базальным симпатическим тонусом.
Гиповолемия может стать причиной серьезного угнетения сердечно-сосудистой системы во время спинальной анестезии. При гиповолемии давление крови поддерживается повышенным симпатическим тонусом, который обуславливает периферическую вазоконстрикцию. Симпатический блок, являющийся следствием спинальной анестезии, может привести к выраженной гипотонии. Следовательно, гиповолемия является относительным противопоказанием к спинальной анестезии. Однако, спинальная анестезия вполне приемлема, если при наличии гиповолемии нормоволемия может быть достигнута замещением объема.
Беременные особенно чувствительны к симпатической блокаде и гипотонии, связанными со спинальной анестезией. Это происходит из-за механической обструкции венозного возврата беременной маткой. Беременные должны быть помещены в положение со слегка опущенным головным концом (латеральную наклонную позицию) немедленно после вводной части спинальной анестезии, чтобы предотвратить аорто-кавальную компрессию. Нарушения кровообращения, связанные со спинальной анестезией у беременных обсуждаются более детально в следующих публикациях.
У пожилых пациентов, страдающих гипертензией и ишемической болезнью сердца, гипотония во время спинальной анестезии развивается чаще по сравнению с молодыми здоровыми пациентами.
Факторы, связанные с анестетиками
Степень гипотонии может зависеть от препарата, которым выполняется спинальная анестезия. Несмотря на достижение одинакового уровня сенсорной анестезии, бупивакаин вызывает меньше гипотоний, чем тетракаин. Разница в гипотонии может быть связана с большей симпатической блокадой В-волокон при применении тетракаина (как было продемонстрировано в исследованиях in vitro ) в сравнении с бупивакаином.
Баричность анестезиологического раствора также может влиять на гипотонию во время спинальной анестезии. Гипербарические растворы тетракаина и бупивакаина приводят к большей гипотонии, чем изобарические растворы. Эти различия, вероятно, связаны с различиями в уровнях сенсорного и симпатического блока. Гипербарические растворы распространяются дальше, чем изобарические или гипобарические растворы и обуславливают большую симпатическую блокаду.
Сопутствующая (вспомогательная) общая анестезия предположительно увеличивает частоту гипотоний во время спинальной анестезии. Известно, что это же происходит в случаях сочетания общей анестезии с эпидуральным блоком (более детально об этом – в следующих публикациях).
Суммируя сказанное, отметим, что изменения в сердечно-сосудистой системе во время спинальной анестезии являются нормальным физиологическим ответом и обусловлены блокадой симпатических волокон. Знание факторов, ответственных за изменение артериального давления позволяет избежать тяжелой гипотонии. Такое знание также значимо при выборе подходящей терапии для восстановления угнетенных функций сердечно-сосудистой системы.
Респираторные эффекты спинальной анестезии
Влияние спинальной анестезии на функцию дыхания связано с уровнем блокады проводимости. Распространение спинальной анестезии до среднегрудного уровня или ниже редко обуславливает значимые изменения легочных функций. Однако, спинальная анестезия, которая распространяется до верхнегрудных дерматомов может стать причиной нежелательных изменений функции дыхания (напр., у пациентов с хроническими обструктивными заболеваниями дыхательных путей). С другой стороны у пациентов, страдающих ожирением, может наступать улучшение оксигенации, предположительно за счет увеличения растяжимости грудной клетки, которое в свою очередь является следствием паралича абдоминальных мышц. Среднегрудная спинальная анестезия не имеет значительного влияния на дыхательный объем, частоту дыхания, минутную вентиляцию или Р CO 2 в конце выдоха. Однако остановка дыхания может случиться вследствие непреднамеренной тотальной спинальной анестезии в связи с параличом дыхательных мышц и/или ишемией головного мозга, развившейся вследствие тяжелой гипотонии.
Контроль дыхания
Спинальная анестезия, распространенная до середины верхних грудных отделов иногда вызывает диспноэ, которое не обусловлено слабостью дыхательных мышц. Диспноэ может происходить из дыхательных центров головного мозга, которые во время спинальной анестезии лишены афферентного ввода (сигналов) от абдоменальной области и грудной клетки. Стимул к дыханию в норме ингибируется этими проприоцептивными импульсами. Когда они заблокированы высокой спинальной анестезией, имеет место возросший стимул к дыханию, обусловленный снижением остаточного РСО2 в конце выдоха и увеличением вентиляторной реактивности на СО2. Пациент может воспринимать эти увеличенные вентиляторные стимулы как диспноэ.
Респираторные механизмы
Спинальная анестезия значимо не влияет на механизмы спокойного дыхания. Функциональная остаточная емкость снижается при минимальном изменении дыхательного объема. Измерения на вдохе давления, потока и объема указывают лишь на небольшое ухудшение функций инспираторных мышц даже при высоких грудных уровнях анестезии. Однако имеется взаимосвязь между уровнем спинальной анестезии и активностью экспираторных мышц. Высокие уровни спинальной анестезии приводят к заметному снижению максимального давления и скорости потока на выдохе. Снижение пиковой объемной скорости непосредственно зависит от направления распространения анестезии, которое получается выше, когда применяются гипербарические растворы. Влияние спинальной анестезии на функции мышц вдоха и выдоха связаны с тем, что при вдохе и выдохе вовлекаются различные мышцы. Главной мышцей вдоха является диафрагма. Другие мышцы вдоха включают внешние межреберные и грудино-ключично-сосцевидные мышцы. Диафрагма иннервируется спинномозговыми нервами С3-5. Таким образом, даже высокие грудные уровни не подавляют сжатие диафрагмы. В действительности функция диафрагмы может быть улучшена во время спинальной анестезии, поскольку сила, которую диафрагма должна развить, чтобы сместить внутренние органы абдоминальной области во время вдоха, уменьшается из-за паралича абдоминальных мышц. Диафрагма, следовательно, компенсирует паралич внешних межреберных мышц. На добавочные мышцы вдоха оказывает влияние лишь спинальная анестезия, достигающая верхних шейных нервов.
У здорового человека при спокойном дыхании выдох пассивен, но во время гипервентиляции он становится активным. Главными экспираторыми мышцами являются абдоминальные мышцы. Внутренние межреберные мышцы также участвуют в выдохе. Активные экспираторные усилия необходимы для эффективного кашля. Пациенты с тяжелым хроническим легочным заболеванием могут вовлекать экспираторные мышцы во время спокойного дыхания из-за увеличенного сопротивление выдыхаемому воздушному потоку и снижения эластичного ответа легких. Следовательно, у этих пациентов может развиться дыхательная недостаточность во время спинальной анестезии.
Регионарная анестезия, включающая эпидуральную или спинальную анестезию, часто предлагается как предпочтительная по сравнению с общей анестезией для пациентов, страдающих астмой. Поскольку пациентам-астматикам требуются активные усилия на выдохе, высокие уровни спинальной анестезии могут теоретически ухудшить эту функцию. Однако, исследования пациентов с хроническими заболеваниями легких указывают, что изменения респираторных механизмов в связи со спинальной анестезией не превышают допустимых порогов. Например, спинальная анестезия не обуславливает значительного изменения форсированной жизненной емкости легких у пациентов, имеющих заболевания легких, ни в положении на спине, ни в литотомическом положении. В действительности форсированный объем выдоха даже слегка увеличивается в литотомическом положении. В противоположность этому у здоровых людей положение влияет на функцию выдоха. Например, форсированная жизненная емкость легких снижается на 10% в положении на спине и 15% в литотомическом положении, тогда как объем форсированного выдоха снижается на 6% и 7% в этих позициях. Улучшение форсированного объема выдоха во время спинальной анестезии у пациентов с легочными заболеваниями является свойством «вспомогательного возврата» диафрагмы, обусловленного весом внутренних органов абдоминальной области во время выдоха.
Газообмен в легких
Низкие уровни спинальной анестезии незначительно влияют на газообмен. Потребление кислорода и продукция углекислого газа снижаются на 10-20% вследствие спинальной анестезии. Однако, если спинальная анестезия распространяется не выше среднегрудных уровней, такие показатели как минутная вентиляция легких, дыхательное мертвое пространство, альвеолярно-артериальная разница кислорода или углекислого газа, внутрилегочный шунт или напряжение газа в артериальной крови изменяются незначительно или совсем не имеют значимых изменений.
Исследования пациентов с ожирением указывают на то, что значения газов крови при спинальной анестезии у них не изменяются или даже фактически улучшаются. Субарахноидальная блокада, распространяющаяся до Т4-10 у пациентов, на 47%превышающих идеальную массу тела, увеличивала среднее напряжение кислорода в артериальной крови примерно на 1 кРа, тогда как напряжение углекислого газа и рН артериальной крови не изменялись. Улучшение растяжимости грудной клетки вследствие паралича абдоминальных мышц во время спинальной анестезии считается ответственным за улучшение вентиляционно-перфузионного соотношения у таких пациентов с ожирением. В контрольной группе пациентов с нормальным весом никаких значимых изменений в значениях газов крови не наблюдалось.
Хотя минимальные изменения дыхательных функций имеют место при среднегрудных уровнях спинальной анестезии, необходимо помнить, что предоперационная и интраоперационная седация может привести к нарушениям легочного газообмена во время спинальной анестезии. Например, у некоторых пациентов пероральный прием темазепама приводит при спинальной анестезии к снижению насыщения кислородом артериальной крови. В добавление к этому, у многих пациентов, которым вводится внутривенная седация, как дополнение к спинальной анестезии, наблюдается десатурация. Таким образом, при вводе седативных препаратов по возможности всегда должен осуществляться мониторинг оксигенации с помощью пульсоксиметрии.