что такое неопластическое образование
Библиотека
Основные свойства неопластической клетки и базовые механизмы их возникновения
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
1.1. Характерные признаки опухолевой клетки
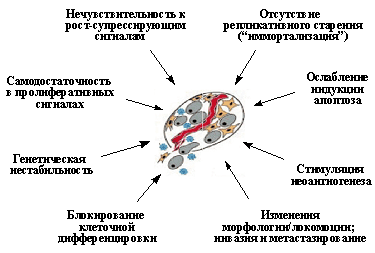
Важнейшие свойства неопластической клетки, приобретаемые в ходе опухолевой прогрессии и обеспечивающие злокачественный рост. (Объяснения в тексте).
Вторым важнейшим приобретенным свойством неопластических клеток является их пониженная чувствительность к рост-ингибирующим сигналам. Как известно, в организме существует множество антипролиферативных сигналов, поддерживающих определенное число клеток в каждой из тканей. Такие сигналы генерируются как секретируемыми растворимыми факторами (цитокинами), так и взаимодействиями клеток с внеклеточным матриксом и друг с другом. Классическим примером здесь является так называемое контактное торможение размножения клеток в культурах in vitro. (Рис. 2В).
Нормальные клетки, например фибробласты, размножаются до тех пор, пока не возникнет плотный монослой и не установятся межклеточные контакты. В отличие от этого, трансформированные клетки при возникновении межклеточных контактов не останавливают свою пролиферацию, а продолжают делиться, наползать друг на друга и образовывать очаги многослойного роста.
А) Пониженная зависимость от факторов роста 
Б) Способность размножаться без прикрепления к внеклеточному матриксу 
В) Отсутствие контактного торможения размножения 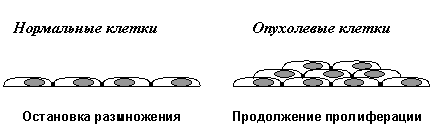
Рис.2. Характерные признаки неопластических клеток in vitro (объяснения в тексте)
Еще одним важнейшим свойством опухолевых клеток является отсутствие репликативного старения, или приобретение бессмертия (иммортализация). Как известно, существует механизм, ограничивающий число делений большинства типов зрелых клеток человека. Так, в культурах человеческих фибробластов in vitro после 60-80 делений (так называемое число Хейфлика) наблюдается необратимая остановка размножения клеток и их постепенная гибель. Между тем, чтобы образовать из одной клетки-родоначальницы сначала опухоль, а затем и метастазы, в условиях жесткого давления со стороны организма, когда многие опухолевые клетки погибают, может потребоваться большее число делений. И, действительно, в опухолевых клетках наблюдается нарушение работы такого «счетно-ограничительного» механизма контроля репликации.
Следующим важным свойством неопластических клеток является ослабление индукции в них апоптоза. Апоптоз представляет собой активный механизм клеточного самоубийства, поддерживающий в организме определенное число клеток и, кроме того, защищающий его от накопления аномальных клеточных вариантов. Он вызывается как физиологическими сигналами (связыванием специфических киллерных цитокинов со своими рецепторами), так и различными внутриклеточными повреждениями или неблагоприятными условиями, в частности нарушениями структуры ДНК, нехваткой ростовых факторов, гипоксией и т.д. Уход от апоптоза резко повышает жизнеспособность неопластической клетки, делает ее менее чувствительной к факторам противоопухолевого иммунитета и терапевтическим воздействиям.
К важнейшим приобретенным свойствам опухолевых клеток принадлежит и их способность стимулировать неоангиогенез, т.е. формировать новые кровеносные и лимфатические сосуды из эндотелиальных клеток предсуществующих окружающих мелких сосудов. Это необходимое условие для дальнейшего роста опухолевого узелка, достигшего в диаметре 2-4 мм. В ином случае клетки в центре опухоли, не получая кислород и питательные вещества, будут погибать.
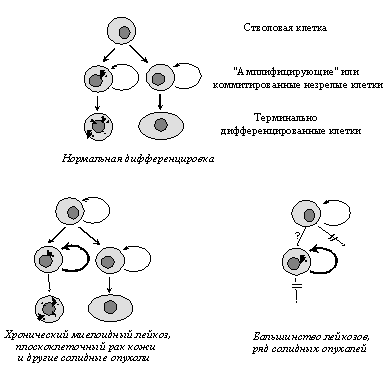
Для многих опухолевых клеток характерны и нарушения клеточной дифференцировки, т.е. образования специализированных типов клеток, синтезирующих специфические белки. Особенно ярко это проявляется в гемобластозах, новообразованиях из кроветворных тканей, при которых их клетки оказываются как бы замороженными на той или иной стадии созревания. Общепринятым является представление, согласно которому меньшая зрелость лейкозных клеток является не следствием дедифференцировки зрелых клеток, претерпевших неопластическую трансформацию, а отражает их происхождение из незрелых клеток, в которых блокированы процессы дальнейшей дифференцировки. Следует заметить, однако, что это свойство не является универсальным: во многих типах опухолей наблюдается сохранение способности к дифференцировке, причем в отличие от лейкозов созревание клеток не препятствует приобретению злокачественного фенотипа. Примерами этого могут служить плоскоклеточный ороговевающий рак кожи и высокодифференцированные аденокарциномы толстой кишки, происходящие из незрелых клеток, которые сначала несколько раз делятся, а затем дифференцируются (Рис. 3).
Происхождение из незрелых клеток не противоречит представлению о том, что опухолевые клетки в ходе прогрессии могут претерпевать определенную дедифференцировку, утрачивая в первую очередь те дифференцировочные белки, отсутствие которых придает клеткам селективные преимущества (например, рецепторы стероидных гормонов в раках молочной железы и т.д.).
Рис.3. Модели, объясняющие происхождение новообразований из незрелых клеток определенной стадии дифференцировки, в которых либо сохранена (внизу слева), либо блокирована (внизу справа) способность к дальнейшему созреванию.
Что такое неопластическое образование
Это комплексное исследование, включающее в себя цитологию и определение уровня экспрессии PTEN клетками эндометрия. Проводится в целях раннего выявления предраковых и онкологических заболеваний матки.
PTEN-иммуногистохимия с моноклональными антителами, иммуногистохимическая оценка экспрессии PTEN.
Жидкостная цитология + иммуноцитохимическое исследование.
Какой биоматериал можно использовать для исследования?
Аспират из полости матки.
Общая информация об исследовании
Патологические процессы эндометрия являются одной из наиболее актуальных проблем современной гинекологии ввиду их высокой частоты встречаемости (30-50 % среди случаев гинекологической заболеваемости), возможности рецидивирования и ракового перерождения (малигнизации). Гиперпластические процессы эндометрия (ГПЭ) в ряде случаев являются предвестниками неопластической трансформации клеток и развития аденокарциномы. В структуре злокачественных новообразований у женщин рак эндометрия (РЭ) занимает второе место после рака молочной железы.
Результаты исследований последних лет показывают, что в основе злокачественного перерождения клеток лежат мутационные повреждения генов, контролирующих их рост, пролиферацию, дифференцировку и апоптоз (гибель). В регуляции апоптоза участвует множество различных факторов, в том числе протоонкоген семейства bcl-2, ген р-53, PTEN, которые рассматриваются как биологические маркеры запрограммированной клеточной гибели.
PTEN (Phosphatase и Tensin Homologue), также называемый MMAC1, расположен на хромосоме 10q23. Белковый продукт гена PTEN (липидная фосфатаза) необходим для нормальной физиологической гибели (апоптоза) стареющих и поврежденных клеток организма. PTEN хорошо экспрессируется в эндометрии как в пролиферативную, так и секреторную фазы. Он является опухоль-супрессорным геном, участвующим в развитии 24 различных типов опухолей, в том числе и злокачественных заболеваний женской репродуктивной системы.
Анализ мутаций PTEN (снижение уровня экспрессии) выявил соматическую инактивацию этого гена в 30-50 % случаев эпителиальных злокачественных опухолей эндометрия, поставив ее на лидирующее место среди наиболее частых молекулярно-генетических нарушений при раке эндометрия (РЭ). Чаще всего в таком случае злокачественные опухоли относятся к I патогенетическому варианту рака эндометрия, который наиболее характерен для ранее не рожавших и имеющих избыточную массу тела женщин. Представлены опухоли высокодифференцированными аденокарциномами с поверхностной инвазией и благоприятным прогнозом.
Мутации PTEN обнаруживаются более чем в 20 % гиперплазий эндометрия (как с атипией, так и без нее), а также в 30-80 % эндометриоидных карцином, указывая на то, что нарушения в PTEN происходят на относительно ранних стадиях онкогенеза эндометрия. Кроме рака эндометрия, отсутствие экспрессии PTEN также является ранним признаком эндометриальной интраэпителиальной и цервикальной интраэпителиальной неоплазий (EIN и CIN).
Замечено, что у женщин с метаболическим синдромом (комплексом изменений, связанных с нарушением обмена веществ) часто отмечается низкая экспрессия PTEN на этапе доброкачественной патологии эндометрия. Отличительной особенностью в данном случае является увеличение частоты рецидивов со снижением экспрессии PTEN при ГПЭ без атипии и эндометриальной интраэпителиальной неоплазии. Также для таких пациенток характерна высокая частота выявления EIN и РЭ, неэффективность гормонального лечения.
Этот метод имеет высокую чувствительность (93 %) и специфичность (100 %), а также является перспективным тестом для раннего выявления предраковых состояний и онкологических заболеваний эндометрия. Также он признан мировым стандартом в скрининге рака шейки матки.
Кроме этого, позволяет выявить группы риска по развитию злокачественного перерождения эндометрия и определить правильную тактику ведения пациенток.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Результат исследования состоит из двух частей: цитограммы и степени выраженности экспрессии PTEN. По совокупности этих данных дается врачебное заключение.
Экспрессия PTEN оценивается по степени интенсивности окрашивания ядер клеток:
Отсутствие или значительное снижение уровня экспрессии PTEN у больных с гиперплазией эндометрия, особенно на фоне метаболического синдрома, прогностически крайне неблагоприятно и с высокой долей вероятности свидетельствует о повышенном риске развития рака эндометрия.
Мутации PTEN (снижение уровня экспрессии) обнаруживаются на относительно ранних стадиях онкогенеза эндометрия.
Кто назначает исследование?
Гинеколог, онколог, цитолог.
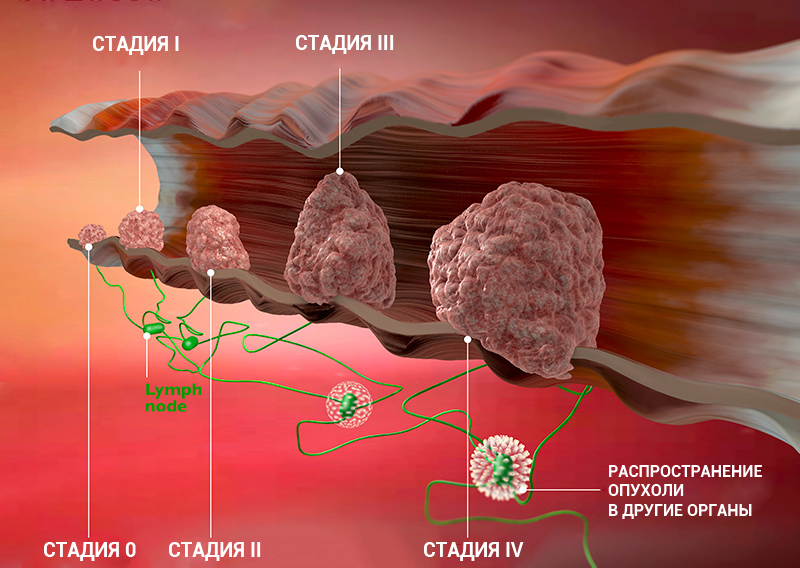
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Фолликулярная неоплазия щитовидной железы (лекция)
Полный текст:
Аннотация
Узловые образования щитовидной железы выявляются примерно у 4–7% лиц, проживающих в регионах с нормальной йодной обеспеченностью. В регионах йодного дефицита распространенность узлового зоба значительно выше, особенно у женщин старше 40 лет, у которых она может превышать 30%.
Ключевые слова
Для цитирования:
Трошина Е.А., Мазурина Н.В., Абесадзе И.А., Юшков П.В., Егорычева Е.К. Фолликулярная неоплазия щитовидной железы (лекция). Проблемы Эндокринологии. 2006;52(1):22-25. https://doi.org/10.14341/probl200652122-25
For citation:
Troshina E.A., Mazurina N.V., Abesadze I.A., Yushkov P.V., Yegorycheva Y.K. Follicular thyroid neoplasia (a lecture). Problems of Endocrinology. 2006;52(1):22-25. (In Russ.) https://doi.org/10.14341/probl200652122-25
Узловые формы зоба представляют собой весьма гетерогенную патологию щитовидной железы как с позиции морфологии, так и в плане клинического течения: речь может идти о солитарных или множественных коллоидных узлах либо об опухолевых образованиях на фоне различного функционального состояния щитовидной железы. Анализируя данные разных авторов, можно сделать заключение о том, что злокачественные опухоли встречаются примерно в 5% случаев всех узловых образований’щитовидной железы.
При обнаружении в щитовидной железе пальпируемых узловых образований одной из основных целей обследования является исключение рака щитовидной железы. Дифференциальный диагноз доброкачественных и злокачественных узловых образований требует проведения комплексного обследования, так как ни один из используемых на сегодняшний день методов не обладает 100% специфичностью и чувствительностью в отношении диагностики рака щитовидной железы.
Единственным методом морфологической диагностики узловых образований щитовидной железы является тонкоигольная аспирационная биопсия (ТАБ) с последующим цитологическим исследованием. ТАБ щитовидной железы позволяет поставить точный морфологический диагноз в 70—85% случаев. Морфологический материал, полученный при ТАБ, принято делить на 4 категории: доброкачественные изменения; злокачественные изменения; изменения, подозрительные на злокачественные; недостаточный для цитологического исследования материал.
Доброкачественные изменения включают в себя коллоидный зоб, тиреоидиты, кисты, нормальную ткань щитовидной железы. Злокачественные изменения обнаруживают в 4—5% случаев. К этой группе относят папиллярный рак (самая частая злокачественная опухоль щитовидной железы), медуллярный рак, лимфомы и метастазы опухолей другой локализации.
В группу изменений, подозрительных на злокачественные, или неопределенных изменений на цитологическом этапе включают фолликулярные и гюртлеклеточные опухоли щитовидной железы. Выделение этой группы является следствием ограниченных возможностей ТАБ в диагностике этих новообразований щитовидной железы. На основании цитологического исследования не представляется возможным отличить фолликулярную аденому от фолликулярного рака. Именно поэтому их объединяют термином «фолликулярная неоплазия».
Фолликулярная неоплазия: определение, классификация, эпидемиология
Фолликулярная неоплазия — это группа новообразований, цитологическая картина которых характеризуется преобладанием в пунктате фолликулярных структур с полиморфизмом или без него.
Распространенность фолликулярной неоплазии по данным ТАБ составляет 10—15% среди всех узловых образований щитовидной железы. В подавляющем большинстве случаев речь идет о доброкачественных образованиях. Тем не менее примерно в 1 из 10—15 случаев фолликулярная неоплазия оказывается злокачественным образованием (высокодифференцированным фолликулярным раком).
Фолликулярные образования считаются доброкачественными, если отсутствует инвазия в сосуды и капсулу опухоли. Таким образом, гистологическое исследование является решающим в дифференциальной диагностике фолликулярных опухолей щитовидной железы.
Что же служит критерием постановки диагноза? Инвазия капсулы, инвазия в вены и рост за пределы капсулы — это диагностические критерии фолликулярного рака щитовидной железы. Критерием сосудистой инвазии является исключительно прорастание вен, потому что разрастание опухоли по капиллярам в веществе опухоли не имеет диагностического и прогностического значения.
Для оценки инвазивности роста опухоли требуется исследование нескольких срезов ее периферийных частей. Очевидно, что оценить инвазию сосудов или капсулы невозможно при цитологическом исследовании. Подобные проблемы появляются и при интраоперационной оценке замороженных срезов.
Фолликулярная аденома: морфология, тактика лечения, прогноз
Фолликулярная аденома определяется как доброкачественная инкапсулированная опухоль из клеток фолликулярного эпителия, чаще единой структуры, состоящая из мономорфных укрупненных тироцитов. Аденомы чаще всего являются солитарными, хотя возможны и первично-множественные опухоли.
Согласно гистологической классификации опухолей щитовидной железы (ВОЗ, 1988), терминология, используемая для отображения структуры фолликулярных аденом, включает в себя следующие варианты: нормофолликулярная, макрофол- ликулярная, микрофолликулярная (фетальная), трабекулярная и солидная (эмбриональная).
Микрофолликулярная аденома может иметь различные признаки. Клетки могут формировать хорошо дифференцированные фолликулы, схожие с нормальными фолликулами, или иметь трабекулярный характер с рудиментарными фолликулами или без них.
Изредка фолликулярная аденома содержит клетки Бишара, которые представляют собой цитологически атипичные клетки с огромным гипер- хромным ядром, иногда находят клетки с множественными ядрами. Эти изменения также доброкачественные.
Методом выбора оперативных вмешательств при фолликулярной аденоме являются резекция щитовидной железы или гемитиреоидэктомия. Прогноз благоприятный.
Фолликулярный рак: морфология, тактика лечения, прогноз
Фолликулярный рак составляет 2—5% всех опухолей щитовидной железы. Фолликулярная карцинома чаще представляет собой единичную опухоль щитовидной железы, более или менее инкапсулированную. Отмечают склонность фолликулярного рака к прорастанию кровеносных сосудов (но не лимфатических).
В зависимости от степени прорастания окружающих тканей выделяют опухоли с минимальной (инкапсулированные) или со значительной инвазией. Это подразделение имеет большое клиническое значение, так как прогноз хуже при значительной инвазии. В целом нет затруднения в подразделении двух гистологических типов.
Более 50% случаев всех фолликулярных опухолей составляют опухоли с минимальной инвазией. Макроскопически фолликулярный рак с минимальной инвазией неотличим от фолликулярной аденомы. Диагноз злокачественности базируется на наличии сосудистой инвазии и/или инвазии всей толщины капсулы. Часто необходимо исследование множества срезов с периферии опухоли для исключения или подтверждения инвазии. Цитологически опухоли с минимальной инвазией практически неотличимы от доброкачественных аденом и цитологическое исследование не в состоянии дифференцировать злокачественное повреждение от доброкачественного. Срочное гистологическое исследование замороженных срезов, даже из множества различных участков узла, также не всегда позволяет поставить правильный диагноз. В случаях со значительной инвазией видна инфильтрация ткани щитовидной железы, поэтому возникает меньше диагностических трудностей.
При микроскопическом исследовании степень дифференцировки опухоли может варьировать. Как минимально, так и значительно инвазивный фолликулярный рак морфологически вариабелен — от дифференцированных с хорошо сформированными фолликулами, содержащими коллоид, до плохо дифференцированных с солидным характером роста. Для определения прогноза важно принимать во внимание как характер инвазии, так и степень дифференцировки, так как близкой корреляции между этими двумя показателями нет.
Диссеминация фолликулярного рака происходит гематогенным путем, чаще всего опухоль метастазирует в кости, легкие, мозг и печень. Гематогенные метастазы часты при варианте с выраженной инвазией и редко встречаются при минимальной инвазии.
Методом лечения при фолликулярном раке является тиреоидэктомия с последующей радиойод- терапией. Пациентам, оперированным по поводу предположительно доброкачественных опухолей, оказавшихся при гистологическом исследовании фолликулярным раком (как правило, с минимальной инвазией), рекомендовано повторное оперативное вмешательство — тиреоидэктомия. Аргументами в пользу радикального оперативного вмешательства являются снижение риска рецидива; лучшая выживаемость при размерах опухоли более 1,5 см; возможность проведения радиоабляции |31 1 остаточной тиреоидной ткани; возможность использовать тиреоглобулин в качестве маркера рецидива заболевания.
Прогностические факторы при фолликулярном раке
Больные фолликулярным раком со значительным инвазивным ростом имеют менее благоприятный прогноз. У пациентов с инкапсулированными фолликулярными опухолями щитовидной железы отмечается лучшая выживаемость (10-летняя более 80%). Ряд исследователей оценивали клинические и морфологические факторы, ассоциированные с неблагоприятным исходом. К ним относятся пожилой возраст на момент постановки диагноза, мужской пол, рост за пределы щитовидной железы или метастазирование на момент постановки диагноза, продолженная инвазия в сосуды, солидная или трабекулярная структура, анеуплоидные популяции клеток. Факторы неблагоприятного прогноза представлены в таблице.
Выраженная сосудистая инвазия, без сомнения, является фактором неблагоприятного прогноза. Некоторые гистологические варианты фолликулярного рака, такие как гюртлеклеточный, также часто имеют худший прогноз. Такие опухоли, как правило, менее дифференцированы и демонстрируют низкую способность к захвату радиоактивного йода. Между степенью сосудистой инвазии и степенью дифференцировки опухоли не всегда прослеживается четкая корреляция, поэтому эти свойства опухоли должны учитываться независимо друг от друга.
Распространение опухоли за пределы капсулы щитовидной железы также является независимым фактором неблагоприятного прогноза. Прорастание опухоли за пределы железы наблюдается в 3— 5% случаев фолликулярного рака. Такие пациенты подвергаются большему риску рецидивов, развитию отдаленных метастазов и смерти, связанной с опухолевым процессом.
Факторы неблагоприятного прогноза при фолликулярном раке щитовидной железы (М. Schlumberger, F. Pacini, 1999)
Индивидуальные характеристики пациента
Характеристики опухоли
Большой размер опухоли
Распространение опухоли за пределы капсулы щитовидной железы
Наличие отдаленных метастазов
Метастазы в лимфатические узлы
Тактика лечения
Нерадикальная операция (резекция щитовидной железы)
После тиреоидэктомии не проведена радиойодтерапия
Повышение уровня тиреоглобулина через 3 мес после операции
Метастазы в регионарные лимфатические узлы при фолликулярном раке щитовидной железы наблюдаются в 15—20% случаев, т. е. гораздо реже, чем при папиллярном раке. Данные о прогностическом значении регионарных метастазов довольно противоречивы. При анализе результатов подобных исследований важно учитывать, что прогноз в каждом индивидуальном случае зависит не только от наличия метастазов, но и от их количества, размеров и инвазивности роста.
По мнению многих ведущих специалистов в области лечения рака щитовидной железы, наличие отдаленных метастазов на момент постановки диагноза определяет самый неблагоприятный прогноз при фолликулярном раке. Смертность, связанная с опухолевым процессом, варьирует в зависимости от длительности наблюдения и составляет приблизительно 70% в течение 15 лет.
Потеря дифференцировки опухолевыми клетками сопровождается снижением экспрессии специфических генов, таких как ген рецептора ТТГ, Na + / Г-симпортера, тиреоглобулина, тиреоидной пероксидазы. Снижение экспрессии этих генов означает снижение или даже потерю способности к захвату радиоактивного йода, что имеет принципиальное значение при лечении отдаленных метастазов.
Рецидивы рака щитовидной железы и развитие отдаленных метастазов могут рассматриваться как следствие поздней диагностики или агрессивного биологического поведения опухоли. К сожалению, еще одной причиной может быть неадекватное хирургическое вмешательство. Рецидив или метастазирование могут произойти в течение 5 лет после операции, хотя известны случаи метастазирования через много лет после хирургического вмешательства.
Многие специалисты признают, что радикальное хирургическое лечение является решающим фактором благоприятного исхода. Результаты многих исследований свидетельствуют о том, что проведение тиреоидэктомии по сравнению с резекцией щитовидной железы значительно снижает риск рецидива у всех пациентов и повышает выживаемость у пациентов с плохим прогнозом.
Радиойодтерапия с целью полной деструкции остатков тиреоидной ткани после хирургического вмешательства улучшает прогноз, снижая риск рецидива у пациентов с опухолями более 1,5 см и при распространении опухоли за пределы капсулы щитовидной железы. При небольшом размере опухоли, радикальном объеме хирургического вмешательства и отсутствии других неблагоприятных факторов прогноз благоприятный и лечение радиоактивным йодом не создает дополнительных преимуществ, хотя и должно быть проведено. В любом случае полная деструкция тиреоидных остатков повышает диагностическую значимость сканирования со 131 1 и исследования уровня сывороточного тиреоглобулина.
Современные возможности молекулярной диагностики при фолликулярной неоплазии
Достижения молекулярной диагностики делают возможным дополнительное исследование как цитологического, так и операционного материала, позволяющее в ряде случаев проводить дифференциальный диагноз между доброкачественными и злокачественными образованиями. Основные требования, которые предъявляются к молекулярным маркерам в клинической практике, могут быть сформулированы следующим образом.
В научной литературе описывается не менее 50 различных молекулярных маркеров, исследованных у пациентов с узловыми образованиями щитовидной железы. Однако только 4 из многочисленных маркеров (тиреоидная пероксидаза, теломераза, галектин-3 и RET/PTC) оказались полезными в клинической практике и продемонстрировали высокую чувствительность и специфичность при исследовании пунктатов, подозрительных на злокачественные; кроме того, эти маркеры могут определяться практически в любой морфологической лаборатории.
Таким образом, дифференциальная диагностика фолликулярных опухолей щитовидной железы остается одной из актуальных проблем современной эндокринологии и онкологии. Проведение иммуногистохимических исследований маркеров злокачественного роста в ткани щитовидной железы может позволить усовершенствовать дифференциальную диагностику фолликулярных образований щитовидной железы не только при гистологическом исследовании, но и на цитологическом этапе.