что такое нарушение функции кроветворения
Апластическая анемия
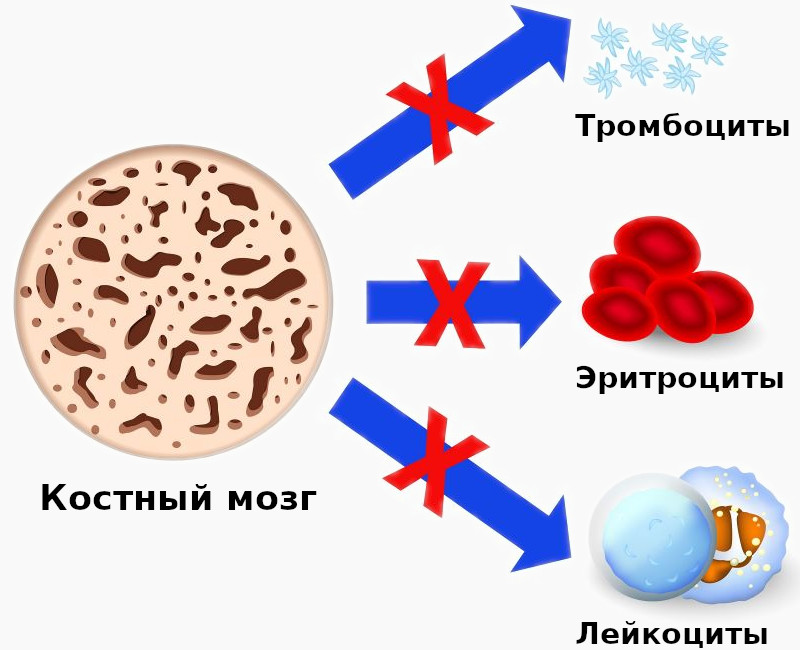
Апластическая анемия – серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Пройти диагностику и лечение апластической анемии в Москве предлагает отделение гематологии ЦЭЛТ. Наша многопрофильная клиника одна из первых в РФ начала деятельность на рынке платных медицинских услуг и успешно продолжает её уже третье десятилетие. В отделении гематологии ведут приём ведущие отечественные специалисты, в арсенале которых имеется современная лечебно-диагностическая база, позволяющая точно ставить диагноз и проводить лечение в соответствии с международными стандартами. Стоимость услуг доступна в нашем прайс-листе, который мы регулярно обновляем. Во избежание недоразумений просим Вас уточнять цифры у операторов нашей информационной линии: +7 (495) 788 33 88.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х10 9 /л, тромбоцитов менее 20,0х10 9 /л. |
| Тяжёлая | Гранулоцитов менее 0,5х10 9 /л, тромбоцитов менее 20,0х10 9 /л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л. |
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
Апластическая анемия: осложнения
Отсутствие лечения апластической анемии может привести к летальному исходу из-за развития таких осложнений, как:
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня – 20-30 г/л, наблюдается агранулоцитоз – снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов – всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов – повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани – 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
Обзор онкологических заболеваний крови
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕАНИЯ КРОВИ
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний.
Предлагаем Вашему вниманию краткий, но очень подробный обзор онкологических заболеваний кроветворной системы.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Филиалы и отделения, где лечат злокачественные заболевания крови
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения опухолей
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
тел: 8 (494) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения злокачественных новообразований
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
тел: 8 (484) 399 – 31-30
Каждая новая клетка проходит строго определенные этапы своего развития, результатом которых является изменение ее внешнего вида и свойств. Если на каком-либо этапе в силу разных повреждающих причин происходит «замирание» одной единственной клетки (=блок дифференцировки), а затем эта клетка начнет деление и новые клетки будут также лишены возможности дальнейшего развития, то исходом этого процесса будет накопление не завершивших все необходимые этапы дифференцировки клеток (=опухолевого клона), что собственно и будет обозначать начало гемобластоза. Интересно, что злокачественные клетки крови в той или иной мере сохраняют морфологические, иммунологические свойства и «биологическое поведение» своих нормальных аналогов.
Существующие классификационные системы опухолей лимфоидной и кроветворной тканей основываются на детальной иммуноморфологической характеристике опухоли, подкрепленной в ряде случаев дополнительной информацией о генетической и молекулярной ее структуре.
Иммунофенотипирование при лейкозе или лимфоме
– необходимый диагностический этап при остром лейкозе или лимфоме. Это комплексная характеристика типа клеток. С использованием иммунологических методов возможно выявление особых структур, антигенов, на поверхности клетки (как правило, белковых молекул, так называемых CD (claster differentiation), кластер дифференцировки). Комплекс данных антигенов составляет иммунологический фенотип (иммунофенотип) на основании которого каждая клетка может быть отнесена к определенному классу: негемопоэтическая, гемопоэтическая, миелоидная, лимфоидная, T-клетка, В-клетка, клетка-предшественник. В соответствии с иммунофенотипом определяется иммунологический вариант заболевания, что является принципиальным для выбора правильной терапии на этапе диагноза.
Цитогенетический метод исследования крови
в настоящее время входит в перечень необходимых диагностических мероприятий при большинстве онкогематологических заболеваний. Данный метод позволяет:
• Провести точную диагностику большинства опухолевых заболеваний системы крови.
• Определить прогноз заболевания.
• Использовать таргетную (точечную, прицельную терапию) при обнаружении определенных цитогенетических перестроек.
В основе развития онкогематологических заболеваний лежат перестройки (поломки) генетического материала в клетках кроветворной и лимфоидной тканей. Эти события приводят к трансформации нормальных кроветворных клеток в опухолевые. Они не затрагивают другие клетки организма (в т.ч. половые клетки). По этой причине онкогематологические заболевания, за редким исключением, не передаются по наследству. Хромосомные перестройки можно обнаружить при помощи стандартного цитогенетического исследования или более чувствительного метода – интерфазного анализа с использованием зондов (маркеров) к конкретным участкам хромосом (метод FISH). В ряде случаев цитогенетические изменения могут происходить на субмикроскопическом уровне (т.к называемые точечные мутации). Такие изменения возможно детектировать только с помощью ультратонких высокочувствительных методов молекулярного исследования (метод ПЦР- полимеразная цепная реакция).
В ходе больших международных исследований было обнаружено различное течение онкогематологических заболеваний в зависимости от обнаружения тех или иных хромосомных перестроек или мутаций генов. Известны изменения, ассоциированные с благоприятным, промежуточным или неблагоприятным агрессивным течением заболевания. Таким образом, молекулярно-цитогенетические характеристики являются предикторами прогноза. На этой основе при различных онкогематологических заболеваниях на ряду с другими признаками разрабатываются программы терапии разной интенсивности (риск-адаптированная терапия).
Среди опухолей кроветворной и лимфоидной тканей различают лимфомы и лейкозы. Исторически сложилось разделение лимфоидных опухолей (лимфом) на лимфому Ходжкина и неходжкинские лимфомы. Неходжкинские лимфомы в зависимости от клеточной линии подразделяются на В-клеточные, Т- и NK-клеточные опухоли. На сегодняшний день на основании морфоиммунологических и генетических характеристик выделяется несколько десятков видов неходжкинских лимфом, для многих из которых созданы обособленные терапевтические программы. Лейкозы представляют собой разнородную группу заболеваний, делятся на острые и хронические в зависимости от субстрата опухоли: при острых лейкозах основная масса клеточного субстрата представлена незрелыми клетками (бластами ), при этом блок дифференцировки происходит очень рано, на этапе клеток-родоначальниц кроветворения, в отличие от хронических лейкозов, где опухолевые клетки представлены зрелыми и созревающими элементами. Также принципиально важным является деление лейкозов на миелоидные и лимфоидные, что возможно только при проведении качественного морфо- цитохимического, иммунофенотипического и молекулярно-генетического исследований клеток крови еще до начала лечения.
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний. Уровень смертности при этом значительно снизился в последнее два десятилетии, что является следствием появления новых высоко эффективных программ лечения.
Филиалы и отделения Центра, в которых лечат злокачественные заболевания кроветворной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
Публикации в СМИ
Анемии апластические
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r ) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r ) •• Группа В (тип 2, *227660, дефект гена FA2, r ) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r ) •• Группа D (тип 4, *227646, дефект гена FA4, r ).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
Клиническая картина
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r ). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5 ´ 10 9 /л, тромбоциты 100 ´ 10 9 /л, мегакариоциты меньше 80 ´ 10 9 /л) и тяжёлую (в периферической крови гранулоциты менее 0,5 ´ 10 9 /л, тромбоциты менее 20 ´ 10 9 /л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Дифференциальная диагностика • Транзиторная эритробластопения у детей • Миелодиспластический синдром • Пароксизмальная ночная гемоглобинурия • Острый лейкоз • Волосатоклеточный лейкоз • СКВ • Диссеминированная инфекция • Гиперспленизм • Анемии при гипотиреозе, гипопитуитаризме и заболеваниях печени.
ЛЕЧЕНИЕ
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
Консервативное лечение
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100 ´ 10 9 /л, гранулоцитов более 1,5 ´ 10 9 /л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100 ´ 10 9 /л, гранулоцитов 0,5–1,5 ´ 10 9 /л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30 ´ 10 9 /л (без проведения трансфузий).
Течение и прогноз • Приобретённая анемия. Течение и прогноз прямо пропорциональны возрасту больного. При отсутствии своевременной и адекватной терапии 80% пациентов погибают в течение 3 мес от манифестации заболевания. С внедрением в клиническую практику циклоспорина шансы на продление жизни больного увеличились. При предполагаемой трансплантации костного мозга во избежание сенсибилизации в предоперационный период желательно избегать переливаний препаратов крови (в особенности от родственников) • Анемия Фанкони. Выживаемость не превышает 4 лет при изолированной заместительной терапии. Прогноз значительно благоприятнее при эффективности андрогенов или трансплантации костного мозга.
Синонимы: Для анемии Фанкони — синдром Фанкони.
МКБ-10 • D60 Приобретённая чистая красноклеточная аплазия [эритробластопения] • D61 Другие апластические анемии
Примечания • Аплазия костного мозга — врождённое или приобретённое тяжёлое состояние, проявляющееся панцитопенией. Врождённая форма сочетается с фенотипическими и цитогенетическими аномалиями, что облегчает диагностику • Панцитопения — снижение количества эритроцитов, лейкоцитов и тромбоцитов. Характерны бледность и сонливость, инфекции, обусловленные нейтропенией; геморрагический диатез вследствие тромбоцитопении. Для дифференциальной диагностики необходимо исследование костного мозга (аплазия [чаще гипоплазия] костного мозга, вытеснение ростков костного мозга бластными клетками, аутоиммунное разрушение клеток крови — синдром Эванса) • Конституциональными называют врождённые и иногда идиопатические типы анемий.
Что такое нарушение функции кроветворения
Болезни крови считаются одними из самых агрессивных: они характеризуются быстрым развитием и течением, поэтому их лечение часто непростое и длительное, требует оперативных мер для сохранения жизни. Каковы симптомы патологий и можно ли предупредить их развитие, рассказали специалисты Медицинского центра «Молекула».
Заболевания крови: виды и этиология
Болезни гемотолгии объединяют нарушения, причиной которых является нарушения химического состава крови. Измененный состав крови может быть обусловлен как наследственными, генетическими факторами, так и внешним влиянием окружающей среды.
Общее понятие анемии объединяет заболевания, при которых понижается гемоглобин в крови. При наследственных пороках анемии неизлечимы. А вот гемолитические анемии, возникшие в результате негативного воздействия внешних факторов, могут корректироваться с помощью приема препаратов.
Отдельного внимания специалистов требует лечение рака крови. Онкологические болезни крови невозможно выявить на профосмотре: диагностика выполняется на основании анализов. Механизм развития лейкоза запускает поражение костного мозга, после чего меняется и структура крови. А вот лимфомы характеризуются измененным строением и работой лимфоцитов, а потому патологические нарушения в костном мозгу возникают уже на поздней стадии заболевания.
Лечение острых лейкозов
Острый лейкоз – злокачественное нарушение в системе кроветворения. В основе болезни – возникновение бластных клеток. Они инфильтруют костный мозг, подавляя здоровые клетки. В результате угнетается функция кроветворения, также может происходить бластная инфильтрация внутренних органов. Признаки:
Лечение острых лейкозов предполагает трансфузию тромбоцитов, эритроцитов, плазмы, а также химеотерапию для остановки деления бластных клеток.
Хронический лимфолейкоз
Лечение хронического лимфолейкоза в большинстве случаев требуется взрослым пациентам. Патологический процесс характеризуется злокачественной трансформацией CD5-положительных В-клеток, что в дальнейшем может привести к лимфоме. Симптомы также неспецифичные: потеря веса, анорексия, лихорадка, ночная потливость и т.д.
Тромбоцитопения
Под тромбоцитопенией подразумевается состояние, при котором количество тромбоцитов в крови снижено. Несмотря на нормальное общее состояние, тромбоцитопения опасна внутренними кровотечениями, в том числе и кровоизлияниями в мозг. Запускают нарушения свертываемости крови аллергические реакции на препараты, проблемы с иммунитетом при переливаниях крови и т.д. Лечение тромбоцитопении имеет выжидательный характер (при легкой форме) или может включать прием препаратов в комплексе с ограничениями двигательной активности.
Профилактика болезней крови
Говорить о профилактике наследственных гематологических нарушений не приходится, но уменьшить риски появления приобретенных заболеваний крови все же можно. Предупредительные мероприятия включают:
Внимание к своему здоровью и правильный образ жизни позволит существенно снизить риски гематологических заболеваний. А при появлении симптомов стоит обратиться к гематологу: в Медицинском центре «Молекула» прием ведет опытный специалист в Харькове.
Почему появляются морщины
Разумеется, каждый случай индивидуален, поэтому у одних в 25 есть всего лишь незаметные «гусиные лапки» у глаз, а у других – хорошо заметные носогубки. В любом случае, если вы хотите поддерживать цветущий и сияющий вид кожи, есть смысл воспользоваться эффективными методами косметологии.