что такое мышечная спастичность
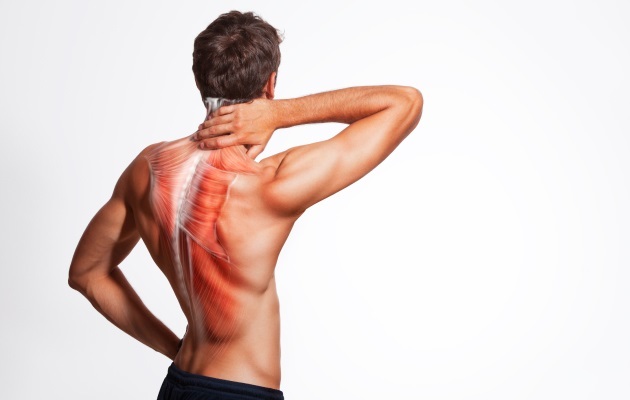
Мышечно-тонический синдром
Специалисты реабилитационного центра “Лаборатория движения” помогут в восстановлении функций опорно-двигательного аппарата
Самым частым проявлением дегенеративных патологий позвоночника является мышечно тонический синдром. Длительное и стойкое напряжение мышц, отвечающих за поддержание стабильности позвоночных сегментов, приводит к формированию болезненных «триггерных точек». И только комплексное лечение, направленное на оптимизацию различных звеньев двигательной системы, позволяет существенно облегчить состояние пациента.
Рассказывает специалист ЦМРТ
Дата публикации: 29 Июня 2021 года
Дата проверки: 29 Июня 2021 года
Содержание статьи
Причины мышечно-тонических болевых синдромов
Чрезмерные статические нагрузки и микротравмирование позвоночных структур влечет за собой рефлекторное напряжение мышц, ограничение их подвижности и формирование неоптимального двигательного стереотипа. Основной причиной мышечно-тонического синдрома являются дегенеративно-дистрофические заболевания позвоночника (остеохондроз, межпозвонковые грыжи) и нарушения осанки, связанные с врожденными аномалиями развития и деформацией спинного хребта.
Спровоцировать болезненный мышечный спазм может:
Под воздействием провоцирующих факторов в мышцах происходят биохимические процессы с выделением медиаторов воспаления, вызывающих рефлекторное сокращение мышц.
Симптомы мышечно-тонического синдрома
Основным признаком миотонического синдрома являются глубокие ноющие вертеброгенные боли. Болезненные спазмы, сопровождающиеся уплотнением и отечностью одной или нескольких мышц, существенно ограничивают подвижность. Из-за взаимодействия с нервными рецепторами развивается стойкая болезненность. Та, в свою очередь, усиливает сокращение мышц и замыкает порочный круг: спазм – отек – боль – спазм.
Мышечно-тонический синдром пояснично-крестцового отдела чаще всего становится следствием тяжелых физических нагрузок. Напряжение грушевидной мышцы может повлечь за собой боль в области ягодицы, тазобедренного сустава. В случае сдавливания седалищного нерва возможно онемение одной из конечностей.
Мышечно-тонический синдром шейного отдела проявляется цервикальными болями, болевыми ощущениями в шее, усиливающимися при разгибании и поворотах головы, гиперстезией 4-го и 5-го пальцев руки.
Для мышечно-тонического синдрома грудного отдела характерна болезненность между лопаток и по ходу ребер. Иногда может наблюдаться ощущение жжения и сдавленности в груди, имитирующих проявления сердечных проблем.
Классификация мышечно-тонических синдромов
Существует несколько разновидностей мышечно-тонических болевых синдромов. Они классифицируются в зависимости от локализации:
Помимо вышеперечисленных, патологическим изменениям нередко подвергается трапециевидная, широчайшая грудная, квадратная мышца поясницы, подниматель лопатки. Болевой синдром может быть первичным (охватывающим только спазмированные ткани) и вторичным, локализованным вне зоны повреждения.
Диагностика
Комплекс диагностических мероприятий включает:
Самым информативным, безопасным и безболезненным методом нейровизуализации признана магнитно-резонансная томография. Она дает максимально точную оценку состоянию позвоночника и спинного мозга, позволяет выявить протрузии и межпозвонковые грыжи, определить их размеры и локализацию.
О спастичности
Спастичность в ее внешнем проявлении — это повышенный тонус в мышцах конечности, возрастающий при растяжении мышцы и вызывающий ее сопротивление выполнению пассивных движений. Максимальное сопротивление при спастичности приходится на начало движения. При увеличении скорости пассивного движения тонус повышается и сопротивление возрастает.
Возникающие при спастичности вторичные изменения в мышцах, сухожилиях и суставах (фиброз, атрофия, контрактура) усиливают двигательные расстройства.
С точки зрения внутреннего механизма спастичность до конца не изучена, однако специалисты сходятся в том, что это результат комбинированных поражений пирамидных и экстрапирамидных структур головного и спинного мозга.
Среди ведущих причин спастичности называют изменение возбудимости спинальных интернейронов; гипервозбудимость рецепторов; формирование новых синапсов вследствие спрутинга.
Нейрохимически развитие спастичности характеризуется преобладанием активации аминацидергической нейротрансмиссии, в первую очередь обусловленной глутаматом и аспартатом.
Факторы появления спастичности
К основным причинам спастичности относят:
Развитие спастичности
На ранней стадии заболевания часто имеет место период уменьшенной рефлекторной деятельности спинного мозга («отключение» вследствие спинального шока). Спастичности предшествует заметная вялость мышц.
На следующей стадии появляются гиперактивные рефлексы. Это увеличивает вероятность некоторых компенсаторных структурных и/или функциональных реорганизаций в пределах центральной нервной системы. К ним относятся коллатеральный рост аксонов, гиперчувствительность рецепторов после «денервации» и активация неактивных до этого синапсов.
На поздней стадии описанные изменения приводят к анормальным, избыточным рефлекторным реакциям на внешние стимулы (такие как растягивание), ведущим к общей сверхактивности мышцы. Главное клиническое проявление спастичности заключается в повышенном сопротивлении быстрому сгибанию/разгибанию или приведению/отведению врачом пораженных мышц конечности.
Последствия и клиническая картина спастичности
Спастичность может варьировать от небольшой жесткости мышцы до постоянно сокращенного состояния. Когда мышца постоянно сокращена, соответствующий сустав деформируется. Нахождение сустава в неправильном положении может сопровождаться ощущением боли или неправильным выполнением обычных движений (это явление называется контрактурой). Еще одна проблема у многих пациентов, страдающих спастичностью, — клонус, или быстрые повторные мышечные спазмы.
Возможные последствия спастичности:
Хотя спастичность может поразить любую группу мышц, существует несколько распространенных клинических вариантов. Для верхней конечности это:
Эти состояния могут влиять на способность человека одеваться, принимать пищу или писать, могут влиять на поддержание равновесия, вызывая тем самым затруднения при ходьбе.
Наиболее распространенные клинические варианты спастичности нижней конечности:
Спастичность одной или обеих ног может влиять на способность ходить, принимать положение в кровати, сидеть, перемещаться или стоять.
Болезненный мышечный спазм, спастичность. Алгоритм диагностики и терапии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Показаниями к применению миорелаксантов являются:
1. Болезненный мышечный спазм, связанный с патологией позвоночника и собственно мышц.
1. Болезненный мышечный спазм, связанный с патологией позвоночника и собственно мышц.
Болезненный мышечный спазм
Определение. Болезненный мышечный спазм (БМС) – тоническое напряжение мышц, возникающее в ответ на болевое раздражение. Каждое локальное болевое раздражение вызывает спинальный сенсомоторный рефлекс в соответствующем ему сегменте спинного мозга, сопровождающийся активацией мотонейронов, что, в свою очередь, приводит к спазму мышц, иннервируемых этими нейронами. Физиологическая обоснованность напряжения мышц, которое следует за любой болью, заключается в иммобилизации пораженного участка тела, создании мышечного корсета. Однако сам мышечный спазм приводит к усилению стимуляции болевых рецепторов мышцы. Возникает порочный круг по механизму самовоспроизведения: боль–мышечный спазм– усиленная боль– болезненный мышечный спазм. Предположительно в мышце формируются триггерные точки, содержащие множественные локусы сенситизации, состоящие из одного или нескольких сенситизированных нервных окончаний. Врач чаще всего имеет дело с БМС при болях в спине в рамках дегенеративно–дистрофических поражений позвоночника (рефлекторные мышечно–тонические синдромы) или миофасциальных синдромов. Миофасциальные болевые синдромы, как правило, не связаны с патологией позвоночника, а являются проявлением первичной дисфункции миофасциальных тканей, но могут развиваться на фоне рефлекторных мышечно–тонических вертеброгенных синдромов, осложняя их течение (рис. 1).
Рис. 1. Болезненный мышечный спазм (алгоритм диагностики и терапии)
Диагностика. Рефлекторный мышечно–тонический синдром характеризуется локальной болью в пределах спазмированной мышцы, которая провоцируется движением с участием соответствующей мышцы. При пальпации мышца напряжена, болезненна с локальными гипертонусами. Могут быть положительны симптомы натяжения.
Для миофасциального паттерна боли характерна региональная боль, достаточно удаленная («отраженная») от спазмированной мышцы. Собственно спазмированная мышца, резко болезненная при пальпации, содержит в себе зоны еще большего болезненного мышечного уплотнения, где локализуются триггерные точки. При нажатии на активную триггерную точку появляется резкая болезненность в самой точке и на отдалении – в отраженной зоне.
БМС – неспецифическое звено формирования боли в спине, поэтому прежде чем приступать к его коррекции необходимо исключить серьезную патологию, которая может клинически проявляться только болью и мышечным спазмом. Необходимо проявлять настороженность в отношении первичных и метастатических опухолей позвоночника, спинного мозга, внутренних органов, отраженных болей при заболеваниях внутренних органов, переломов позвонков, инфекционных заболеваний. Алгоритм диагностики и терапии представлен на рисунке 1.
Лечение. Главной задачей при терапии больных с острой болью является уменьшение ее интенсивности. При дорсалгиях с этой целью чаще всего до сих пор используется симптоматическое лечение – нестероидные противовоспалительные препараты (НПВП) и физиотерапия.
Вместе с тем имеются теоретические предпосылки и практические доказательства успешности комплексного лечения дорсалгий с включением в терапию миорелаксантов. Добавление миорелаксантов к НПВП и физиотерапии способствует снижению сроков лечения и уменьшает риск развития побочных эффектов НПВП за счет снижения дозировок последних при комбинированной терапии. В последнее время существенно расширился спектр применения Мидокалма за счет успешного использования в терапии БМС. Широта этиологического спектра клинических моделей дорсалгий (остеохондроз, спондилоартроз, остеопороз, остеоартрозы), при которых применялся Мидокалм, демонстрирует, что его назначение патогенетически оправдано при наличии БМС различного происхождения. Наличие иньекционной формы препарата позволяет в острый период использовать в/м способ введения, а в последующие периоды – таблетированные формы. Несмотря на существенные различия используемых доз, оптимальной считается доза 450 мг Мидокалма в сутки в три приема. Длительность лечения варьирует от 10 до 28 дней (в среднем 21 день). Мидокалм хорошо переносится. Противопоказания к его применению не носят специфического характера и включают только индивидуальную гиперчувствительность к толперизону (для иньекционной формы – также к лидокаину).
Определение. Спастичность (особое, стойкое патологическое повышение мышечного тонуса) – один из компонентов пирамидного (центрального) пареза, который по современной классификации обозначается, как синдром верхнего мотонейрона (СВМ). СВМ включает мышечную слабость, утрату ловкости движений, повышение мышечного тонуса, мышечные спазмы и повышение сухожильных рефлексов. Синдром верхнего мотонейрона – один из наиболее частых неврологических синдромов, текущих хронически. Наиболее часто к СВМ приводят церебральный инсульт, черепно–мозговая и спинальная травмы, перинатальная энцефалопатия (детский церебральный паралич) и рассеянный склероз. Однажды возникнув, СВМ ведет к выраженной в различной степени инвалидизации больного и чаще всего сохраняется на протяжении всей жизни.
Лечение. Из всех проявлений хронического СВМ лучше всего поддается коррекции спастичность, мышечные спазмы и в значительно меньшей степени – сила и ловкость произвольных движений. Эффективность лечения во многом определяется сроками с момента заболевания и степенью пареза. Ранняя антиспастическая терапия предупреждает развитие многих проблем, в том числе развитие контрактур, которые могут возникнуть при сохранении спастичности. Проведение антиспастической терапии необходимо сочетать с физиотерапией и лечебной гимнастикой, поскольку эти методы не заменяют один другого. В то же время антиспастическая терапия облегчает проведение лечебной гимнастики и усиливает общий реабилитационный эффект. Как правило, антиспастическое лечение должно продолжаться годами. Алгоритм диагностики и лечения спастичности представлен на рисунке 2.
Рис. 2. Спастичность (алгоритм диагностики и терапии)
Спастичность обусловлена сочетанием различных патофизиологических нарушений, поэтому антиспастические препараты не должны быть чрезвычайно селективными. Большинство активно используемых в клинической практике миорелаксантов в основном тормозят полисинаптические и в меньшей степени моносинаптические рефлексы в спинном мозге. Представителем миорелаксантов является толперизон (Мидокалм). Механизм действия Мидокалма многогранен. Его миорелаксирующий эффект достигается за счет подавления активности каудальной части ретикулярной формации ствола и торможением моно– и полисинаптических рефлексов в спинном мозге. Эффективность и безопасность Мидокалма доказаны длительным успешным применением в клинической практике.
При использовании Мидокалма в терапевтическом диапазоне от 150 до 450 мг в сутки снижение спастичности достигается в среднем через месяц и сохраняется на протяжении нескольких лет.
Спастичность – современные подходы к терапии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Расстройства мышечного тонуса являются одним из наиболее часто встречающихся неврологических синдромов, при этом повышение тонуса по спастическому типу (спастичность) имеет исключительно широкую распространенность. Спастичность не является синдромом, специфичным для какого–либо заболевания и отмечается при самых различных органических поражениях головного и спинного мозга – расстройствах мозгового кровообращения, травматических, воспалительных и демиелинизирующих поражениях центральной нервной системы, нейродегенерациях, опухолях и др.
Перед началом лечения, помимо установления самого факта существования спастичности, необходимо попытаться выяснить, насколько повышение мышечного тонуса вызывает нарушение двигательных функций. Следует иметь в виду, что проведение чрезмерно активного лечения, попытка любой ценой добиться снижения мышечного тонуса, может не только не принести желаемого эффекта, но и, наоборот, ухудшить состояние больного, значительно ухудшить моторные функции. При центральном парезе больные, имеющие выраженную спастичность, в среднем имеют более плохую функциональную активность конечности, чем больные с легкой спастичностью. Вместе с тем при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а ее снижение способно привести к ухудшению двигательной функции. Кроме того, при выраженном парезе конечности больные могут не ощутить улучшения двигательных функций после снижения спастичности (Бойко А.Н. и соавт., 2004). У пациентов с выраженными когнитивными расстройствами нормализация мышечного тонуса за счет уменьшения спастичности не сопровождается расширением двигательного режима, но существенно облегчает уход за больным. Начинать лечение спастичности целесообразно в том случае, если имеет место значительное нарушение двигательных функций в повседневной активности, резкое затруднение поддержания позы, возникновение связанного со спастичностью болевого синдрома. После принятия решения о проведении миорелаксации (терапии) следует выбрать оптимальный для конкретного пациенты способ лечения, т.е., определить наиболее эффективный способ нормализации тонуса (местное или системное воздействие), тип лекарственного препарата и его дозу, сроки проведения лечения. Разнообразие патофизиологических механизмов, приводящих к развитию спастичности, индивидуальные особенности выраженности изменений мышечного тонуса, характер и тяжесть имеющегося неврологического дефицита в значительной степени определяют лечебную тактику. Современные подходы к лечению спастичности включают системное введение миорелаксантов, интратекальную доставку препаратов, воздействие на локальные мышечные группы (инъекции ботулинического токсина, фенола, алкоголя, ризотомия), оперативные вмешательства на сухожильно–связочном аппарате, физиотерапевтические воздействия, лечебную гимнастику. Учитывая разнообразие механизмов развития спастичности, исключительную сложность путей формирования повышенного мышечного тонуса и индивидуальную вариабельность клинической картины, трудно предположить существование единого универсального подхода к лечению данного состояния. Вместе с тем, принимая во внимание роль активации полисинаптических рефлексов, активации спинальных мотонейронов в реализации повышенного мышечного тонуса, представляется очевидной целесообразность медикаментозного воздействия на эти структуры при помощи препаратов из группы миорелаксантов центрального действия. В клинической практике наиболее часто используются следующие миорелаксанты – толперизон (Мидокалм) , баклофен, тизанидин. Относительно реже применяются дантролен, бензодиазепиновые производные (диазепам), антиконвульсанты (габапентин, вигабатрин). Важным свойством миорелаксантов является способность оказывать воздействие на полисинаптические рефлексы, непосредственно участвующие в реализации спастичности при минимальном воздействии на моносинаптические, с эффективностью функционирования которых связана мышечная сила (Гусев Е.И., 1999). Толперизон (Мидокалм) является антиспастическим препаратом центрального действия. Основным эффектом данного препарата является блокада полисинаптических спинномозговых рефлексов, что в определенной степени может быть обусловлено избирательным угнетением каудальной части ретикулярной формации. Кроме того, оказывает центральное н–холинолитическое действие, обладает спазмолитической и умеренной сосудорасширяющей активностью. Препарат снижает повышенный мышечный тонус и ригидность мышц при заболеваниях экстрапирамидной системы, улучшает произвольные активные движения, нормализует периферическое кровообращение. При его назначении следует учитывать его сосудорасширяющее действие, которое на фоне одновременного применения антигипертензивных, седативных препаратов может сопровождаться тенденцией к артериальной гипотонии. Противопоказаниями являются тяжелая миастения, детский возраст (до 1 года). Применение – внутрь по 150–450 мг/сут. в 3 приема, внутримышечно по 100 мг 2 раза в сутки, внутривенно медленно 100 мг 1 раз в день. Перед парентеральным применением следует убедиться в отсутствии у больного повышенной чувствительности к лидокаину. Достоинствами Мидокалма являются отсутствие существенных побочных эффектов и хорошее взаимодействие с нестероидными противовоспалительными средствами, что во многих случаях позволяет уменьшить дозу последних и вследствие этого ослабить или даже полностью устранить их побочные эффекты (в первую очередь риск язвенного поражения ЖКТ) без снижения эффективности лечения. Важным преимуществом Мидокалма перед другими миорелаксантами является отсутствие седативного эффекта и мышечной слабости при его приеме. Хорошая переносимость Мидокалма и возможность назначения его в тех случаях, когда пациент продолжает водить автомобиль или его деятельность требует сохранения быстрых реакций и внимания, доказана результатами исследований. Проведенные двойные плацебо–контролируемые исследования показали эффективность и безопасность применения Мидокалма при болезненном мышечном спазме. Анализ субъективной оценки результатов лечения, данной больными после окончания, показал, что в группе больных, получавших Мидокалм, достоверно чаще встречалась очень хорошая оценка лечения.
Выбор фармакологической терапии при спастическом мышечном гипертонусе
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с использованием антиспастических препаратов в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов
Myorelaxants are the basic preparations used for reduction in the muscular tone. Issues of selection of therapy by anti-spastic preparations depending on the disease, manifestation of muscular spasticity, side effects and special features of the preparation effect are considered.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечно-полосатых мышц). При применении миорелаксантов могут возникать достаточно значимые побочные действия, которые при выборе препарата надо тщательно оценивать [1, 2].
При выборе антиспастических препаратов учитывают в основном их способность тормозить полисинаптические рефлексы (уменьшение спастики), оказывая при этом наименьшее влияние на моносинаптические рефлексы (сила мышц). Антиспастический препарат должен уменьшать мышечную спастичность при минимальном снижении мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблетированных и инъекционных форм. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры, предупредить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта [6].
К миoрелаксантам центрального действия, наиболее часто используемым в России для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин, толперизон, диазепам [7, 8].
Баклофен (Баклосан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК), который связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат проявляет также умеренное центральное анальгезирующее действие. Баклофен используется при спинальном и церебральном спастическом мышечном гипертонусе различного генеза. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются седацией, сонливостью, снижением концентрации внимания, головокружением и часто ослабевают в процессе лечения. Возможно возникновение тошноты, запоров и диареи, артериальной гипертонии, усиление атаксии, появление парестезий. Требуется осторожность при лечении больных пожилого возраста, пациентов, перенесших инсульт, пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии, наличии судорог в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное применение антиспастических препаратов не эффективно, показано интратекальное введение баклофена, которое впервые было предложено в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать довольно значительные дозы баклофена, что может привести к нарушениям сознания, сонливости, слабости. В связи с этим были разработаны системы, при помощи которых баклофен доставляется непосредственно в подоболочечное пространство спинного мозга при помощи подоболочечной баклофеновой насосной системы. При этом клинического эффекта добиваются гораздо меньшими дозами баклофена, чем при использовании таблетированных форм [11, 12].
Данная система состоит из резервуара, где содержится баклофен или аналогичный препарат, насоса (помпы), при помощи которого препарат дозированно подается в подоболочечное пространство спинного мозга через люмбальный катетер и блока питания. Из резервуара баклофен поступает непосредственно в спинномозговую жидкость, а его дозировка контролируется специальным радиотелеметрическим устройством. Количество поступающего в спинномозговую жидкость лекарственного препарата можно изменять в зависимости от клинической картины. Добавление баклофена в резервуар производится через 2–3 месяца при помощи чрезкожной пункции [13].
Использование баклофеновой помпы улучшает скорость и качество ходьбы больных с нефиксированными рефлекторными контрактурами, обусловленными высокой спастичностью мышц-синергистов и дисбалансом мышц-антагонистов. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин обладает также умеренным центральным анальгетическим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, при индивидуальном подборе увеличение дозы происходит на 3–4 день на 2 мг. При пероральном приеме действие препарата проявляется через 30–45 минут, максимальный эффект наступает в течение 1–2 часов. Средняя терапевтическая доза составляет 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникнуть сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако тизанидин при адекватном подборе дозировки лучше переносится, т. к. не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации и обладает Н-холинолитическими свойствами. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим действием, что следует учитывать при назначении больным с тенденцией к артериальной гипотонии. Также препарат может вызывать или усиливать у больных недержание мочи [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое наступление мышечной слабости, причем в каждом случае врач должен находить баланс между снижением тонуса и усилением слабости. Кривая баланса между снижением спастического тонуса и усилением мышечной слабости у больных на фоне увеличения дозы Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое усиление слабости происходит при приеме Баклофена, а самый мягкий препарат, позволяющий эффективно подобрать индивидуальную дозировку, — Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно наращивая ее до достижения отчетливого антиспастического эффекта, но не до появления слабости [18, 19].
Диазепам (Реаланиум, Релиум, Сибазон) является миорелаксантом, поскольку обладает способностью стимулировать уменьшенное пресинаптическое торможение на спинальном уровне. Он не имеет прямых ГАМК-ергических свойств, увеличивает концентрацию ацетилхолина в мозге и тормозит обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивляемости растяжению, увеличением диапазона движений. Диазепам также обладает способностью уменьшать болевой синдром, вызываемый спазмом мышц. Наряду со снижением мышечного тонуса, развиваются заторможенность, головокружение, нарушение внимания и координации ввиду токсического действия на центральную нервную систему. Это значительно ограничивает применение диазепама в качестве миорелаксанта. Используется он, в основном, для лечения спастичности спинального происхождения при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в день. Максимальная суточная доза может составлять 60 мг. При больших дозах могут отмечаться расстройства сознания, преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепина. Клоназепам оказывает успокаивающее, центральное миорелаксирующее, анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления ингибирующего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола головного мозга и вставочных нейронов боковых рогов спинного мозга, а также уменьшения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинальных рефлексов.
Быстрое наступление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для снижения проявления возможных побочных реакций, достигать терапевтической дозы необходимо путем медленного титрования в течение двух недель. Для приема внутрь взрослым рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза — 4–8 мг/сут. Возможно назначение небольших доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальных повышениях мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, трансформируется в главный метаболит диазепама, обладает большей активностью и длительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде уменьшения фазических рефлексов на растяжение, обладает незначительным седативным эффектом. Первоначальная доза составляет 5 мг 4 раза в сутки, затем уменьшается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действует вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена — блокирование высвобождения кальция из саркоплазматического ретикулума, что ведет к снижению степени сократимости скелетных мышц, редукции мышечного тонуса и фазических рефлексов, увеличению диапазона пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинального, но и церебрального генеза. Начальная доза — 25 мг/сут, при переносимости дозу увеличивают в течение 4 недель до 400 мг/сут. Побочные эффекты — сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пожилых пациентов в дозе более 200 мг/сут, представляет гепатотоксическое действие, поэтому в период лечения надо регулярно следить за функцией печени. Элиминация дантролена на 50% осуществляется за счет печеночного метаболизма, в связи с этим он противопоказан при заболеваниях печени. Осторожность следует соблюдать и при тяжелых сердечных или легочных заболеваниях.
Катапресан — применяется в основном при спинальных повреждениях, действует на альфа-2-агонисты головного мозга, обладает пресинаптическим торможением. Из побочных эффектов отмечаются снижение артериального давления и депрессия. Первоночальная доза — 0,05 мг 2 раза в день, максимальная — 0,1 мг 4 раза в день.
Темазепам — взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, восходящей активирующей ретикулярной формации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и таким образом потенцируется действие эндогенного тормозного медиатора — ГАМК. Рекомендуемая доза — 10 мг 3 раза в день. Эффективно его сочетание с баклофеном [23, 24].
Основные лекарственные средства, используемые для лечения спастического мышечного гипертонуса, представлены в табл.
Таким образом, выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия конкретного препарата.
Так, например, тизанидин и баклофен в большей степени действуют на тонус мышц-разгибателей, поэтому в случаях наличия значительного гипертонуса мышц-сгибателей руки, легкой спастичности мышц ноги их прием не показан, поскольку легкое повышение тонуса мышц-разгибателей ноги компенсирует мышечную слабость в ноге и стабилизирует походку больного. В таком случае средством выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом перед другими миорелаксантами обладает Мидокалм, который не оказывает седативного эффекта и имеет благоприятный спектр переносимости, поэтому является препаратом выбора для лечения в амбулаторных условиях и для лечения пожилого контингента пациентов.
Допустима комбинация нескольких средств, что позволяет эффективно снижать тонус на меньших дозах каждого из препаратов. Сочетание препаратов с разными точками приложения, начиная от центров в головном мозге и до мышц, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном использовании, часто возникает необходимость возрастающего повышения дозировок для поддержания начального клинического эффекта, что сопровождается увеличением частоты и тяжести побочных реакций [25–27].
В ситуации, когда спастичность носит локальный характер и системный эффект пероральных миорелаксантов нежелателен, предпочтительны локальные методы воздействия, одним из которых является локальное введение ботулотоксина [28, 29].
Литература
А. А. Королев, кандидат медицинских наук
ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, Санкт-Петербург




_575.gif)