что такое мыла в кале у взрослого
Копрограмма: бессмысленная и беспощадная
Поделиться:
Копрограмма (общий анализ кала) — один из наиболее частых анализов в отечественной детской поликлинике или больнице. Если открыть историю болезни пациента с ОРВИ, ангиной или даже с черепно-мозговой травмой, там наряду с клиническим анализом крови и мочи вы обязательно найдете копрограмму. Большинство врачей с советских времен к этому настолько привыкли, что им даже не приходит в голову вопрос: а зачем, собственно, микроскопия кала при лечении отита или пневмонии?
Ту же картину иногда наблюдаем и в амбулаторных условиях. Допустим, ребенок здоров, хорошо прибавляет в весе, у него нормальный стул — кажется, чтó еще нужно для счастья? Конечно, копрограмма, которую педиатры обязательно должны назначить всем здоровым детям грудного возраста минимум дважды, без всяких на то показаний.
Согласно «протоколу», копрограмма является важнейшим диагностически значимым анализом и используется для диагностики различных заболеваний желудочно-кишечного тракта (ЖКТ).
Читайте также:
Обследуй меня полностью
Но я, например, в своей практической работе почти никогда ее не использую, так как считаю на 90 % бесполезной. Почему? Давайте разберем по порядку.
Итак, возможно, нам нужен этот анализ для того, чтобы…
Таким образом, с моей точки зрения, копрограмма в большинстве случаев — бесполезный анализ, на который ежегодно переводится куча средств из системы ОМС. Копрограмма, назначенная здоровому ребенку без показаний, приводит к большому числу ложных заключений, назначению ненужных лекарств, а назначенная ребенку больному — ничего толком не проясняет в диагнозе.
Конечно, если ваш врач будет настаивать на этом анализе — ну сдайте его, что ж поделать. Но можете и обратить внимание своего доктора, что сегодня существуют куда более точные исследования. И уж точно не стоит «назначать» себе копрограмму самостоятельно, вы лишь совершенно напрасно потратите свои деньги.
Копрограмма в Заюково
Исследование состава и физических свойств кала для диагностики заболеваний желудочно-кишечного тракта.
Приём и исследование биоматериала
Когда нужно сдавать анализ Копрограмма?
Подробное описание исследования
Кал состоит из 75 % воды и 25 % твердых веществ. Около 30 % твердого вещества составляют бактерии, 30 % – непереваренные продукты, например, клетчатка, от 10 до 20 % – холестерин и другие жиры, от 10 до 20% – неорганические вещества, такие как кальций и железо, и еще от 2 до 3 % – белок.
Копрограмма представляет собой лабораторный анализ образца кала, который включает в себя микроскопическое исследование, химические показатели и микробиологический анализ. В процессе исследования оценивают множество показателей, от цвета до химического состава.
Консистенция кала связана с содержанием в нем воды. При диарее ее процентное содержание возрастает, и стул становится жидким, то есть неоформленным. Запор связан с уменьшением содержания воды в фекалиях, что приводит к его уплотнению. Нормальной считается оформленный стул.
Запах кала отражает жизнедеятельность кишечных микроорганизмов. Появление кислого или зловонного запаха служит отражением нарушения баланса между нормальной и условно-патогенной микрофлорой кишечника.
Реакция кала оценивается относительно рН среды и также косвенно отражает жизнедеятельность кишечной микрофлоры и ее изменения. Нормальной считается нейтральная или слабощелочная реакция.
Кровь в кале может быть обнаружена из-за кровотечения преимущественно в желудочно-кишечном тракте.
Слизь в небольшом количестве обнаруживается в копрограмме в норме. Ее выделяют клетки толстой и прямой кишки для защиты слизистой оболочки органа. При патологических процессах в кишечнике образование слизи увеличивается.
Остатки непереваренной пищи обнаруживаются в копрограмме в случае, когда выделения пищеварительных соков недостаточно, однако могут выявляться и при ускоренном выведении пищи из организма.
Измененные мышечные волокна служат продуктом переваривания мяса и выявляются при недостаточности пищеварительных соков.
Неизмененные мышечные волокна свидетельствует о нарушении расщепления белковой пищи.
Растительная клетчатка разделяется на перевариваемую и неперевариваемую. Обнаружение перевариваемой клетчатки отражает недостаточность процессов утилизации сложных углеводов.
Нейтральный жир и мыла могут быть выявлены в копрограмме, когда желчь и сок поджелудочной железы выделяются в недостаточном количестве для расщепления жирной пищи. Это может отмечаться при различных острых и хронических заболеваниях печени, желчного пузыря, поджелудочной железы.
Жирные кислоты служат продуктом метаболизма жиров в организме. Их обнаружение свидетельствует о снижении всасывающей способности кишечника или усилению его перистальтики, из-за чего данные продукты обмена не могут попасть в кровоток и накапливаются в просвете кишечника.
Крахмал обнаруживается внутри растительных клеток (внутриклеточный) или вне клеток при их разрушении (внеклеточный), в норме эта разновидность углеводов расщепляется пищеварительными соками. Крахмал может быть выявлен в копрограмме при недостаточности выделения соляной кислоты в желудке и панкреатического сока.
Лейкоциты представляют собой клетки иммунной системы, которые выявляются в любом органе при воспалении. Выявление повышенного количества лейкоцитов в образце кала свидетельствует о воспалении в желудочно-кишечном тракте.
Эритроциты появляются в копрограмме вследствие кровотечения из кишечника.
Эпителий кишечника имеет свойство обновляться, и отмершие клетки попадают в состав фекалий. Воспалительные заболевания приводят к усилению его слущивания, что отражается в копрограмме.
Обнаружение кристаллов отражает нарушение пищеварения и специфического воспаления в желудочно-кишечном тракте. Трипельфосфаты образуются при значительном изменении рН в щелочную сторону и связаны с размножением условно патогенной микрофлоры кишечника. Кристаллы Шарко-Лейдена служат скоплением эозинофилов, клеток, связанных с аллергическими реакциями.
Йодофильная флора имеет указанное название ввиду ее окрашивания йодом при исследовании. Избыток представителей этой флоры является отражением дисбиоза кишечника.
Дрожжеподобные грибы принято рассматривать как условно-патогенных представителей микрофлоры кишечника. Их обнаружение в большом количестве может также быть признаком дисбиоза.
Возможность обнаружения в копрограмме яиц гельминтов служит важным источником диагностики паразитарных инфекций. Микроскопия позволяет определить не только наличие яиц, но и вида гельминта.
Определение указанных показателей при исследовании кала позволяет оценить состояние органов пищеварительной системы и выявить ее заболевания.
Синдром недостаточности пищеварения
Мальдигестия или прямая угроза для кишечника
Синдром недостаточности пищеварения или синдром мальдигестии не является редким явлением в современном мире. Одной из главных причин нарушения пищеварения принято считать недостаточную выработку пищевых ферментов, которые расщепляют компоненты пищи. Это состояние сопровождается выраженными клиническими проявлениями, которые заставляют человека обратиться за медицинской помощью.
Характеристики состояния
Синдром мальдигестии обусловлен функциональной недостаточностью поджелудочной железы, желудка или кишечника. Независимо от степени вовлеченности одного из органов пищеварительной системы, данное состояние приводит к нарушению процесса всасывания нутриентов, включая витамины и минералы. За короткий промежуток времени, расстройства пищеварения вызывают потерю массы тела, ухудшение состояния кожи и волос, негативно отражается на иммунитете человека, и провоцирует обострение любых хронических заболеваний.
Кроме того, остатки непереваренной пищи (химус) являются благоприятной средой для размножения болезнетворных организмов, с последующим развитием тяжелого кишечного дисбактериоза и аллергических реакций.
Несмотря на то, что существует отдельная (инволютная) форма мальдигестии, связанная с возрастными изменениями в организме пожилых людей, чаще всего с этим состоянием сталкиваются люди молодого и среднего возраста.
Причины развития
Одной из главных причин развития данного состояния является нарушение работы желудка или кишечника, а также поджелудочной железы с уменьшением продукции пищеварительных ферментов. К другим потенциальным факторам развития синдрома недостаточности пищеварения, можно отнести:
Нарушение процесса желчеобразования и желчевыделения.
Синдром недостаточности пищеварения условно делится на полостную, пристеночную и внутриклеточную мальдигестию. Полостная мальдигестия развивается при таких состояниях, как муковисцидоз, хроническое воспаление поджелудочной железы, а также после операций на данном органе. Снижение функциональности ферментов, ответственных за расщепление компонентов пищи, наблюдается при хроническом гастрите. Кроме того, развитию мальдигестии способствует язва желудка и синдром раздраженного кишечника, при котором наблюдается нарушение транзита химуса. Пристеночное пищеварение нарушается в том случае, если наблюдается повреждение клеток эпителия кишечника (энтероцитов). Повреждение эпителия кишечника наблюдается при целиакии, болезни Крона, а также при энтеритах различной этиологии.
Непереваренные остатки пищи, которые остаются длительное время в просвете кишечника провоцируют не только развитие дисбактериоза, но и приводят к образованию токсических компонентов (скатол, аммиак, индол), которые оказывают местнораздражающий эфеект и повреждают слизистую оболочку кишечника.
Клинические симптомы
Распознать расстройства кишечника при мальдигестии можно по таким характерным клиническим признакам:
Кроме того, для мальдигестии характерны такие симптомы, как общая слабость, частичная или полная утрата аппетита, а также снижение массы тела. У пациентов с мальдигестией наблюдается увеличение объема испражнений, при этом меняется их цвет и запах. В испражнениях наблюдается маслянистые включения (стеаторея). Синдром недостаточности пищеварения очень часто протекает в комбинации с непереносимостью лактозы (молочного сахара) или других пищевых компонентов.
При тяжелом течении, у пациентов с синдромом мальдигестией резко ухудшается общее состояние, нарушается процесс всасывания биологически-значимых компонентов и развивается мальабсорбция. На фоне данного состояния снижается масса тела, у женщин могут пропадать менструации, наблюдается ухудшение состояния кожи, волос и ногтей.
Лечение
Одним из главных условий правильного и результативного лечения мальдигестии является коррекция рациона. Из ежедневного меню исключают те продукты, которые плохо переносятся организмом. Питание усиливают продуктами, богатыми белком, углеводами и микроэлементами, при этом жиры урезают до минимума. Также, из меню исключают сырые фрукты и овощи. Стандартная терапия синдрома недостаточности пищеварения включает приём медикаментов, содержащих пищеварительные ферменты. Перестальтика кишечника восстанавливается с помощью приёма медикаментов из группы регуляторов моторики.
Для восстановления структурно-функционального состояния ЖКТ при мальдигестии и лечения дисбактериоза целесообразно использовать метапребиотики, которые бережно и эффективно нормализуют баланс кишечной и желудочной микрофлоры, подавляют рост и развитие болезнетворных микроорганизмов, а также восстанавливает поврежденный эпителий желудочно- кишечного тракта. Метапребиотик Стимбифид Плюс содержит фруктополисахариды и фруктоолигосахариды, которые являются ценным питательным субстратом для кишечной и желудочной микробиоты. Кроме того, Стимбифид Плюс дополнен лактатом кальция, стимулирующим рост и размножение полезных кишечных бактерий.
Комбинация из перечисленных компонентов позволяет добиться эффекта быстрого, безопасного и полного восстановления пищеварительной системы, пострадавшей от мальдигестии. Рациональное питание и приём метапребиотика Стимбифид плюс с профилактической целью, позволит избежать дисбиоза кишечника, расстройств пищеварительной деятельности и тяжелых осложнений, развивающихся на фоне синдрома недостаточности пищеварения. Метапребиотик может быть использован в любом возрасте.
Панкреатическая стеаторея (K90.3)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Чаще всего ПС является не самостоятельной патологией, а следствием (осложнением) другого заболевания.
Примечания
1. Если ПС является следствием другого заболевания, при кодировке используется код уточненного основного заболевания.
2. Из данной подрубрики исключены нарушения, являющиеся следствием хирургического вмешательства на желудочно-кишечном тракте (K91.2).
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
По этиологии:
1. Первичная:
— идиопатическая панкреатическая стеаторея;
— стеаторея при генетически обусловленном изолированном дефиците продукции панкреатической липазы;
— при врожденной гипоплазии, дисплазии или аплазии поджелудочной железы (ПЖ).
2. Вторичная:
2.1 При заболеваниях ПЖ:
— хронический панкреатит;
— состояния после резекции ПЖ;
— большие кисты, опухоли ПЖ, приводящие к уменьшению объема функционально активной паренхимы;
— обструкция панкреатических протоков вследствие различных причин;
— сахарный диабет;
— синдром Золлингера-Эллисона;
— муковисцидоз.
2.2 При заболеваниях других органов пищеварения:
— желудка: хронический гастрит с пониженной желудочной секрецией или ахилией, состояния после резекции желудка, демпинг-синдром;
— тонкой и толстой кишок: хронический энтерит, избыточный бактериальный рост;
— печени и желчных путей: холестатические заболевания печени, состояния после холецистэктомии, хронический холецистит с гипомоторной дисфункцией желчного пузыря.
Более редко панкреатическая стеаторея является проявлением состояния после облучения, абдоминального ишемического синдрома, переедания (употребления в пищу количества жиров, превышающего возможности продукции липолитических ферментов).
Этиология и патогенез
Эпидемиология
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Начальные проявления ПС:
— потеря массы тела;
— полифекалия;
— «жирный стул»;
— лиентерея (макроскопические остатки непереваренной пищи в кале);
— метеоризм;
— спастические боли в животе.
Возможные проявления ПС:
9. При ПС, как правило, нарушается состав кишечной флоры. У больных возникает энтеропанкреатический синдром (избыточный бактериальный рост, энтерит) и существует риск транслокации кишечной флоры из просвета кишечника в брюшную полость, что вызывает развитие бактериальных осложнений.
Диагностика
Обязательное исследование: УЗИ поджелудочной железы (ПЖ), желчного пузыря, печени для выявления заболеваний, приведших к развитию панкреатической стеатореи.
При наличии показаний:
1. Для определения внешнесекреторной функции ПЖ:
— 13С-триглицеридный, 13С-амилазный дыхательные тесты;
— секретин-панкреозиминовый тест (или эуфиллин-кальциевый тест, или тест Лунда).
2. Электрокардиография – проводится для исключения патологии сердечно-сосудистой системы.
5. Компьютерная томография органов брюшной полости и забрюшинного пространства – позволяет выявлять зону некроза при помощи контрастирования.
Лабораторная диагностика
Для диагностики панкреатической стеатореи (ПС) необходимо осуществлять определение экскреции жира с калом. Для диагностики скрытых форм патологии всасывания определение жиров в кале рекомендуется проводить после жировых нагрузок.
Классификация панкреатических функциональных тестов
2. Беззондовые тесты:
Зондовые тесты
Секретин-панкреозиминовый тест
Наиболее надежный тест определения внешнесекреторной недостаточности ПЖ. Для проведения данного теста после забора базальной секреции в/в медленно (в течение 3-4 минут) вводят секретин в дозе 1 ЕД/кг массы тела. Непосредственно перед применением во флакон с секретином вводят 10 мл стерильного изотонического раствора натрия хлорида. В 1 мл полученного раствора должно содержаться 10 ЕД секретина. На каждые 10 кг массы тела вводят 1 мл разведенного секретина. После его введения дуоденальное содержимое собирают в три 20-минутные порции.
Далее аналогичным образом панкреозимин в дозе 1 ЕД/кг массы тела (разводят так же, как секретин). После введения панкреозимина дуоденальное содержимое собирают в три 20-минутные порции.
Беззондовые тесты
РАВА- или ПАБК-тест, а также пептидный или бентираминовый тест: вводят внутрь трипептид парааминобензойной кислоты в количестве 1,0-2,0 г (в зависимости от возраста и массы тела); 1 г вещества содержит 340 мг парааминобензойной кислоты. Вещество расщепляется в тонкой кишке при помощи хемотрипсина. Процент отщепления парааминобензойной кислоты улавливают по выделению этого соединения с мочой.
Исследование мочи осуществляется в течение 8 часов, в норме за это время выделяется не менее 50% принятой парааминобензойной кислоты.
Проведение фекального теста осложняется тем, что требуется сбор всех испражнений в течение нескольких суток и существует риск смешивания кала с мочой. Диагностические возможности радиоизотопного метода повышаются при параллельном использовании кровяного и фекального тестов. Исследование активности мочи менее надежный метод, чем исследование крови.
С помощью радиоизотопного метода облегчается топическая диагностика абсорбционных расстройств.
Методы, основанные на исследовании крови (метод «спровоцированной гиперлипидемии», хроматографический метод исследования различных фракций липидов, проспароловый тест, вариант теста с липиодолом, вариант ПАБК-теста) относительно ненадежны. Наиболее достоверным и простым методом является определение жировой экскреции с калом. Это связано с тем, что 95% жира всасывается и небольшое снижение этого процента гораздо более заметно при определении выделяемого количества, чем при измерении его абсорбции.
В диагностике ПС применяется также такой простой метод, как йодолиполовый тест. Йодолипол, принятый внутрь, расщепляется в кишках липазой и выделяется с мочой. По времени экскреции и концентрации йода в моче можно судить об активности липазы.
При наличии показаний:
— железо, кальций, магний, калий, натрий в крови: снижение уровня;
— витамины А, D, E, K в крови: дефицит;
— ПАБК-тест, панкреолауриловый тест или другие тесты, выявляющие внешнесекреторную недостатточность ПЖ;
— бактериологическое исследование кала: нарушенный состав кишечной флоры, энтеропанкреатический синдром (избыточный бактериальный рост, энтерит).
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
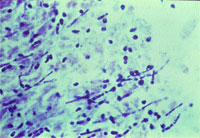 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
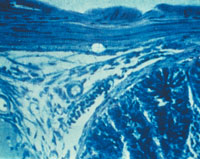 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
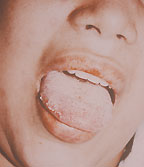 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
 Читайте также:
Читайте также: 


