что такое мукормикоз после ковида
Случай успешного лечения мукормикоза околоносовых пазух перед аллогенной трансплантацией гемопоэтических стволовых клеток
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Трансплантация гемопоэтических стволовых клеток (ТГСК) является современным методом лечения гематологических заболеваний. Проведение ТГСК сопровождается определенными рисками ввиду побочных эффектов цитостатической терапии, периода агранулоцитоза, нарушения клеточного и гуморального иммунитета. Развитие инфекционных осложнений во время противоопухолевой терапии, предшествующей трансплантации, ставит под сомнение не только достижение ремиссии основного заболевания, но и возможность последующего выполнения ТГСК.
В статье описывается случай успешного комбинированного лечения мукормикоза околоносовых пазух у пациентки с острым миелобластным лейкозом, развившегося на фоне проведения противоопухолевой химиотерапии, которая выполнялась с целью достижения ремиссии основного заболевания перед аллогенной неродственной ТГСК. Подробно описаны клинические проявления заболевания, динамика поражения околоносовых пазух, комбинированная терапия и проведение хирургического вмешательства в условиях цитостатической панцитопении. Представлены рентгенологические и эндоскопические иллюстрации поражения тканей полости носа мукормикозом, а также результаты микроскопического исследования. Авторы приходят к выводу, что при своевременной диагностике, ранней лекарственной терапии, соответствующей подготовке и хирургическом лечении возможно достижение благоприятного исхода в лечении быстропрогрессирующего жизнеугрожающего осложнения — мукормикоза околоносовых пазух на фоне цитостатической панцитопении.
Ключевые слова: мукормикоз, острый лейкоз, противоопухолевая химиотерапия, трансплантация гемопоэтических стволовых клеток, эндоскопическая ринохирургия, синусит.
Для цитирования: Долгов О.И., Попова М.О., Карпищенко С.А. и др. Случай успешного лечения мукормикоза околоносовых пазух перед аллогенной трансплантацией гемопоэтических стволовых клеток. РМЖ. 2021;4:59-62.
Сase of successful treatment of mucormycosis of the paranasal sinuses before allogeneic hematopoietic stem cell transplantation
1 Pavlov First Saint-Petersburg State Medical University, Saint Petersburg
2 Saint Petersburg Research Institute of Ear, Throat, Nose and Speech, Saint Petersburg
Hematopoietic stem cell transplantation (HSCT) is a modern method of treating hematological diseases. HSCT is accompanied by certain risks due to the cytostatic therapy side effects, agranulocytosis period, and impaired cellular and humoral immunity. The development of infectious complications during anticancer therapy prior to transplantation calls into question not only the achievement of the underlying disease remission, but also the possibility of subsequent HSCT.
The article describes a case of successful combined treatment of mucormycosis of the paranasal sinuses in a female patient with acute myeloid leukemia occurred during anticancer therapy, which was performed in order to achieve the underlying disease remission before allogeneic HSCT from unrelated donors. The article also considers disease clinical manifestations, tendency of the paranasal sinuses’ lesions, combination therapy and surgical intervention in conditions of cytostatic pancytopenia. X-ray and endoscopic images of nasal cavity mucormycosis lesions, as well as the results of microscopic examinatio n are presented. The authors conclude that with timely diagnosis, early drug therapy, appropriate preparation and surgical treatment, it is possible to achieve a favorable outcome in the treatment of rapidly progressive life-threatening complication — mucormycosis of the paranasal sinuses in the setting of cytostatic pancytopenia.
Keywords: mucormycosis, acute leukemia, antitumor chemotherapy, hematopoietic stem cell transplantation, endoscopic rhinosurgery, sinusitis.
For citation: Dolgov O.I., Popova M.O., Karpishchenko S.A. et al. Сase of successful treatment of mucormycosis of the paranasal sinuses before allogeneic hematopoietic stem cell transplantation. RMJ. 2021;4:59–62.
Введение
В последние десятилетия наблюдается рост встречаемости грибковых синуситов [1–4]. Это обусловлено существенным увеличением количества пациентов с факторами риска их развития, среди которых ведущие позиции занимают иммунодефицитные состояния, вызванные длительным использованием глюкокортикоидных и иммуносупрессивных препаратов, онкологические и гематологические заболевания, СПИД, массивная антибактериальная терапия, соматическая патология, в частности сахарный диабет, бронхиальная астма и пр. [5–7].
Различают инвазивные и неинвазивные формы грибковых синуситов. К инвазивным формам относят острый инвазивный грибковый синусит, хронический инвазивный грибковый синусит, хронический гранулематозный инвазивный грибковый синусит. Неинвазивные формы включают в себя аллергический грибковый синусит и грибковое тело (шар) [8]. Отличительной чертой инвазивных грибковых синуситов является наличие деструкции костной стенки околоносовых пазух (ОНП), а также сосудистой инвазии [9]. Развитие той или иной формы во многом зависит от иммунологического состояния макроорганизма. Острые инвазивные грибковые синуситы обычно встречаются у иммунокомпрометированных пациентов, в то время как хронические инвазивные и неинвазивные синуситы характерны для пациентов с нормальным иммунным статусом (иммунокомпетентных) [10, 11].
Особую опасность грибковые синуситы представляют для иммунокомпрометированных пациентов, находящихся в процессе трансплантации гемопоэтических стволовых клеток (ТГСК) [5, 12]. При этом инфекционные осложнения могут возникать как в периоде после трансплантации, так и на этапе проведения противоопухолевой химиотерапии (ПХТ), которая выполняется с целью достижения ремиссии основного заболевания и обеспечения возможности проведения ТГСК [13].
Среди гематологических заболеваний к группе повышенного риска развития инвазивных микозов относятся пациенты с острым миелобластным лейкозом (ОМЛ) в период проведения ПХТ индукции ремиссии [14]. У большинства пациентов с ОМЛ для обеспечения долгосрочной выживаемости программной химиотерапии недостаточно и единственным излечивающим методом терапии является аллогенная ТГСК [15, 16]. Развитие инвазивного микоза на этапе ПХТ может быть препятствием для своевременного проведения ТГСК, но при ранней диагностике и адекватной терапии наличие инвазивного микоза до трансплантации не влияет на долгосрочные результаты [13].
Представляем клиническое наблюдение успешного лечения инвазивного мукормикоза ОНП, возникшего на этапе ПХТ, перед аллогенной ТГСК.
Клиническое наблюдение
Пациентка Г., 44 года, находилась на лечении в отделении химиотерапии и трансплантации костного мозга НИИ ДОГиТ им. Р.М. Горбачевой с диагнозом «Острый миелоидный лейкоз без созревания» (М1 вариант по франко-американо-британской классификации). Ремиссия ОМЛ не была достигнута в результате стандартного курса ПХТ индукции ремиссии по схеме «7+3» (непрерывное введение цитарабина в течение 7 дней и болюсное введение митоксантрона в течение 3 дней). Для индукции ремиссии была назначена ПХТ «FLAG-Ida» (режим, включающий использование флударабина, цитарабина, гранулоцитарного колониестимулирующего фактора, а также идарубицина), достигнута ремиссия основного заболевания. В соответствии с российскими и международными рекомендациями, с учетом возраста, диагноза, течения заболевания пациентке было показано проведение аллогенной ТГСК от донора в первой ремиссии [17]. В российском и международном регистре был инициирован поиск совместимого донора для трансплантации. С целью закрепления и поддержания полученного эффекта пациентке начата стандартная ПХТ консолидации ремиссии с использованием высоких доз цитарабина со 2 июля 2019 г. С начала курса ПХТ у пациентки диагностирован бартолинит, по поводу которого была назначена комбинированная антибактериальная терапия (цефоперазон + сульбактам, ванкомицин). На 15-й день от начала химиотерапии, 9-й день агранулоцитоза и тромбоцитопении 4-й степени, на фоне проводимой антибактериальной терапии развилась нейтропеническая лихорадка, отмечался рост показателя С-реактивного белка до 245 мг/л с единственным клиническим признаком локализованной инфекции — заложенностью носа. На обзорной рентгенограмме обнаружено затемнение верхнечелюстной пазухи. Выполнена пункция левой верхнечелюстной пазухи, по результатам исследования при микроскопии и бактериологического исследования промывных вод возбудителя не обнаружено. Модифицирована антибактериальная терапия (имипенем + циластатин, линезолид, тигециклин) — с временным эффектом. На 17-й день от начала химиотерапии (11-й день агранулоцитоза) возобновились подъемы температуры тела выше 38 °C, появился отек над- и подглазничной области слева.
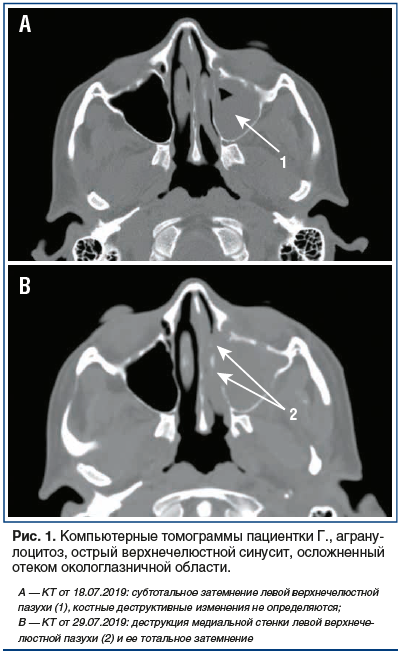
При компьютерной томографии (КТ) ОНП отмечалось субтотальное затемнение левой верхнечелюстной пазухи без признаков деструкции костных стенок (рис. 1 А).
С учетом группы риска и клинических проявлений, которые могут быть характерны для инвазивного микоза ОНП, пациентке назначена противогрибковая профилактика препаратом позаконазол.
Повторно выполнена пункция левой верхнечелюстной пазухи, по результатам исследования на 2-е сутки посева получен рост мукорового гриба Lichtheimia corymbifera. С учетом группы риска, клинических проявлений и лабораторного подтверждения, в соответствии с критериями Европейской организации по изучению и лечению рака (European Organization for Research and Treatment of Cancer) и Группы изучения микозов (Mycoses Study Group) Национального института аллергологии и инфекционных заболеваний (The National Institute of Allergy and Infectious Diseases, NIAID), США [9] установлен диагноз мукормикоза с поражением верхнечелюстной пазухи и начата стартовая антимикотическая терапия в соответствии с рекомендациями 2019 г. [18]: амфотерицин В (липидный комплекс) внутривенно в дозе 5 мг/кг/сут. Проводились пункции левой верхнечелюстной пазухи на фоне антимикотической терапии.
С целью оценки динамики проводимого лечения через 5 дней терапии амфотерицином В в сочетании с позаконазолом (10 дней) 29.07.2019 была выполнена контрольная КТ ОНП, на которой обнаружена деструкция носовых раковин, стенок решетчатого лабиринта слева, нарастание отека (рис. 1 В).
С учетом появления деструкции костей на фоне терапии принято решение об оперативном лечении в объеме эндоскопического вскрытия левой верхнечелюстной пазухи, несмотря на затянувшуюся цитостатическую панцитопению. По данным миелограммы подтверждено наличие ремиссии основного заболевания. В качестве терапии спасения, с учетом появления деструкции к комбинированной терапии добавлен каспофунгин.
В клинике НИИ ДОГиТ им. Р.М. Горбачевой 01.08.2019 в условиях общей анестезии пациентке было выполнено оперативное вмешательство по поводу острого левостороннего грибкового синусита. Показатели крови в день операции: тромбоциты — 22 (норма — 150–400×10 9 /л), гемоглобин — 74 (норма — 115–145 г/л), лейкоциты — 1,4 (норма — 4–8,8×10 9 /л), нейтрофилы (абс.) — 0,72 (норма — 2,2–4,8×10 9 /л), лимфоциты (абс.) — 0,5 (норма — 1,2–2,5×10 9 /л). С целью профилактики интра- и постоперационного кровотечения пациентке было введено 0,503 мл тромбоцитарной взвеси.
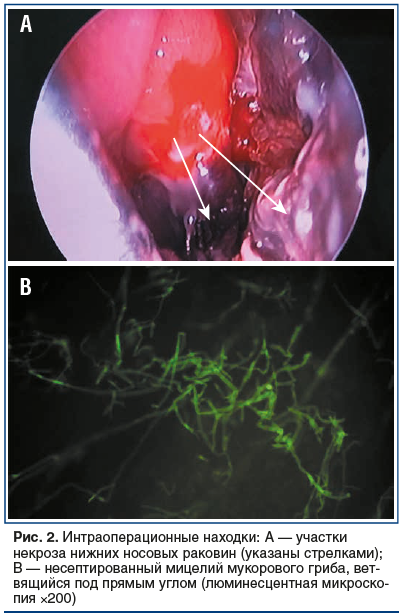
Интраоперационные находки: при осмотре средняя и нижняя носовые раковины синюшны, некротизированы, также отмечается некроз латеральной стенки левой половины носа (рис. 2А). Выполнена резекция средней и нижней носовых раковин. Затем сформировано широкое соустье с левой верхнечелюстной пазухой. Отмечается мягкость костных стенок в области среднего и нижнего носовых ходов. В пазухе обнаружены полипозные изменения фиброзной плотности, патологические участки удалены. В конце операции вскрыты клетки решетчатого лабиринта. Интраоперационный материал был отправлен в отделение клинической микробиологии для микроскопического и микологического (культурального) исследования. Проведен гемостаз классической передней и задней тампонадой. В результатах микроскопии обнаружен мицелий мукорового гриба (рис. 2В).
Послеоперационный период протекал без осложнений. В условиях операционной 05.08.2019 выполнено растампонирование полости носа, а также ревизия левой верхнечелюстной пазухи, резекция патологических участков.
В послеоперационном периоде пациентка наблюдалась врачом-оториноларингологом, проводился туалет полости носа, продолжалась комбинированная противогрибковая терапия. Ее продолжительность составила 2 нед. после операции, с последующей деэскалацией. Контроль эффективности терапии проводился путем эндоскопического осмотра и микологического исследования отделяемого из послеоперационной раны.
Несмотря на высокий риск возврата инфекции и развития жизнеугрожающих осложнений, с целью сохранения ремиссии ОМЛ была продолжена ПХТ без редукции доз цитостатиков на фоне продолжающейся противогрибковой терапии — применение позаконазола.
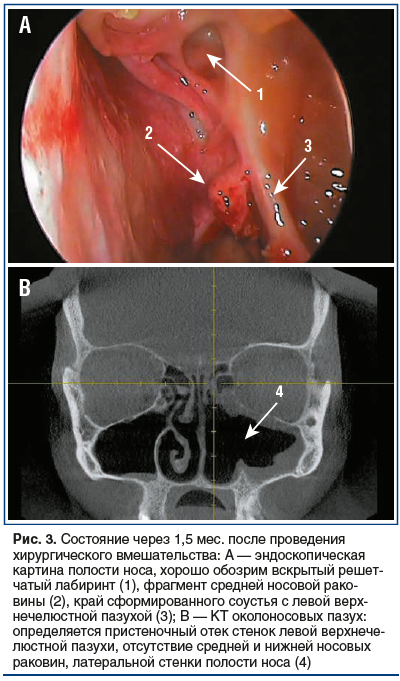
При контрольном осмотре через 1,5 мес. после операции в полости носа признаков воспалительных явлений не отмечается, слизистая умеренно бледная, неотечная. Отсутствуют средняя и нижняя носовые раковины (результат резекции), верхнечелюстная пазуха слева хорошо обозрима, в пазухе определяются рубцово-отечные изменения (рис. 3). Признаков грибкового поражения не обнаружено. В контрольных результатах микологического исследования грибка не обнаружено.
Пациентка завершила курс ПХТ, рецидива мукормикоза на фоне вторичной профилактики позаконазолом не наблюдалось. В международном регистре найден совместимый донор гемопоэтических стволовых клеток, и в последующем успешно проведена аллогенная ТГСК.
Обсуждение
Представленное клиническое наблюдение демонстрирует успешные диагностические и лечебные мероприятия в сложной клинической ситуации редкого жизнеугрожающего осложнения терапии гематологических опухолей и подчеркивает важность оперативного взаимодействия специалистов разных специальностей — мультидисциплинарного подхода.
Заключение
В настоящее время происходит постоянное совершенствование оказания медицинской помощи пациентам с заболеваниями крови. Несмотря на современные достижения в онкогематологии, часть вопросов, касающихся профилактики и лечения инфекционных осложнений у этого контингента пациентов, лежит в сфере компетентности врачей смежных специальностей. В представленном клиническом случае своевременная диагностика и комплексное лечение мукормикоза полости носа и ОНП позволили провести не только раннюю противогрибковую терапию, но и хирургическое лечение. Это сделало возможным последующее выполнение пациентке аллогенной ТГСК, являющейся современным методом лечения ее основного заболевания. Рецидивов мукормикоза в посттрансплантационном периоде не наблюдалось. Накопление подобного опыта позволит в будущем его обобщить и выработать оптимальные алгоритмы профилактики и лечения подобных осложнений.
Только для зарегистрированных пользователей
ВЫБОР АНТИМИКРОБНЫХ ХИМИОПРЕПАРАТОВ ПРИ ГРИБКОВЫХ ИНФЕКЦИЯХ
За последние 20 лет количество грибковых инфекций (микозов) резко возросло. Это связано преимущественно с внедрением новых медицинских технологий и значительным увеличением числа пациентов с иммунодефицитом. Спектр возбудителей микозов быстро расширяется, в настоящее время известно более 400 видов грибов, вызывающих заболевания у человека.
Клинические проявления инфекций, обусловленных грибами, широко варьируют от относительно безобидных поверхностных поражений слизистых оболочек и кожи до угрожающих жизни инвазивных микозов, при которых могут поражаться практически любые органы.
В данной главе представлены показания к проведению лечения (критерии диагностики) наиболее распространенных микозов, главные направления лечения, дозы антимикотиков и сроки их применения.
Поскольку микозы обычно развиваются у пациентов с теми или иными нарушениями в системе противоинфекционной защиты (факторами риска), их устранение или уменьшение выраженности должно быть обязательным компонентом лечения и профилактики рецидива микозов. В задачу данной главы не входит детальный разбор этих мероприятий, указаны лишь некоторые из них. Кроме применения противогрибковых препаратов и устранения факторов риска, обязательным условием эффективного лечения некоторых инвазивных микозов является своевременное хирургическое удаление пораженных тканей.
КАНДИДОЗ
Основные возбудители
Основными возбудителями кандидоза являются C.albicans, C.tropicalis, C.parapsilosis, C.glabrata и C.krusei. Значительно реже встречаются C.lusitaniae, C.guillermondii, C.rugosa и др. Несмотря на то, что наиболее распространенным возбудителем остается C.albicans, за последние 15-20 лет отмечено значительное увеличение числа инфекций, вызываемых C.tropicalis, C.parapsilosis, C.glabrata и C.krusei.
Таблица. Чувствительность основных возбудителей кандидоза к противогрибковым препаратам
На практике определение вида возбудителя рекомендуется проводить при инвазивном кандидозе, а также при рецидивирующем течении и/или резистентности поверхностного кандидоза к стандартной терапии.
Candida spp. являются обитателями организма человека. Они выявляются при посевах со слизистой оболочки полости рта и ЖКТ у 30-50% здоровых людей и со слизистой оболочки гениталий у 20-30% здоровых женщин. Поэтому важно уметь различать кандидоз и колонизацию слизистых оболочек или кожи.
Факторы риска
Факторами риска развития кандидоза являются уменьшение числа и нарушение функции нейтрофилов и Т-лимфоцитов различного генеза; эндокринопатии; злокачественные новообразования; использование катетеров (сосудистых, мочевых, перитонеальных и др.); травмы, распространенные ожоги и хирургические вмешательства; применение АМП широкого спектра действия, глюкокортикоидов, иммуносупрессантов и инфузионной терапии; преждевременные роды; трансплантация органов и тканей.
Классификация
Спектр заболеваний, вызываемых Candida spp., очень широк. Проявления этой инфекции варьируют от поверхностного кандидоза с поражением слизистых оболочек, кожи и ногтей до инвазивного и диссеминированного поражения различных органов и тканей.
ИНВАЗИВНЫЙ КАНДИДОЗ
Инвазивный кандидоз характеризуется тяжестью клинических проявлений и высокой (30-70%) летальностью. В связи с этим адекватность противогрибковой терапии у пациентов с инвазивным кандидозом имеет особое значение. Основными антимикотиками для лечения инвазивного кандидоза являются амфотерицин В и флуконазол. Роль других азолов менее значима в связи с вариабельной биодоступностью при приеме внутрь и относительно небольшом опыте в лечении. При выборе препарата следует учитывать вид возбудителя и его чувствительность к антимикотикам.
Важным компонентом лечения инвазивного кандидоза являются устранение или уменьшение выраженности факторов риска (удаление в/в или мочевых катетеров, компенсация сахарного диабета и др.).
КАНДИДЕМИЯ И ОСТРЫЙ ДИССЕМИНИРОВАННЫЙ КАНДИДОЗ
Показания к терапии
Острый диссеминированный кандидоз:
Выбор антимикробных препаратов
Выбор антимикотика зависит от вида возбудителя и его чувствительности к противогрибковым средствам, а также клинического состояния больного.
| Возбудитель: C.albicans, C.tropicalis, C.parapsilosis | флуконазол 6,0 мг/кг/сут амфотерицин В 0,6 мг/кг/сут |
| Возбудитель: C.glabrata | амфотерицин В 0,8-1,0 мг/кг/сут флуконазол 12 мг/кг/сут |
| Возбудитель: C.krusei | амфотерицин В 1,0 мг/кг/сут |
| Возбудитель: C.lusitaniae, С.guillermondii | флуконазол 6,0 мг/кг/сут |
| Возбудитель: не определен | амфотерицин В 1,0 мг/кг/сут |
| Состояние пациента нестабильно (шок, полиорганная недостаточность) | амфотерицин В 0,6 мг/кг/сут |
Липосомальный амфотерицин В в дозе 3,0 мг/кг/сут рекомендуется применять при почечной недостаточности (креатинин сыворотки крови более 220 мкмоль/л или клиренс креатинина менее 25 мл/мин), при неэффективности стандартного амфотерицина В после его применения в суммарной дозе 7,0 мг/кг, а также в случае его нефротоксичности (повышение концентрации креатинина в сыворотке крови более 220 мкмоль/л у взрослых и более 133 мкмоль/л у детей) или выраженных инфузионных реакциях, не купируемых премедикацией.
После стабилизации состояния пациента и уточнения вида возбудителя амфотерицин В (стандартный или липосомальный) может быть заменен флуконазолом.
Всем пациентам с кандидемией показано раннее удаление (замена) всех внутрисосудистых катетеров.
Длительность терапии: не менее 2 нед после исчезновения всех клинических признаков кандидемии и острого диссеминированного кандидоза и последнего выявления Candida spp. при посеве крови и биосубстратов из очагов поражения. После завершения лечения показано наблюдение в течение не менее 2 мес для исключения возникновения поздних очагов гематогенной диссеминации.
ЭМПИРИЧЕСКАЯ ПРОТИВОГРИБКОВАЯ ТЕРАПИЯ У ПАЦИЕНТОВ С РЕЗИСТЕНТНОЙ К АНТИБИОТИКАМ НЕЙТРОПЕНИЧЕСКОЙ ЛИХОРАДКОЙ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Препараты выбора: амфотерицин В 0,6-0,7 мг/кг/сут; липосомальный амфотерицин В 3,0 мг/кг/сут.
Длительность терапии: не менее 7 дней после нормализации температуры тела и завершение периода нейтропении (менее 1,0 x 10 9 /л).
ЭМПИРИЧЕСКАЯ ПРОТИВОГРИБКОВАЯ ТЕРАПИЯ ПРИ ВЫСОКОМ РИСКЕ РАЗВИТИЯ ОСТРОГО ДИССЕМИНИРОВАННОГО КАНДИДОЗА У ПАЦИЕНТОВ БЕЗ НЕЙТРОПЕНИИ
Показания к терапии
Терапия показана при сочетании следующих признаков:
Выбор антимикробных препаратов
Препараты выбора: флуконазол 6,0 мг/кг/сут.
Альтернативные препараты: амфотерицин В 0,6-0,7 мг/кг/сут.
Длительность терапии: не менее 5 дней после нормализации температуры тела.
ХРОНИЧЕСКИЙ ДИССЕМИНИРОВАННЫЙ (ГЕПАТОЛИЕНАЛЬНЫЙ) КАНДИДОЗ
Показания к терапии
«Вероятный» хронический диссеминированный кандидоз (у пациентов с факторами риска):
персистирующая лихорадка после завершения периода нейтропении в сочетании с характерными ультразвуковыми или компьютерно-томографическими или магнитно-резонансно-томографическими признаками поражения печени и/или селезенки.
«Доказанный» хронический диссеминированный кандидоз:
вышеуказанное в сочетании с высевом Candida spp. из крови до появления признаков поражения печени и/или селезенки или с выявлением возбудителя при гистологическом исследовании и/или посеве биопсийного материала из очагов поражения.
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью (см. раздел «Кандидемия и острый диссеминированный кандидоз»). Важными условиями успешного лечения являются длительное (3-6 мес) применение антимикотиков, а также антифунгальная профилактика рецидива после достижения ремиссии.
Препараты выбора: флуконазол 6,0 мг/кг/сут в течение 3-6 мес; амфотерицин В 0,6-0,7 мг/кг/сут в течение 3-6 мес; амфотерицин В 0,6-0,7 мг/кг/сут в течение 1-3 нед, затем флуконазол 6,0 мг/кг/сут в течение 3-6 мес.
КАНДИДОЗНЫЙ МЕНИНГИТ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Препараты выбора: амфотерицин В 0,7-1,0 мг/кг/сут.
Длительность терапии: не менее 4 нед после исчезновения всех признаков инфекции.
Необходимо удаление контаминированных катетеров, шунтов и т.п. и коррекция внутричерепного давления.
КАНДИДОЗНАЯ ПНЕВМОНИЯ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Вторичная пневмония вследствие гематогенной диссеминации: лечить как острый диссеминированный кандидоз (см. раздел «Кандидемия и острый диссеминированный кандидоз»)
КАНДИДОЗНЫЙ ОСТЕОМИЕЛИТ И КАНДИДОЗНЫЙ АРТРИТ
Показания к терапии
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью (см. раздел «Кандидемия и острый диссеминированный кандидоз»). Важным условием успешного лечения является длительное применение антимикотиков.
Препараты выбора: амфотерицин В 0,5-1,0 мг/кг/сут в течение 6-10 нед (внутрисуставное введение амфотерицина В не рекомендуется!); флуконазол 6,0 мг/кг/сут в течение 6-12 мес; амфотерицин В 0,5-1,0 мг/кг/сут в течение 2-3 нед, затем флуконазол 6,0 мг/кг/сут в течение 6-12 мес.
Проводят хирургическое удаление пораженных тканей, удаление протеза, адекватное дренирование пораженного сустава.
КАНДИДОЗНЫЙ ПЕРИТОНИТ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью (см. раздел «Кандидемия и острый диссеминированный кандидоз»).
Препараты выбора: амфотерицин В 0,6-1,0 мг/кг/сут в течение 2-4 нед; флуконазол 6,0 мг/кг/сут в течение 2-4 нед.
Проводят хирургическое лечение с дренированием брюшной полости, удаление катетера для перитонеального диализа.
Интраперитонеальное введение амфотерицина В не рекомендуется в связи с высокой вероятностью развития химического перитонита.
КАНДИДОЗНЫЙ ЭНДОКАРДИТ, ПЕРИКАРДИТ, ФЛЕБИТ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью, липосомальный амфотерицин В назначается при наличии показаний (см. раздел «Кандидемия и острый диссеминированный кандидоз»).
Препараты выбора: амфотерицин В 1,0-1,5 мг/кг/сут в течение не менее 6 нед после хирургического лечения; флуконазол 10-12 мг/кг/сут в течение 2-6 мес; липосомальный амфотерицин В 3,0-5,0 мг/кг/сут в течение 2-6 мес.
Проводят хирургическое удаление инфицированных клапанов сердца, резекцию пораженных участков периферических вен и перикарда.
Наблюдение за пациентами в течение не менее 1 года после завершения лечения.
КАНДИДОЗНЫЙ РЕТИНИТ, ЭНДОФТАЛЬМИТ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью, липосомальный амфотерицин В назначается при наличии показаний (см. раздел «Кандидемия и острый диссеминированный кандидоз»).
Препараты выбора: амфотерицин В 0,8-1,0 мг/кг/сут в течение 6-12 нед; флуконазол 6,0-12 мг/кг/сут в течение 6-12 нед; липосомальный амфотерицин В 3,0-5,0 мг/кг/сут в течение 2-6 мес.
Эффективность введения антимикотиков в стекловидное тело не определена.
КАНДИДОЗ ГОРТАНИ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Выбор препарата определяется видом возбудителя и его чувствительностью (см. раздел «Кандидемия и острый диссеминированный кандидоз»).
Препараты выбора: амфотерицин В 0,7-1,0 мг/кг/сут в течение 3-6 нед; флуконазол 6,0 мг/кг/сут в течение 3-6 нед.
КАНДИДОЗ МОЧЕВЫВОДЯЩИХ ПУТЕЙ
Показания к терапии
Терапия показана при наличии следующих признаков:
Выбор антимикробных препаратов
Препараты выбора: флуконазол 3,0 мг/кг/сут в течение 1-2 нед.
Промывание мочевого пузыря амфотерицином В (50-200 мкг/мл) обычно сопровождается временным прекращением кандидурии, однако этот метод лечения неэффективен при поражении вышележащих отделов МВП.
Необходимо удаление или замена мочевых катетеров.
При бессимптомной кандидурии у пациентов без факторов риска развития острого диссеминированного кандидоза применение антимикотиков не рекомендуется, показано устранение или уменьшение влияния факторов риска (удаление или замена мочевого катетера, оптимизация АМП, коррекция сахарного диабета и т.д.).
АНТИФУНГАЛЬНАЯ ПРОФИЛАКТИКА ИНВАЗИВНОГО КАНДИДОЗА
Применение антимикотиков для первичной профилактики инвазивного кандидоза рекомендуется только для пациентов с высоким (не менее 15%) риском возникновения этого осложнения. В настоящее время в контролируемых клинических исследованиях доказана эффективность антифунгальной профилактики инвазивного кандидоза у реципиентов трансплантатов костного мозга и печени, а также у хирургических пациентов с повторной перфорацией ЖКТ. Неоправданное профилактическое применение антимикотиков в группах с низким риском инвазивного кандидоза не только бесполезно, но и вредно, поскольку может сопровождаться НР и способствовать селекции резистентных к противогрибковым препаратам штаммов Candida spp.
ПРОФИЛАКТИКА ИНВАЗИВНОГО КАНДИДОЗА У БОЛЬНЫХ С НЕЙТРОПЕНИЕЙ
Показания
Продолжительный агранулоцитоз (число палочкоядерных и сегментоядерных нейтрофилов в периферической крови менее 0,5 x 10 9 /л) у реципиентов трансплантатов кроветворных стволовых клеток.
Профилактика
Флуконазол 0,4 мг/сут в периоде нейтропении.