что такое мпс в кардиологии у новорожденных
Что такое мпс в кардиологии у новорожденных
Что такое дефект межпредсердной перегородки?
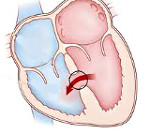
В нормальном сердце правые и левые отделы разделены между собой тонкой стенкой, так называемой перегородкой. Дефект межпредсердной перегородки это отверстие между камерами сердца – левым и правым предсердиями (Рис 1). Давление в левых отделах сердца в норме выше, чем правых. Кровь из левого предсердия попадает в правое передсердие, затем в правый желудочек и легочную артерию, вызывая растяжение и перегрузку этих отделов сердца. Это в свою очередь приводит к ряду неприятных проблем.
Естественное течение порока. Или к чему приведет дефект межпредсердной перегородки?
Перегруженные кровью правый желудочек и правое предсердие увеличиваются в размерах, что приводит к нарушению работы сердца, развитию сердечной недостаточности и различных аритмий. Порок проявляется отдышкой, постоянным чувством усталости, а в запущенных случаях – отеками и ощущением перебоев в работе сердца. Перегрузка кровью легочной артерии приводит к развитию частых бронхо-легочных заболеваний, а в запущенных случаях – к необратимым изменениям со стороны сосудов легких, их склерозу. В таких случаях закрытие дефекта межпредсердной перегородки противопоказано.
Что такое открытое овальное окно?
У некоторых здоровых людей есть небольшая щель между предсердиями, которая называется открытым овальным окном. Такая щель есть у плода в утробе матери и, как правило, закрывается она самостоятельно в первые несколько месяцев жизни. Открытое овальное окно не является пороком развития и не приводит к развитию тех симптомов, которые проявляются при дефекте межпредсердной перегородки. Довольно редко у взрослых людей открытое овальное окно может привести к развитию внезапной тромбоэмболии сосудов головного мозга (инсульту у лиц молодого возраста). Только в этом случае открытое овальное окно требует эндоваскулярного закрытия.
Лечение дефекта межпредсердной перегородки.
Эндоваскулярное закрытие ДМПП
Рис 2 – Внешний вид окклюдера
Рис 3 – Окклюдер на системе доставки
Рис 4 – Окклюдер может растягиваться и деформироваться, но в сердце он примет нужную нам форму
Рис 5 – Окклюдер частично сложен в систему доставки (вид сзади)
Рис 6 – Окклюдер частично сложен в систему доставки (вид спереди)
Рис 7 – Окклюдер полностью сложен в систему доставки диаметром всего в 4 мм
Материалы, из которых сделан окклюдер полностью биосовместимые и гипоалергенные, не имеют магнитных свойств. Эндоваскулярное вмешательство выполняется в условиях рентгеноперационной. Перед проведением операции эндоваскулярного закрытия дефекта межпредсердной перегородки всем пациентам проводится транспищеводное ультразвуковое исследование сердца (УЗИ). Поскольку наше сердце располагается непосредсдвенно за пищеводом, транспищеводное УЗИ дает полную информацию об анатомии такого порока сердца.
Рис 8 – Транспищеводная ЭхоКГ
Рис 9 – Измерение размера дефекта по данным ЭхоКГ
Рис 10 – Измерение размера дефекта с помощью измерительного баллона, который заведен и раздут в отверстии между предсердиями. Размер перетяжки на баллоне соответствует размеру дефекта.
Рис 11 – Система доставки заведена в бедренную вену
Рис 12 – Дефект закрыт окклюдером (транспищеводная ЭхоКГ)
Только этот метод диагностики позволит точно определить показания и противопоказания к эндоваскулярному лечению (Рис 8). Транспищеводный датчик у большинства пациентов вызывает дискомфорт, поэтому операция закрытия дефекта межпредсердной перегородки окклюдером проводится под наркозом. Ни разреза грудной клетки, ни использования аппарата искусственного кровообращения при этом не требуется.
Размер дефекта измеряют по ЭхоКГ (Рис 9) или определяют с помощь измерительного баллона (Рис 10). Затем через прокол вены на бедре (Рис 11) окклюдер в «упакованном» виде, по ходу естественных сосудов вводится в полости сердца, под контролем рентгеноскопии и эхокардиографии устанавливается таким образом, что один из его дисков располагается в левом предсердии, другой – в правом предсердии. Дефект оказывается полностью закрыт заплаткой, которая исключает сброс крови из левого предсердия в правое(Рис 12).
Реабилитация после процедуры
Как правило, пациентов выписывают на следующий день после процедуры. На месте введения катетера в сосуд еще некоторое время должна оставаться стерильная повязка. Некоторое время после процедуры вы будете чувствовать дискомфорт в горле, обусловленный введением транспищеводного датчика. В течение 6 месяцев после операции вы будете принимать аспирин для профилактики тромбообразования и в случае простудных заболеваний проводить антибиотикопрофилактику инфекционного эндокардита. В течение одного месяца после процедуры необходимо будет ограничить физические нагрузки. Уже через 6 месяцев после операции окклюдер полностью покрывается собственными клеточками сердца – эндотелизируется. До этого времени пациентам стоит воздержаться от плановой вакцинации и планирования беременности. Спустя 6 месяцев наш пациент может вести привычный для него образ жизни – теперь он абсолютно здоров! У нас наибольший в Украине опыт по эндоваскулярному закрытию вторичного дефекта межпредсердной перегородки – более 350 операций. Мы имеем доступ к оборудованию для закрытия дефектов любых размеров. Для того чтобы попасть к нам на консультацию или госпитализироваться позвоните по одному из телефонов или запишитесь на прием онлайн.
| • МПС I, II и VII – системные заболевания, поражающие различные органы и ткани, включая ЦНС; неврологические нарушения не бывают изолированными. |
| • МПС III характеризуется поражением ЦНС при отсутствии соматических проявлений. |
| • МПС IV поражает в основном опорно-двигательный аппарат и не сопровождается снижением интеллекта. |
| • При МПС VI наблюдается поражение различных органов и систем, интеллект остается нормальным. |
| Тип | Название | Фермент | Ген | Тип наследования | Лечение |
|---|---|---|---|---|---|
| МПС I | Синдромы Гурлера, Шейе или Гурлера-Шейе | α-L-идуронидаза | IDUA 4p16.3 | Аутосомно-рецессивный | Ларонидаза |
| МПС II | Синдром Хантера | Идуронат-2-сульфатаза | IDS Xq28 | X-сцепленный рецессивный | Идурсульфаза |
| МПС IIIA | Синдром Санфилиппо A | Гепаран-N-сульфатаза | SGSH 17q25.3 | Аутосомно-рецессивный | Разрабатывается |
| МПС IIIB | Синдром Санфилиппо В | α-N-ацетилглюкозаминидаза | NAGLU 17q21 | Аутосомно-рецессивный | |
| МПС IIIC | Синдром Санфилиппо С | Ацетил-КоА α-глюкозамин-ацетил-трансфераза | HGSNAT 8p11.1 | Аутосомно-рецессивный | |
| МПС IIID | Синдром Санфилиппо D | N-ацетилглюкозамин-6-сульфатаза | GNS 12q14 | Аутосомно-рецессивный | — |
| MПС IVA | Синдром Моркио А | Галактозамин-6 сульфатсульфатаза | GALNS 16q24.3 | Аутосомно-рецессивный | Элосульфаза |
| MПС IVB | Синдром Моркио В | β-Галактозидаза | GLB1 3p21.33 | Аутосомно-рецессивный | — |
| MПС VI | Синдром Марото-Лами | Арилсульфатаза B | ARSB 5q11.q13 | Аутосомно-рецессивный | Галсульфаза |
| МПС VII | Синдром Слая | β-Глюкуронидаза | GUSB 7q21.11 | Аутосомно-рецессивный | Разрабатыва |
| МПС IX | Синдром Натовича | Гиалуронидаза I | AH 3p21.3-p21.2 | Аутосомно-рецессивный | — |
Своевременная диагностика МПС сегодня приобрела особое значение, учитывая возможность заместительной терапии рекомбинантными ферментами, такими как идурсульфаза (МПС II), ларонидаза (МПС I), галсульфаза (МПС VI) и элосульфаза (МПС IVA), которые позволяют улучшить состояние больных или по крайней мере затормозить прогрессирование заболевания [5]. Ферментозаместительная терапия (ФЗТ) более эффективна, если ее начинают на более раннем этапе, когда еще отсутствуют необратимые проявления болезни.
Трудности диагностики МПС
МПС относятся к очень редким (орфанным) заболеваниям. В разных странах различные МПС регистрировали с частотой 1 на 16000-29000 живых новорожденных [6,7], а в 2007 году в Скандинавских странах распространенность МПС составила всего 4-7 случаев на 1 млн населения [8]. В связи с этим информированность врачей, особенно наблюдающих взрослых пациентов, о МПС низкая. Дополнительные сложности в диагностике возникают при более легком течении МПС, особенно при отсутствии типичных фенотипических проявлений, таких как низкий рост и характерные черты лица. Например, в зависимости от клинических проявлений и течения выделяют три формы МПС I – тяжелую (синдром Гурлера), промежуточную (синдром Гурлера-Шейе) и более легкую (синдром Шейе). Во всех случаях причиной заболевания является мутация гена, кодирующего α-L-идуронидазу. У пациентов с синдромом Гурлера симптомы появляются в раннем детском возрасте и часто наблюдается тяжелое поражение ЦНС, в то время как при синдроме Шейе симптомы менее выражены и возникают значительно позднее, а когнитивные расстройства обычно отсутствуют [9]. Два варианта течения заболевания – тяжелый и более легкий – возможны и при МПС VI (синдроме Марото–Лами), обусловленном мутациями гена, кодирующего арилсульфатазу В.
В клинике им. Е.М. Тареева за последние 3 года были обследованы 5 взрослых пациентов в возрасте от 20 до 33 лет с МПС VI. У трех из них диагноз был установлен в подростковом возрасте (от 7 до 16 лет), а у двух – в возрасте 23 и 30 лет, соответственно. Необ хо димо подчеркнуть, что хотя у двух последних пациенток наблюдалось замедленное прогрессирование заболевания, тем не менее, в обоих случаях на момент госпитализации в клинику имелось тяжелое поражение опорно-двигательного аппарата с резким ограничением подвижности в суставах, пороки клапанов сердца, стеноз шейного отдела позвоночника, нарушение проходимости дыхательных путей, поражение органа зрения и др. Обе пациентки были низкого роста (132 и 146 см) [4].
Замедленное прогрессирование течение иногда на блюдается и при МПС II (синдроме Хантера). Два года назад в нашу клинику был госпитализирован 42-летний пациент с МПС II, который был диагностирован в возрасте 13 лет на основании характерных изменений внешнего вида и наличия синдрома Хантера у старшего брата и подтвержден при энзимологическом (дефицит активности идуронат-2-сульфатазы) и молекулярногенетическом (мутация с.236С>А гена IDS в гемизиготном состоянии) исследованиях [10]. В течение длительного времени состояние пациента оставалось удовлетворительным. Успешно закончил школу, а затем институт. Работал инженером на заводе. С 30-летнего возраста прогрессирующее снижение чувствительности и боли в кистях и стопах, ухудшение зрения и выпадение центральных полей зрения, однако продолжал работать. Резкое ухудшение состояния, связанное с развитием сердечной недостаточности на фоне тяжелого порока аортального клапана, было отмечено только за год до госпитализации, т.е. в возрасте около 40 лет.
При обращении к ревматологу на МПС может указывать поражение суставов, не сопровождающееся признаками воспаления, такими как припухание, повышение СОЭ и/или уровня С-реактивного белка [12]. T. Rocha Siqueira и соавт. измеряли экскрецию ГАГ с мочой у 55 пациентов в возрасте от 3 до 21 года (в среднем 9 лет) с невоспалительной артропатией неясного генеза. У всех больных определялись дискомфорт или боль в суставах, а у 2/3 – скованность [12]. Экскре ция ГАГ была повышена у 1 из 55 больных. При дополнительном обследовании у 15-летней пациентки был установлен диагноз МПС II. Хотя очевидным ограничением этого исследования было небольшое число обследованных пациентов, тем не менее, полученные данные указывают на возможную роль скрининга в диагностике более легких форм МПС.
Как заподозрить МПС?
В настоящее время известно 11 лизосомных ферментов, дефицит которых приводит к развитию 7 типов МПС [13]. Замедленное прогрессирование заболевания и более поздняя диагностика чаще отмечаются у пациентов с МПС I, IV, VI и VII, в то время как другие типы МПС обычно характеризуются тяжелым течением и более короткой продолжительностью жизни. Следует отметить, что в задачи практического врача не входит дифференциальная диагностика различных МПС – вполне достаточно заподозрить этот диагноз и направить пациента на консультацию к генетику и/или провести скрининговое исследование (определение экскреции ГАГ с мочой).
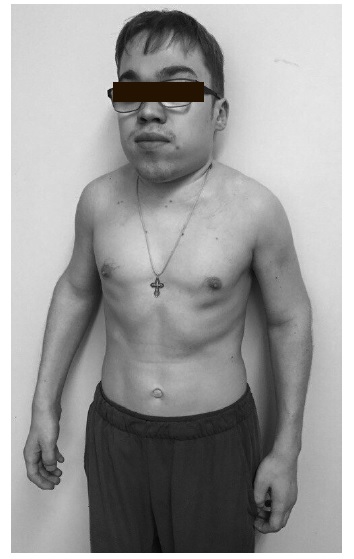
Хотя МПС представляют собой неоднородную группу болезней и отличаются по тяжести течения и частоте поражения центральной нервной системы, тем не менее, в целом клинические проявления некоторых из них достаточно однотипны и позволяют предположить наличие заболевания, особенно у пациентов старшего возраста при наличии типичного фенотипа. При осмотре пациентов с МПС прежде всего обращают на себя внимание низкий рост, непропорциональное строение скелета (короткие туловище и шея, длинные конечности), а также грубые черты лица, толстые губы, увеличение языка, запавшее переносье, увеличение расстояния между глазами (гипертелоризм) (рис. 1, 2). При тяжелом течении МПС рост пациентов не превышает 95-100 см, хотя при медленном развитии заболевания может достигать 140-150 см. Например, в нашей серии наблюдений рост 5 взрослых пациентов с МПС VI варьировался от 132 до 153 см, а рост 42-летнего пациента с МПС II составлял 158 см. В крупном исследовании среди 121 пациента с МПС VI доля взрослых составляла около 25% [14]. Средний рост больных в возрасте 19-24 и 25-56 лет равнялся 142,7±20,1 и 157,0±8,5 см, соответственно. Таким образом, по крайней мере у части больных МПС рост может быть фактически нормальным.
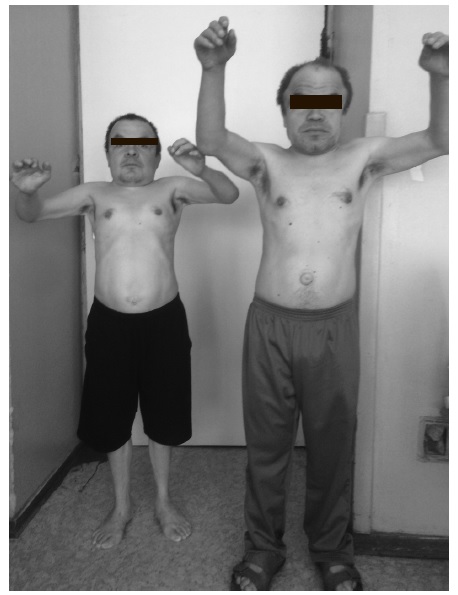
При всех МПС развивается тяжелое поражение опорно-двигательного аппарата (множественный дизостоз), которое проявляется тугоподвижностью и контрактурами суставов (в большей степени ухудшается разгибание), деформацией кистей (“когтистая лапа”) (рис. 3) и позвоночника (кифоз, сколиоз), воронкообразной грудной клеткой. Наблю даются недоразвитие таза, дисплазия головок бедренных костей и вальгусное положение шейки бедренной кости. Ограничение подвижности суставов отмечается уже в детском или подростковом возрасте, постепенно нарастает и в конечном итоге служит причиной инвалидизации больных.
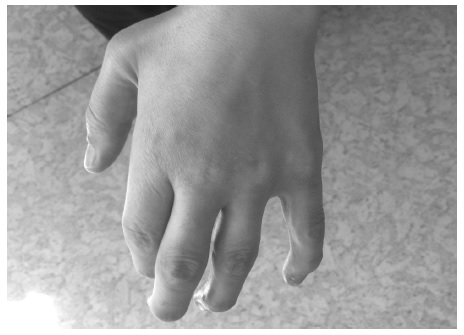
Для МПС IV (синдрома Моркио), в отличие от других типов МПС, типично развитие гипермобильности суставов, обусловленной деформацией метафизов, гипоплазией костей и деградацией соединительной ткани, окружающей суставы [15].
У пациентов с МПС часто наблюдаются обструкция глотки, верхних и нижних дыхательных путей, связанная с увеличением языка и миндалин, сужением трахеи, утолщением надгортанника и голосовых связок, отложением ГАГ в слизистой оболочке бронхов. Обструкция дыхательных путей сопровождается затрудненным дыханием и громким храпом с эпизодами апноэ во время сна. Характерно развитие рецидивирующего среднего отита, вызывающего прогрессирующую тухоугость, которая обусловлена как кондуктивными, так и нейросенсорными механизмами. Причинами нарушения функции дыхания могут быть также небольшие размеры и малоподвижность грудной клетки, растя жение живота в сочетании с кифозом, сколиозом и значительным поясничным лордозом, а также рецидивирующие инфекции нижних дыхательных путей.
Еще одно типичное проявление МПС – поражение клапанов сердца, частота которого достигает 60-90%. С. Wippermann и соавт. обследовали 84 больных в возрасте от 1 до 47 лет с различными типами МПС [16]. Частота недостаточности митрального и/или аортального клапана составила 75,0%, однако тяжелая митральная или аортальная регургитация наблюдалась только в 4,8% и 8,3% случаев, соответственно. Частота пороков клапанов сердца достигала 89-100% у больных МПС I, II и VI, но была ниже у пациентов с МПС III и IV – 3366%. В другом исследовании у 28 больных МПС VI частота поражения митрального клапана составила 96%, трикуспидального – 71% и аортального – 43% [17]. Следует отметить, что, в отличие от некоторых других лизосомных болезней накопления, таких как болезнь Фабри, для МПС не характерно тяжелое поражение миокарда.
У большинства больных МПС I, VI и VII часто отмечается помутнение роговицы, в то время как при других типах МПС оно отсутствует [18].
У пациентов с тяжелыми формами МПС I и II наб лю дается поражение ЦНС (поведенческие расстрои ̆ства, задержка умственного развития, ухудшение интеллекта, тяжелая когнитивная дисфункция) [10]. Выраженные неврологические и когнитивные расстройства характерны также для МПС III. В то же время у большинства пациентов с МПС VI сохраняется нормальный интеллект.
МПС I, II и VI могут привести к развитию синдрома запястного канала, проявляющегося стойкой болью и онемением пальцев кисти в результате сдавления срединного нерва между костями и сухожилиями мышц запястья. Возможно также сдавление спинного мозга вследствие сужения спинно-мозгового канала и нестабильности атлантоаксиального канала. Компрессион ная миелопатия может осложниться слабостью в нижних конечностях и спастической параплегией или квадриплегией.
Диагноз и дифференциальный диагноз
Алгоритм диагностики и дифференциальной диагностики МПС у пациентов с поражением опорно-двигательного аппарата представлен на рис. 4 [19]. Если контрактуры суставов определяются у новорожденного ребенка, то наиболее вероятен диагноз артрогрипоза – заболевания, характеризующегося врожденными контрактурами двух и более суставов несмежных областей в сочетании с мышечной гипо- или атрофией. Различают артрогрипоз с поражением верхних и/или нижних конечностей, генерализованный и дистальный варианты. Артрогрипоз – это не самостоятельная нозологическая форма, а скорее физический симптом, который может быть обусловлен различными причинами, например, ограничением движений плода во время его развития (многоводие, маловодие, пороки развития и опухоли матки, многоплодная беременность), нарушением развития мышц (вирусные инфекции), генетическими факторами и др.
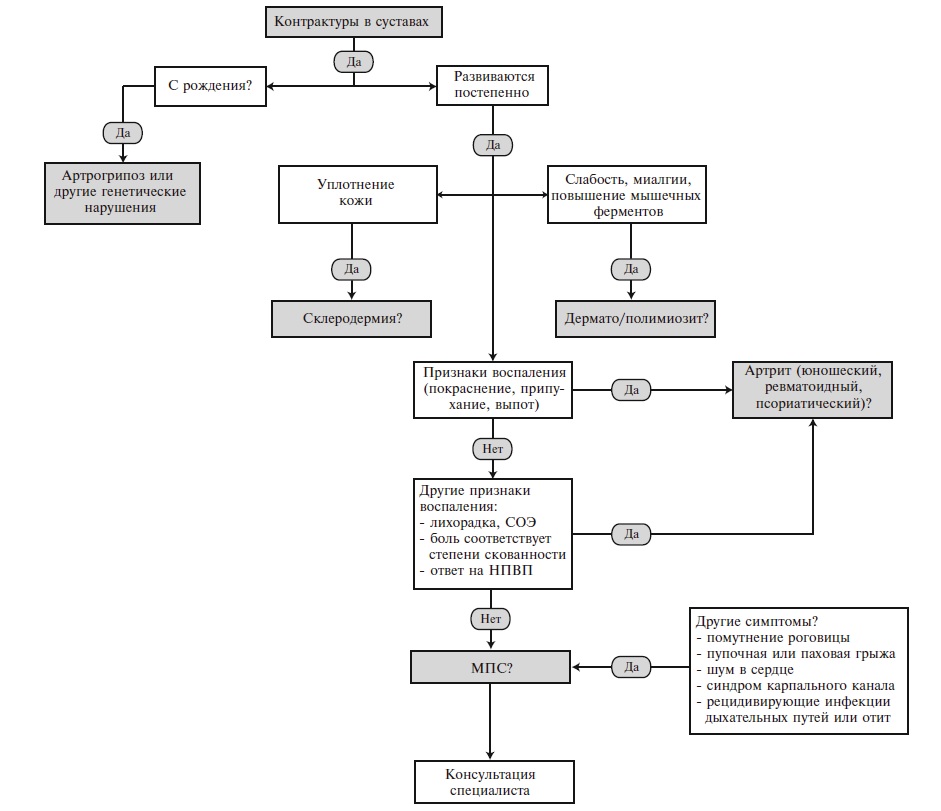
Боли и тугоподвижность суставов, появляющиеся в детском или подростковом возрасте, могут имитировать ревматические заболевания, в частности юношеский идиопатический артрит, ревматоидный или псориатический артрит. Основное значение для дифференциальной диагностики с этими заболеваниями имеют отсутствие воспалительной боли (т.е. боли, возникающей по утрам и сопровождающейся скованностью, которая уменьшается на фоне физической активности), локальных (припухание и болезненность при пальпации суставов) и системных (повышение температуры тела и/или СОЭ и уровня С-реактивного белка) признаков воспаления (рис. 4) [19]. Глюкокортикостероиды неэффективны, хотя нестероидные противовоспалительные препараты могут несколько уменьшить имеющиеся симптомы.
Признаки поражения суставов, появляющиеся в более старшем возрасте, часто расценивают как первичный остеоартроз. Дифференцировать поражение опорно-двигательного аппарата при МПС с этим забо леванием позволяют развитие артропатии в подростковом или молодом возрасте при отсутствии факторов риска первичного остеоартроза и наличие других типичных проявлений генетического заболевания (карликовый рост, измененные черты лица, порок клапана сердца, помутнение роговицы и т.п.) (табл. 3).
| Поражение опорно-двигательного аппарата |
| Контрактуры суставов, развивающиеся в раннем возрасте и не сопровождающиеся признаками воспаления или эрозивными изменениями костей |
| “Когтистая лапа” |
| Деформация позвоночника (сколиоз, кифоз, лордоз) |
| Рентгенологические признаки множественного дизостоза |
| Другие клинические проявления |
| Нарастающая “грубость” черт лица |
| Помутнение роговицы |
| Короткая ригидная шея |
| Частые респираторные инфекции, рецидивирующий средний отит, заложенность носа, шумное дыхание/храп |
| Шум в сердце |
| Пупочные и/или паховые грыжи |
| Низкий рост |
| Нарушение походки |
| Увеличение живота за счет печени и селезенки |
Скрининговым методом диагностики МПС является измерение экскреции ГАГ с мочой. Определение типа ГАГ в моче (дерматансульфат, гепарансульфат, хондороитинсульфат и кератансульфат) с помощью тонкослойной хроматографии или электрофореза имеет определенное значение для дифференциальной диагностики МПС, однако результаты этих исследований все же не позволяют установить окончательный диагноз. Экскреция ГАГ с мочой у детей, подростков и молодых людей с МПС обычно превышает таковую у здоровых людей сопоставимого возраста [13]. Однако у взрослых людей с МПС, особенно с более легкими и медленно прогрессирующими формами заболевания, она может оказаться близкой к норме. Соответственно, следует осторожно интерпретировать результаты этих тестов и продолжать обследование, если диагноз МПС представляется вероятным на основании клинических данных.
Следующий этап диагностики – определение активности лизосомных ферментов в высушенных пятнах крови, лейкоцитах или фибробластах. Анализ высушенных пятен крови обычно проводят в тех случаях, когда образец необходимо отправить в лабораторию, находящуюся в другом городе или стране. Более надежным считают исследование лейкоцитов, выделенных из цельной крови, или культивированных фибробластов.
Для подтверждения диагноза проводят молекулярногенетическое исследование, которое необходимо также для выявления носителей мутантных генов и пренатальной диагностики.
Лечение мукополисахаридозов
Для патогенетической терапии МПС применяют рекомбинантные формы ферментов, дефицит которых лежит в основе развития соответствующего заболевания, в том числе ларонидазу для лечения МПС I, идурсульфазу – МПС II, галсульфазу – МПС VI, элосульфазу альфа – МПС IVa (в Российской Федерации последний препарат не зарегистрирован). Все препараты предназначены для внутривенного введения. Их эффективность и безопасность установлены как в рандомизированных, двойных слепых, плацебо-контролируемых исследованиях, так и длительных наб людательных исследованиях, позволивших изучить отдаленные эффекы ФЗТ [20].
Эффективность и безопасность галсульфазы оценивали в рандомизированном, двойном слепом, плацебоконтролируемом, 24-недельном исследовании 3 фазы у 39 больных МПС VI [21]. Критериями эффективности были толерантность к физической нагрузке и экскреция ГАГ с мочой. Лечение галсульфазой в течение 24 недель по сравнению с плацебо привело к значительному увеличению пройденной за 12 минут дистанции (р=0,025) и скорости подъема по лестнице (р=0,053) и достоверному снижению экскреции ГАГ с мочой (p
Заключение
МПС – это группа редких заболеваний, которые обычно диагностируют поздно вследствие низкой информированности врачей о лизосомных болезнях накопления. Наибольшие диагностические трудности возникают при более легких формах МПС, которые характеризуются медленным развитием соматических проявлений и стертостью типичных внешних признаков. Выделение легких, или ослабленных (attenuated), форм МПС весьма условно, так как в конечном итоге у таких больных развиваются инвалидизирующие осложения, часто требующие оперативного лечения. Одним из типичных симптомов МПС I, II и VI является нарастающая тугоподвижность в суставах, поэтому такие больные могут обращаться за помощью к ревматологам. Особенность поражения опорно-двигательного аппарата при МПС – отсутствие локальных (припухания суставов и болезненности при их пальпации) и системных (повышения температуры тела и/или СОЭ и уровня С-реактивного белка) признаков воспаления. Исключить остеоартроз позволяют молодой возраст пациента и отсутствие типичных факторов риска дегенеративных заболеваний суставов. Важное диагностическое значение имеют системные проявления, такие как пупочная и паховая грыжа, изменение черт лица, помутнение роговицы, низкий рост, увеличение печени и селезенки, рецидивирующие инфекции дыхательных путей и средний отит и др. Если заподозрен диагноз МПС, то необходимо определить экскрецию ГАГ с мочой, а также измерить активность лизосомных ферментов и провести молекулярно-генетическое исследование для подтверждения диагноза.