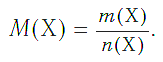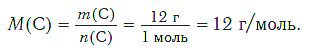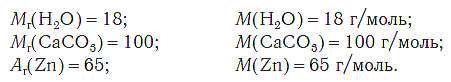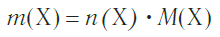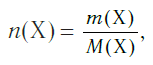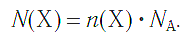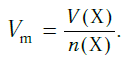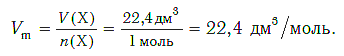что такое молярный объем газа
Урок №40. Закон Авогадро. Молярный объем газов
итальянский учёный-химик, первооткрыватель фундаментального физико-химического закона, названного его именем.
Закон Авогадро : в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро :
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 10 23 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается V m
Молярный объём V m – это постоянная величина для веществ – газов при нормальных условиях (н.у.) V m = 22,4 л/моль
Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
ν = V/V m = N/N a = m/M
M = ρ‧V m
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
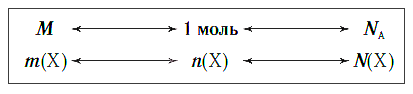
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Молярный объем

Всего получено оценок: 183.
Всего получено оценок: 183.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
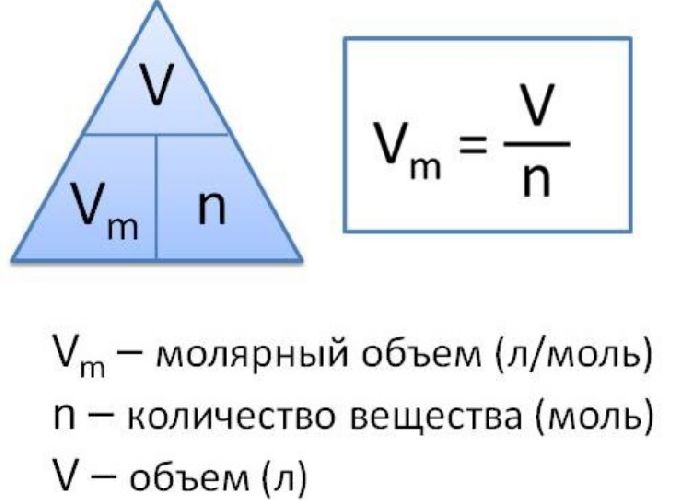
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Химия. 10 класс
*§ 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Интересно знать
Из закона Авогадро вытекают два основных следствия.
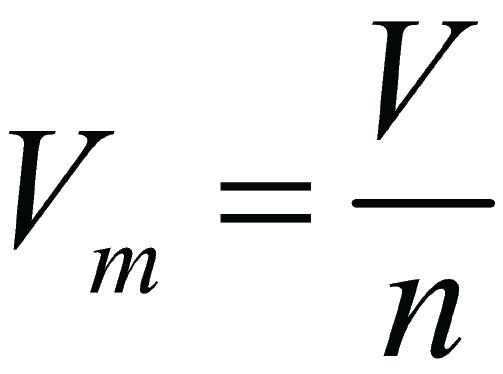
Таким образом, из закона Авогадро следует, что 22,4 дм 3 любого газа при нормальных условиях содержат 6,02 ∙ 10 23 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 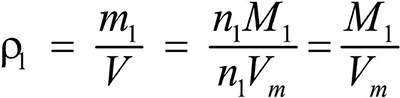
газ 2: 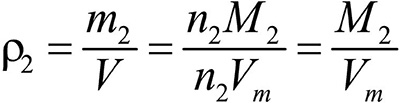
Разделив плотность первого газа на плотность второго, получим: 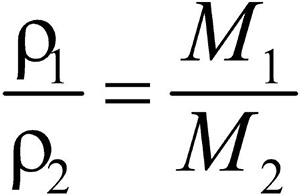
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль ;
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль ), кислорода (32 г/моль ) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм 3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 
2 дм 3 С3Н8 — 10 дм 3 О2
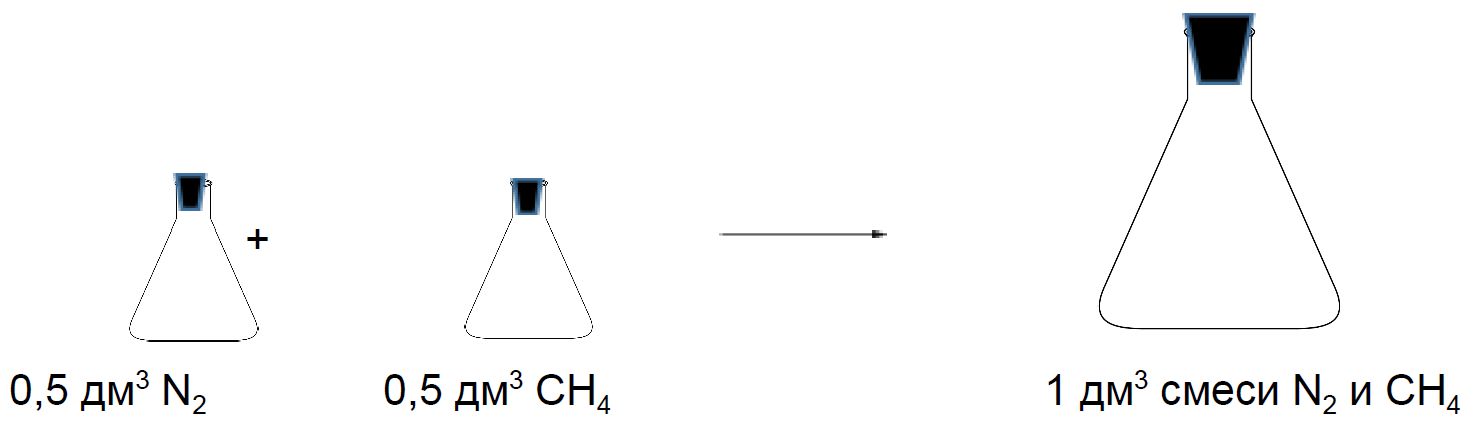
Смеси газов
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = 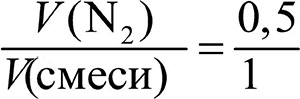
Пример 4. В результате пропускания 150 дм 3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль ):
По уравнению реакции:
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм 3 ;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 
Поскольку после взаимодействия осталось 10 см 3 хлора, то 40 см 3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см 3 хлора и водорода. Поскольку осталось 10 см 3 хлора, то в первоначальной смеси было 20 см 3 водорода и 30 см 3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(Cl2) = 30/50 = 0,6, или 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Молярный объём
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×10 23 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т. д.
Значения молярного объёма химических элементов
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A |
| Период | ||||||||||||||||||
| 1 | H 14,1 | He 31,8 | ||||||||||||||||
| 2 | Li 13,1 | Be 5 | B 4,6 | C 5,3 | N 17,3 | O 14 | F 17,1 | Ne 16,8 | ||||||||||
| 3 | Na 23,7 | Mg 14 | Al 10 | Si 12,1 | P 17 | S 15,5 | Cl 18,7 | Ar 24,2 | ||||||||||
| 4 | K 45,3 | Ca 29,9 | Sc 15 | Ti 10,6 | V 8,35 | Cr 7,23 | Mn 7,39 | Fe 7,1 | Co 6,7 | Ni 6,6 | Cu 7,1 | Zn 9,2 | Ga 11,8 | Ge 13,6 | As 13,1 | Se 16,5 | Br 23,5 | Kr 32,2 |
| 5 | Rb 55,9 | Sr 33,7 | Y 19,8 | Zr 14,1 | Nb 10,8 | Mo 9,4 | Tc 8,5 | Ru 8,3 | Rh 8,3 | Pd 8,9 | Ag 10,3 | Cd 13,1 | In 15,7 | Sn 16,3 | Sb 18,4 | Te 20,5 | I 25,7 | Xe 42,9 |
| 6 | Cs 70 | Ba 39 | * | Hf 13,6 | Ta 10,9 | W 9,53 | Re 8,85 | Os 8,43 | Ir 8,54 | Pt 9,1 | Au 10,2 | Hg 14,8 | Tl 17,2 | Pb 18,3 | Bi 21,3 | Po 22,7 | At н/д | Rn н/д |
| 7 | Fr н/д | Ra 45 | ** | Rf н/д | Db н/д | Sg н/д | Bh н/д | Hs н/д | Mt н/д | Ds н/д | Rg н/д | Cn н/д | Uut н/д | Fl н/д | Uup н/д | Lv н/д | Uus н/д | Uuo н/д |
| Лантаноиды | * | La 22,5 | Ce 21 | Pr 20,8 | Nd 20,6 | Pm 19,96 | Sm 19,9 | Eu 28,9 | Gd 19,9 | Tb 19,2 | Dy 19 | Ho 18,7 | Er 18,4 | Tm 18,1 | Yb 24,8 | Lu 17,8 | ||
| Актиноиды | ** | Ac 22,54 | Th 19,8 | Pa 15 | U 12,5 | Np 21,1 | Pu 12,12 | Am 20,8 | Cm 18,28 | Bk н/д | Cf н/д | Es н/д | Fm н/д | Md н/д | No н/д | Lr н/д |
См. также
Примечания
Полезное
Смотреть что такое «Молярный объём» в других словарях:
молярный объём — molio tūris statusas T sritis fizika atitikmenys: angl. gram molecular volume; molal volume; molar volume vok. Molvolumen, n rus. мольный объём, m; молярный объём, m pranc. volume molaire, m … Fizikos terminų žodynas
молярный объём газа — dujų molio tūris statusas T sritis fizika atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объём газа, m; молярный объём газа, m pranc. volume molaire de gaz, m … Fizikos terminų žodynas
Объём — У этого термина существуют и другие значения, см. Объём (значения). Объём Размерность L3 Единицы измерения СИ … Википедия
Молярный объем — Молярный объём объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул. Согласно закону Авогадро, для любого газа при нормальных условиях эта величина имеет универсальное … Википедия
мольный объём — molio tūris statusas T sritis fizika atitikmenys: angl. gram molecular volume; molal volume; molar volume vok. Molvolumen, n rus. мольный объём, m; молярный объём, m pranc. volume molaire, m … Fizikos terminų žodynas
мольный объём газа — dujų molio tūris statusas T sritis fizika atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объём газа, m; молярный объём газа, m pranc. volume molaire de gaz, m … Fizikos terminų žodynas
Число Авогадро — Число Авогадро, константа Авогадро физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 … Википедия
Уравнение Ван-дер-Ваальса — Уравнение состояния Стат … Википедия