что такое молярная доля газа в смеси
Что такое молярная доля газа в смеси
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
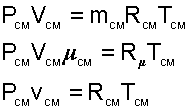 |
необходимо знать газовую постоянную RСМ и молярную массу (условную) смеси µСМ. Для смеси, как для любого идеального газа, эти две величины связаны соотношением RСМ=8314/µСМ (Дж/(кг•К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
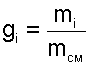 |
где mi – масса отдельного газа, входящего в смесь;
mСМ – общая масса смеси.
Очевидно, что сумма массовых долей всех газов смеси равна единице:
 |
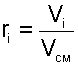 |
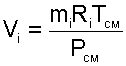 |
 |
можно получить еще одно расчетное выражение для объемной доли, поделив правые и левые части этих уравнений одно на другое:
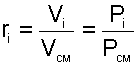 |
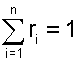 |
 |
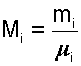 |
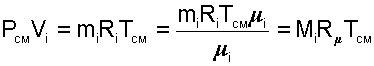 |
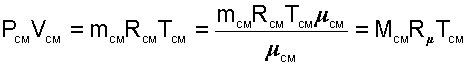 |
получим еще одно расчетное выражение для мольной доли:
 |
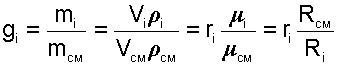 |
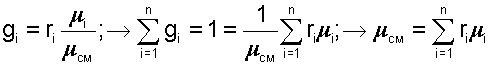 |
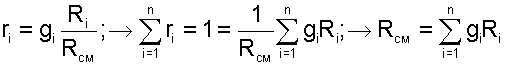 |
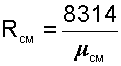 |
Для определения парциального давления данного газа в смеси можно воспользоваться выражением (4.71). В соответствии с ним
Что такое мольная доля вещества? Как найти мольную долю?
Как известно, молекулы и атомы, которые составляют окружающие нас объекты, обладают очень маленькими размерами. Для проведения расчетов во время химических реакций, а также для анализа поведения смеси невзаимодействующих компонент в жидкостях и газах, используют понятие мольных долей. Что это такое, и как их можно применять для получения макроскопических физических величин смеси, рассматривается в данной статье.
Число Авогадро

Число Авогадро в настоящее время широко применяется при изучении различных веществ. Оно связывает макроскопические и микроскопические характеристики.
Количество вещества и молярная масса

В 60-е годы Международная палата мер и весов в систему физических единиц (СИ) ввела седьмую базовую единицу измерения. Ею стал моль. Моль показывает число элементов, которые составляют рассматриваемую систему. Один моль равен числу Авогадро.
Под молярной массой понимают вес одного моля данного вещества. Измеряется она в граммах на моль. Молярная масса является аддитивной величиной, то есть для ее определения для конкретного химического соединения необходимо сложить малярные массы химических элементов, которые составляют это соединение. Например, молярная масса метана (CH4) равна:
MCH4 = MC + 4MH = 12 + 4 * 1 = 16 г/моль.
То есть 1 моль молекул метана будет иметь массу 16 граммов.
Понятие о мольной доле
Получить эту формулу не сложно. Для этого достаточно подставить в нее предыдущее выражение для xi.
Атомные проценты
Перевод долей в атомные проценты осуществляется простым их увеличением на два порядка. Например, 0,21 мольная доля кислорода в воздухе соответствует 21 атомному %.
Идеальный газ
Понятие о мольных долях часто используют при решении задач с газовыми смесями. Большинство газов, находящихся в нормальных условиях (температура 300 К и давление 1 атм.) являются идеальными. Это означает, что атомы и молекулы, составляющие газ, находятся на большом расстоянии друг от друга и не взаимодействуют между собой.
Для идеальных газов справедливо следующее уравнение состояния:
Уравнение состояния показывает, как будет изменяться одна из трех макроскопических характеристик газа (P, V или T), если зафиксировать вторую из них и изменять третью. Например, при постоянной температуре давление будет обратно пропорционально объему газа (закон Бойля-Мариотта).
Самое замечательное в записанной формуле заключается в том, что она не принимает во внимание химическую природу молекул и атомов газа, то есть является справедливой как для чистых газов, так и для их смесей.
Закон Дальтона и парциальное давление
Как рассчитать мольную долю газа в смеси? Для этого достаточно знать общее количество частиц и их число для рассматриваемого компонента. Однако можно поступить иначе.
Мольную долю газа в смеси можно найти, зная его парциальное давление. Под последним понимают давление, которое создал бы данный компонент газовой смеси, если имелась бы возможность убрать все остальные составляющие. Если обозначить парциальное давление i-го компонента как Pi, а давление всей смеси как P, тогда формула мольной доли для этого компонента примет вид:
Поскольку сумма всех xi равна единице, то можно записать следующее выражение:
∑i(Pi / P) = 1, следовательно, ∑i(Pi) = P.
Последнее равенство называется законом Дальтона, который так назван в честь британского ученого начала XIX века Джона Дальтона.
Закон парциального давления или закон Дальтона является прямым следствием из уравнения состояния для идеальных газов. Если атомы или молекулы в газе начинают взаимодействовать друг с другом (это происходит при высоких температурах и большом давлении), тогда закон Дальтона оказывается несправедлив. В последнем случае для расчета мольных долей компонентов необходимо пользоваться формулой через количество вещества, а не через парциальное давление.
Воздух как газовая смесь
Рассмотрев вопрос, как найти мольную долю компонента в смеси, решим следующую задачу: рассчитаем величины xi и Pi для каждого компонента в воздухе.
Если рассматривать сухой воздух, то в его состав входят следующие 4 газовых компонента:
Из этих данных мольные доли для каждого газа вычислить очень просто. Для этого достаточно проценты представить в относительных величинах, как было сказано выше в статье. Тогда получаем:
Парциальное давление этих компонент воздуха вычислим, учитывая, что атмосферное давление на высоте уровня моря равно 101 325 Па или 1 атм. Тогда получаем:
PN2 = xN2 * P = 0,7809 атм.;
PO2 = xO2 * P = 0,2095 атм.;
PAr = xAr * P = 0,0093 атм.;
PCO2 = xCO2 * P = 0,0004 атм.
Эти данные означают, что если убрать весь кислород и остальные газы из атмосферы, а оставить только азот, то давление упадет на 22 %.
МОЛЯРНЫЕ И ОБЪЕМНЫЕ ДОЛИ
ПГС выпускаются в соответствии с «Государственной поверочной схемой для средств измерений содержания компонентов в газовых и газоконденсатных средах», утвержденной приказом Росстандарта от 14.12.2018 № 2664, и на основании ТУ 2114-009-53373468-2015, в которых приведены все требования к изготовлению и аттестации. При производстве фактически происходит передача единицы от первичного эталона ГЭТ-154-2019 к рабочим средствам измерения. Передача производится через весовые (гравиметрические) эталоны. При производстве весовых эталонов расчёт содержания компонентов производится только в единицах молярных долей. Пересчёт молярных долей в объёмные будет вносить дополнительную погрешность, которая зависит, прежде всего, от температуры и давления смеси.
Исторически сложилось так, что приборы газового анализа, используемые на производствах, имеют градуировку шкал в объёмных долях независимо от определяемого компонента, диапазона концентраций, температуры и давления, при которых происходит работа приборов.
Такая ситуация, кроме исторических предпосылок, связана с тем, что молярные и объёмные доли для большинства используемых газов и диапазонов концентраций, практически совпадают. Значимые различия появляются при измерении газовых смесей с высокими концентрациями примесей сложных молекул, свойства которых значительно отличаются от свойств идеального газа.
В заказах, получаемых нашим производством, для всех газовых смесей отличие молярной концентрации компонентов от объёмной значительно меньше погрешности аттестации, приведённой в паспорте. Поэтому величины молярной и объёмной концентраций компонентов, в большинстве случаев численно совпадают.
Сумма всех мольных долей равна 1:
СОДЕРЖАНИЕ
Характеристики
Дифференциальные коэффициенты могут быть сформированы при постоянных отношениях, подобных указанным выше:
Их можно использовать для решения таких PDE, как:
Это равенство можно изменить так, чтобы с одной стороны было дифференциальное отношение мольных количеств или долей.
Мольные количества можно устранить, задав соотношения:
( ∂ п 1 ∂ п 2 ) п 3 знак равно ( ∂ п 1 п 3 ∂ п 2 п 3 ) п 3 знак равно ( ∂ Икс 1 Икс 3 ∂ Икс 2 Икс 3 ) п 3 <\ displaystyle \ left (<\ frac <\ partial n_ <1>> <\ partial n_ <2>>> \ right) _
Таким образом, соотношение химических потенциалов становится:
Аналогичным образом соотношение для многокомпонентной системы становится
Связанные количества
Массовая доля
Массовая доля ш I может быть вычислена по формуле
где М я молярная масса компоненты I и M представляет собой среднюю молярная массу смеси.
Молярное соотношение смешивания
Количественное соотношение равно отношению мольных долей компонентов:
п 2 п 1 знак равно Икс 2 Икс 1 <\ displaystyle <\ frac
Смешивание бинарных смесей с общим компонентом с образованием тройных смесей
Молярный процент
Умножение мольной доли на 100 дает молярный процент, также называемый процентом количество / количество [сокращенно (n / n)%].
Массовая концентрация
Преобразование в массовую концентрацию ρ i и обратно определяется выражением:
Молярная концентрация
Масса и молярная масса
Мольную долю можно рассчитать по массам m i и молярным массам M i компонентов:
Большая Энциклопедия Нефти и Газа
Молярная доля
Молярная доля также выражается в процентах и долях единицы. [16]
Молярная доля также выражается в процентах и долях единицы. [18]
Молярная доля представляет собой отношение количества данного компонента в молях к общему количеству молей всех компонентов в растворе. Молярностью называется количество данного компонента в молях в одном литре раствора. Моляль-ность определяется как количество вещества в молях, приходящееся на 1000 г растворителя. [19]
Молярная доля также выражается в процентах и долях единицы. [20]
Молярные доли образовавшихся газовой и жидкой фаз и их составы в процессе дифференциальной конденсации, сепарации и стабилизации определяют в результате расчетов парожид-костного равновесия. [21]
Молярная доля которого равна х и изменяется независимо. [22]
Молярная доля л-мера Р представляет собой отношение числа молекул данной степени полимеризации п к общему числу всех и полимерных молекул в системе. [23]
Молярные доли N показывают, какая часть от общего количества веществ ( моль), составляющих раствор, приходится на долю растворенного вещества. Раствор может состоять минимум из двух компонентов: растворителя и растворенного вещества. В теории растворов символы, относящиеся к растворителю, отмечают индексом 1 и индексом 2, если они относятся к растворенному веществу. [24]
Молярные доли карбонатов в смеси равны. При прокаливании смеси выделяется газовая смесь, объем которой уменьшается в 2 раза при пропускании как через раствор кислоты, так и через раствор щелочи. [25]
Молярные доли карбонатов в смеси равны. При прокаливании смеси выделяется газовая смесь, объем которой уменьшается в 2 раза ври пропускании как через раствор кислоты, так и через раствор щелочи. [26]
Молярная доля газа в смеси газообразных веществ должна равняться объемной доли этого газа, что можно доказать, используя следствие закона Авогадро. [27]
Молярная доля кислорода равна его объемной доли. [28]
Молярная доля углеводородов в сырье, поступающем в реактор, является важным параметром, но изменение этого параметра в практически применяемых пределах, по-видимому, не оказывает сколько-нибудь существенного влияния на относительные выходы продуктов. [30]