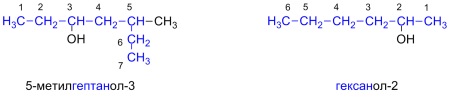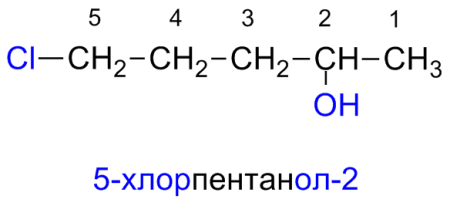что такое молекулярный спирт
Спирты
Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось название — алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким ученым Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m≥1, где R – УВ радикал; m – число функциональных гидроксильных групп – ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:
Классификация спиртов по атомности:
Предельные одноатомные спирты (алканолы)
Общая формула: CnH2n+1OH, n≥1
Гомологический ряд
Изомерия и номенклатура
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН – не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы – ОН.
Спирты изомерны другому классу соединений – простым эфирам (R-O-R):
Электронное строение
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностъю (О, N, F, Сl) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О-Н, С-О, С-Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I.Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О-Н.
а) Взаимодействие с активными металлами с образованием алкоголятов металлов:
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются:
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации):
2. Замещение гидроксильной группы вследствие разрыва связи С-О.
а) Взаимодействие с галогеноводородами с образованием галогеналканов:
Следует отметить, что спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:
R – OH + PCl5 → R – Cl + POCl3 + HCl
б) Взаимодействие с аммиаком с образованием аминов.
Реакции идут при пропускании смеси паров спирта с аммиаком при 300 o С над оксидом алюминия:
При избытке спирта алкильными радикалами могут замещаться 2 или 3 атома водорода в молекуле NН3:
II. Реакции отщепления
1.Дегидратация, т.е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолектлярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—O—R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2.Дегидрирование (разрыв связей О – Н и С – Н)
а) При дегидрировании первичных спиртов образуются альдегиды:
В организме человека этот процесс происходит под действием фермента (алкогольдегидрогеназы).
б) При дегидрировании вторичных спиртов образуются кетоны:
в) Третичные спирты не дегидрируются.
III. Реакции окисления
1.Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:
2.Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
Способы получения алканолов
Кроме прямой гидратации этилена, существует также сернокислотная гидратация, протекающая в две стадии:
— на первой стадии этилен поглощается серной кислотой:
— на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:
При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:
2.Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
Обратите внимание, что при действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена (см. способы получения алкенов).
3. Гидрирование альдегидов и кетонов
Как уже было отмечено выше, дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция — гидрирование альдегидов и кетонов — является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Со) альдегиды восстанавливаются до первичных спиртов, а кетоны — до вторичных спиртов:
4.Специфические методы получения метанола и этанола
Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта – глицерина, или пропантриола-1,2,3:
Физические свойства
Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t о кип.=230 о С. Смешивается с водой во всех отношениях.
Химические свойства
I. Замещение атомов водорода гидроксильных групп
1.Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
2.Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu(OH)2. Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме←О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме ←О за счет неподеленных электронных пар атомов кислорода других ОН-групп:
Нерастворимый в воде Cu(OH)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.
3.Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
II. Замещение гидроксильных групп
Наиболее известными реакциями этого типа является взаимодействие многоатомных спиртов с галогеноводородами. Например, при взаимодействии глицерина с хлороводородом ОН-группы последовательно замещаются атомами хлора:
Способы получения глицерина
1.Гидролиз жиров – основной способ получения глицерина:
2. Синтез из пропилена
В последнее время глицерин получают из пропилена. Существует несколько вариантов этого синтеза. По одному из них пропилен хлорируют при t o = 440—500 о С, полученный аллилхлорид гидролизуют раствором NaOH. На полученный в результате гидролиза аллиловый спирт действуют пероксидом водорода Н2О2, который в присутствии катализатора присоединяется к спирту по двойной связи с образованием глицерина. Весь процесс можно представить схемой:
Применение важнейших спиртов
В медицине С2Н5ОН применяется как дезинфицирующее средство и средство для компрессов, используется для приготовления экстрактов и настоек, как растворитель для многих лекарственных препаратов.
Скачать:
Скачать бесплатно реферат на тему: «Спирты» Спирты.docx (243 Загрузки)
Скачать бесплатно реферат на тему: «Синтез этилового спирта» Синтез-этилового-спирта.docx (209 Загрузок)
Скачать бесплатно реферат на тему: «Синтез метанола из оксида углерода и водорода» Синтез-метанола-из-оксида-углерода-и-водорода.docx (219 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Спирты
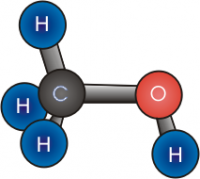
Спирты (от лат. spiritus — дух; устар. алкоголи, от араб. الكحول аль-кухуль — порошок) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся в состоянии sp³-гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
В номенклатуре ИЮПАК для соединений, в которых гидроксильная группа связана с ненасыщенным (sp²-гибридным) атомом углерода, рекомендуются названия «енолы» (гидроксил связан с винильной C=C-связью) и «фенолы» (гидроксил связан с бензольным или другим ароматическим циклом).
Спирты представляют собой обширный и разнообразный класс соединений: они весьма распространены в природе и часто выполняют важные функции в живых организмах. Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств. Кроме того, спирты являются промышленно важными продуктами и находят широчайшее применение как в промышленности, так и в повседневных приложениях.
Содержание
Этимология
Слово спирт появилось в русском языке во времена Петра I через английское слово spirit, которое, в свою очередь, произошло от латинского spīritus — «дыхание, дух, душа».
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры):
— одноатомные спирты (метанол);
— двухатомные спирты (этиленгликоль);
— трёхатомные спирты (глицерин);
— четырёхатомные спирты (пентаэритрит);
— многоатомные спирты (пятиатомный спирт: ксилит).
— предельные (насыщенные) спирты ( бутанол );
— непредельные (ненасыщенные) спирты (аллиловый спирт, пропаргиловый спирт);
— ароматические спирты (бензиловый спирт).
— ациклические (алифатические) спирты (этанол);
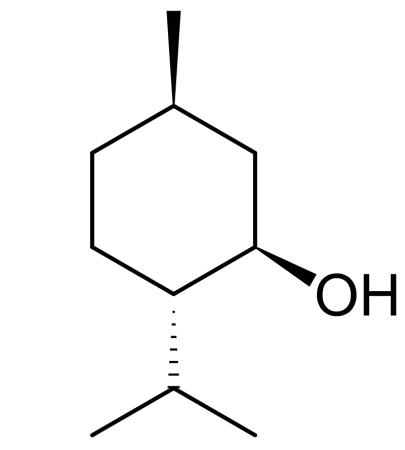
— алициклические спирты (циклогексанол).
— первичные спирты (этанол);
— вторичные спирты (пропанол-2);
— третичные спирты (2-метилпропанол-2).
Номенклатура спиртов
Систематическая номенклатура
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Правила построения названий спиртов:
1. Выбирают родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей гидроксильную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруют в таком направлении, чтобы гидроксильная группа получила наименьший номер в названии. (Если в соединении имеются функциональные группы старше гидроксильной, то это правило применяется к старшей функциональной группе.)
3. Старшая функциональная группа обозначается в виде суффикса (для гидроксильной — -ол), а остальные заместители — в виде приставок в алфавитном порядке. Их положение в углеводородной цепи обозначается при помощи цифр — локантов, помещаемых после суффиксов и перед приставками. Для многоатомных спиртов перед суффиксом -ол указывается число гидроксильных групп (-диол, -триол, -тетраол и т. д.).
4. Если при различных вариантах нумерации цепи гидроксильная группа получает один и тот же локант, то цепь нумеруют в том направлении, при котором другой заместитель получает наименьший локант.
Другие номенклатуры
История открытия спиртов
В Россию спирт впервые попал в 1386 году, когда генуэзское посольство привезло его с собой под названием «аква вита» и презентовало великокняжескому двору.
В 1661 году английский химик Роберт Бойль впервые получил метанол перегонкой древесины. Абсолютированный этанол из его водного раствора был впервые получен в 1796 году русским химиком Т. Е. Ловицем при перегонке над поташом.
В 1842 году немецкий химик Я. Г. Шиль открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Однако, он ошибся, описав её как C2H2. Спустя два года, другой химик Шарль Жерар установил верную гомологическую разницу CH2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта. В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с этилиодидом, установил, что этиловый спирт является производным воды с одним замещённым атомом водорода, экспериментально подтвердив формулу C2H5OH. Впервые синтез этанола действием серной кислоты на этилен осуществил в 1854 году французский химик Марселен Бертло.
Первое исследование метилового спирта было сделано в 1834 году французскими химиками Жаном-Батистом Дюма и Эженом Пелиго. Они назвали его «метиловым или древесным спиртом», так как он был обнаружен в продуктах сухой перегонки древесины. Синтез метанола из метилхлорида осуществил французский химик Марселен Бертло в 1857 году. Им же в 1855 году был открыт изопропиловый спирт, полученный действием серной кислоты на пропилен.
Впервые третичный спирт (2-метилпропанол-2) синтезировал в 1863 году известный русский химик А. М. Бутлеров, положив начало целой серии экспериментов в этом направлении.
Двухатомный спирт этиленгликоль впервые был синтезирован французским химиком А. Вюрцем в 1856 году. Глицерин был обнаружен в природных жирах ещё в 1783 году шведским химиком Карлом Шееле, однако его состав был открыт только в 1836 году, а синтез осуществлен из ацетона в 1873 году Шарлем Фриделем.
Нахождение в природе
Спирты широко распространены в природе как в свободном виде, так и в составе сложных эфиров.
Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике ( Heracleum ).
Этиловый спирт является естественным продуктом анаэробного брожения органических продуктов, содержащих углеводы, под действием дрожжей рода Saccharomyces и бактерий Zimomonas и часто образуется в прокисших ягодах и фруктах. При этом углеводы через последовательность ферментативных реакций, именуемую гликолизом, превращаются в пируват, который далее под действием пируватдекарбоксилазы переходит в ацетальдегид. Последний затем в присутствии алкогольдегидрогеназы акцептирует восстановительный эквивалент от восстановленной формы NAD (восстановление NAD происходит на одной из стадий гликолиза), что даёт этанол в качестве конечного продукта. Данный процесс не только является причиной накопления этанола в природных объектах, но и активно используется в виноделии, пивоварении и хлебопекарной промышленности. В ходе брожения могут образовываться также и другие спирты, например, изопропанол, бутанол-1, бутандиол-2,3.
В эфирных маслах зелёных частей многих растений содержится (Z)-гексен-3-ол-1 («спирт листьев»), придающий им характерный запах. Также в растительном мире очень широко представлены терпеновые спирты, многие из которых являются душистыми веществами, например: борнеол (компонент древесины борнеокамфорного дерева), ментол (в мяте, герани), гераниол и цитронеллол (компоненты цветочных эфирных масел), фенхол (в смоле хвойных деревьев и плодах фенхеля) и др.
В животном и растительном мире распространены конденсированные тетрациклические спирты (производные гонана), обладающие высокой биологической активностью и входящие в класс стероидов, например, холестерин, содержащийся в клетках практически всех живых организмов, особенно животных. Отдельную группу стероидов составляют жёлчные многоатомные спирты, находящиеся в жёлчи животных и человека: буфол, холестантетрол, холестанпентол, миксинол, сцимнол, химерол и др.
В природе встречаются разнообразные спиртовые производные углеводов, например, сорбит (содержится в ягодах вишни и рябины) маннит (в ясене) и др.
В 1959 году немецким химиком Адольфом Бутенандтом при изучении экстракта самки тутового шелкопряда был открыт половой аттрактант, названный бомбиколом. Дальнейшее изучение феромонов насекомых показало, что значительная часть этих феромонов представлена спиртами.
Метаболизм спиртов в организме человека
Физиологическая роль спиртов
Многие спирты являются участниками важных биохимических процессов, происходящих в живом организме. Так, некоторые витамины относятся к классу спиртов, например, витамин А (ретинол), витамин D (эргокальциферол и др.). Стероидные гормоны, среди которых имеются и спирты (эстрадиол, кортизол и др.), участвуют в регуляции обмена веществ и некоторых физиологических функциях организма.
Глицерин является основой более чем половины природных липидов, которые представляют собой его сложные эфиры с жирными кислотами и являются источниками энергии для организма. Также глицерин участвует в глюконеогенезе — процессе образования глюкозы в печени. При этом глицерин под действием ферментов превращается в глицеральдегид-3-фосфат, который далее попадает в метаболический путь глюконеогенеза. Физиологически важным полиолом является мио-инозитол.
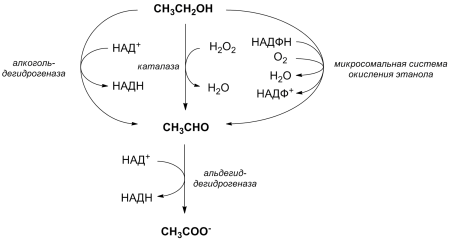
Среди низших спиртов с точки зрения физиологии наибольший интерес представляет, несомненно, этанол. В организме человека этанол является естественным метаболитом и в норме присутствует в крови в очень низких концентрациях. Также этанол может поступать в организм с пищей. Этанол в организме человека метаболизируется преимущественно в печени. Под действием цитозольного фермента алкогольдегидрогеназы этанол окисляется в ацетальдегид, который далее перерабатывается митохондриальной альдегиддегидрогеназой в ацетат. Ацетат после активации короткоцепочечной ацил-коэнзим А-синтетазой может далее разрушаться в цикле Кребса. В утилизации этанола второстепенную роль играет также микросомальная этанол-окисляющая система, представленная цитохромом P450 и каталазой. При высокой концентрации алкоголя в крови ферменты не справляются с оксилением ацетальдегида до ацетата, и в организме происходит накопление ацетальдегида, который в 10—30 раз токсичнее этанола, за счёт чего происходит отравление организма, т. н. похмелье. По энергетической ценности для организма этанол (7 ккал/г) занимает промежуточное положение между углеводами (4,1 ккал/г) и жирами (9,3 ккал/г). Вклад этанола в общую калорийность пищи у не страдающих алкоголизмом взрослых людей может достигать 12 %. Однако потребление этанола в качестве пищевого продукта и источника энергии имеет ряд недостатков с биохимической точки зрения. Кроме образования токсичного ацетальдегида, к таким недостаткам следует причислить тот факт, что избыточные калории, поступившие в организм в форме этанола, могут запасаться только в жирах, так как возможность преобразования этанола в углеводы в организме человека отсутствует. Кроме того, этанол нарушает другие метаболические процессы: ингибирует глюконеогенез (это является причиной гипогликемии при приёме больших доз алкоголя), ускоряет производство цитокинов, изменяет концентрацию гормонов. Алкогольные напитки содержат очень мало витаминов и минеральных веществ, что также может оказать негативное влияние на здоровье. Следует также отметить, что пищевой этанол сам по себе намного дороже, чем энергетически эквивалентное количество сахара.
Токсичность спиртов
Одноатомные предельные спирты вводят организм в наркозоподобное или гипнотическое состояние, а также оказывают токсическое действие.
Этиловый спирт обладает токсическим эффектом. Быстро всасывается через слизистую оболочку желудка и тонкого кишечника, достигая максимальной концентрации в крови через 60—90 минут после его приёма. Этанол вызывает сначала возбуждение, а затем резкое угнетение центральной нервной системы (в том числе разрушает мозговую оболочку); его употребление приводит к нарушению важнейших функций организма, тяжелому поражению органов и систем. Оказывает эмбриотоксическое и тератогенное действие.
Изопропиловый спирт по своему токсическому воздействию напоминает этанол, вызывая угнетение центральной нервной системы и поражая внутренние органы. В высокой концентрации приводит к коме, конвульсиям и летальному исходу (около 3—4 г/кг).
В связи с широким использованием простейших спиртов в различных отраслях промышленности и, в частности, в качестве растворителей, опасным является их ингаляционное воздействие. Острое токсичное воздействие спиртов, испытанное на крысах, проявилось в следующих ингаляционных концентрациях: