что такое молекулярная машина
Молекулярные машины: от создания искусственной модели к терапии рака
Твое будущее в его руках ©
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Для развития загадочного мира ДНК-технологий ученые черпали идеи своих изобретений, по-видимому, из мира научной фантастики, которые превратились из литературного вымысла в новую реальность. Пожалуй, именно поэтому при упоминании термина «наномашины», у большинства людей возникают образы серебристых микроскопических роботов с искусственным интеллектом. В фантастических романах они обычно пытаются подчинить человечество или наносят ущерб всему, с чем сталкиваются. Наши же ДНК-нанороботы вовсе не обладают такими ужасающими способностями. Более того, благодаря стремительному развитию нанотехнологий машины на основе ДНК обладают высоким потенциалом для терапии смертельных заболеваний. Однако можно ли их применять в реальных условиях человеческого организма? А главное, насколько эффективно применение ДНК-нанороботов в нашей жизни? На эти и многие другие вопросы вы найдете ответы в данной статье. Более того, статья расскажет читателям о последних разработках индустрии нанотехнологий и перспективах создания врачей-роботов будущего.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Почему рак, а не лобстер?
Рак как болезнь куда старше человечества: он известен у динозавров, живших в мезозойской эре примерно 240 млн лет назад [1]. Где возникает многоклеточная форма жизни, существует и шанс, что механизм управления клетками выйдет из строя и приведет к неконтролируемому росту и делению клеток. Подобный процесс был обнаружен и выделен в качестве отдельной болезни еще древними людьми [2].
Доподлинно известно, что греческий врач Гиппократ первым обнаружил у пациента опухоль, по форме напоминающую краба, впоследствии римский врач Авл Корнелий Цельс в I в. до н. э. перевел греческое слово καρκίνος на латынь (cancer — рак) [3], [4]. Можете себе представить, что первые методы лечения рака были особенно фантастическими: аптекари того времени запасались зубом кабана, легкими лисиц, настойками свинца, молотым белым кораллом и другими столь же нерезультативными средствами, в то время как хирурги иногда проводили подобие мастэктомии без анестезии в антисанитарных условиях [5], [6].
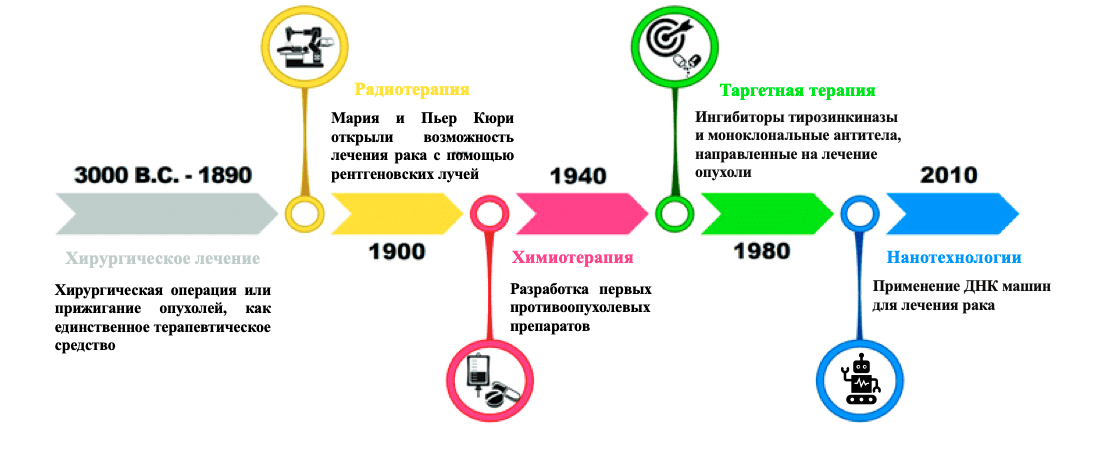
В конце XIX века ученые обратили внимание на возможность убивать злокачественные клетки с помощью лучевой терапии, несмотря на пагубное влияние излучения на здоровые ткани организма. Однако медицина идет вперед (рис. 1), некоторые виды рака уже излечимы в большинстве клинических случаев, благодаря созданию новейших препаратов и переходам к нестандартным методам лечения.
Рисунок 1. Хронология внедрения новых методов лечения злокачественных опухолей. После развития лучевой терапии в начале 1900 года, начался современный этап онкологии с появлением первых химиотерапевтических препаратов примерно в 1940 году. Впоследствии произошел прорыв в области медицинской онкологии с развитием таргетной терапии в 1980 году, что определило улучшение эффективности лечения рака. Последний поворот произошел в 2010 году с появлением ДНК наномашин, ведущих борьбу с биомаркерами раковых клеток.
Например, большинство таргетных препаратов, которые успешно спасают жизни, направлены на белки. В основе целевой, или таргетной (англ. target — цель, мишень), терапии злокачественных опухолей лежит точечное воздействие на характерные молекулы, располагающиеся на поверхности клетки, транслирующие информационные сигналы напрямую в клеточное ядро.
Возникновение опухоли — это процесс накопления мутаций (ошибочных сигналов) под действием различных внешних и внутриклеточных факторов в клеточном геноме. Чем дольше происходит деление поврежденных клеток, тем выше вероятность злокачественного перерождения клетки под действием канцерогенов. Как результат — опухоль дает рецидив в связи с накоплением таких повреждений.
Наравне с таргетными лекарствами развивались прочие многообещающие механизмы борьбы с измененными клетками. Так, методы, основанные на нуклеиновых кислотах, давно привлекают внимание исследователей в качестве регуляторов канцерогенеза на молекулярном уровне.
В начале нашего тысячелетия ученые обратили внимание на особое направление лечения онкозаболеваний — метод генетических модификаций, нацеленный на подавление развития рака путем снижения экспрессии генов, участвующих в развитии онкологических заболеваний. Это становится возможным за счет использования технологий антисмысловых олигонуклеотидов, РНК-интерференции, рибозимов и/или дезоксирибозимов и CRISPR/Cas9. Большинство известных подходов не исключает пагубного влияния не только на раковые, но и на здоровые клетки, а также характеризуется низкой эффективностью, в связи с чем становится невозможным повсеместное уничтожение раковых клеток [7]. Альтернативой традиционным экспериментальным подходам к лечению онкологических заболеваний служат собранные ДНК-наномашины.
Словарик
Составные части ДНК-наномашин
Окей, Google. Что такое ДНК-наномашины?
Наноархитекторы строят структуры ДНК, двигатели и цепи, используя тот же основной принцип, что и природа. Особенность сборки таких устройств заключается в способности нуклеиновых кислот образовывать двойную спираль в строго определенной конформации в соответствии с правилом комплементарности. Таким образом, различные последовательности ДНК могут быть запрограммированы на самосборку, компоновку друг с другом для формирования разнообразных 2D- и 3D-структур.
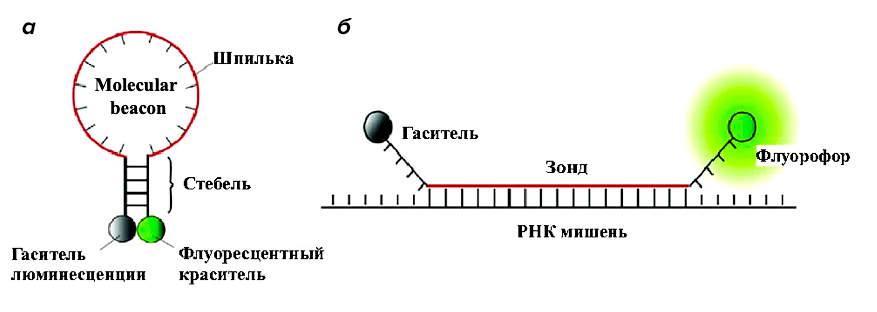
Самый простой пример создания конструкций на основе нуклеиновых кислот — это так называемые «молекулярные маяки» (molecular beacon, MB). Они представляют собой последовательности олигонуклеотидов в виде шпильки (рис. 2а), несущие флуорофор на одном из концов и гаситель флуоресценции на другом. В отсутствие мишени молекулярный маяк находится в стабильной шпильке, за счет чего флуорофор и гаситель пространственно сближены, соответственно, свечение отсутствует. При взаимодействии зонда с целевой мишенью образуется их комплекс, благодаря чему изменяется конформация зонда, и флуорофор отдаляется от гасителя, что приводит к появлению сигнала флуоресценции (рис. 2б).
Рисунок 2. Принцип работы молекулярного маяка
Появление в 1996 году такого молекулярного инструмента, как молекулярный зонд-маяк [8], [9] стало предпосылкой к созданию первых ДНК-машин [7], [10].
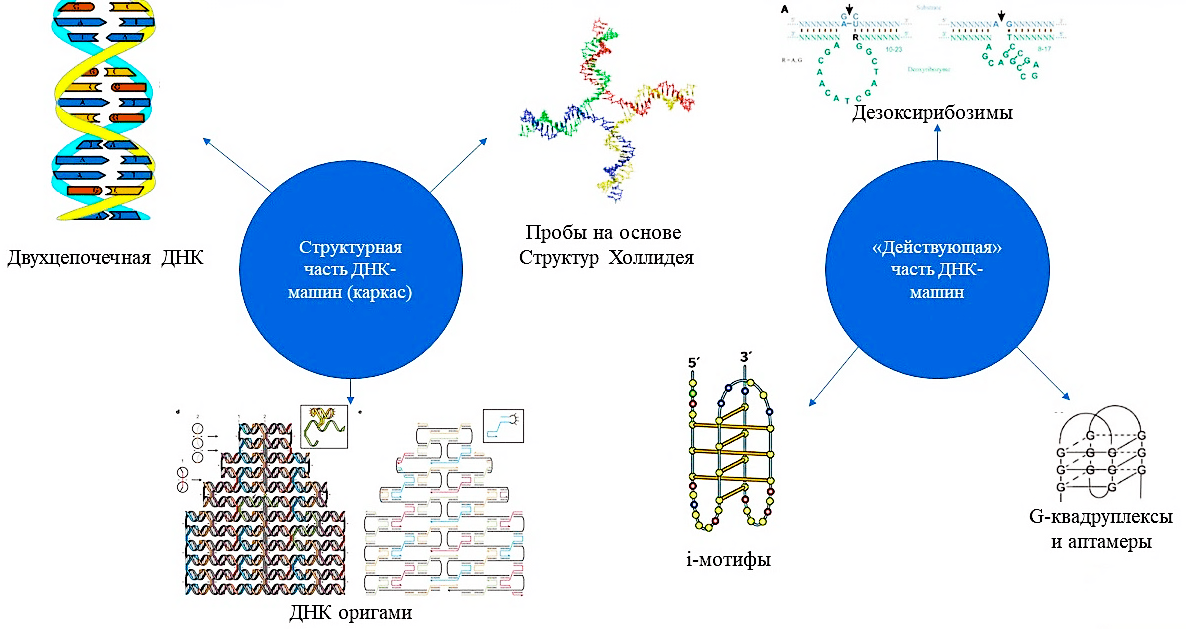
Последние 20 лет развития ДНК-технологий привели к синтезу большого количества различных ДНК-конструкций, структурными элементами которых выступают обычные двухцепочечные ДНК, структуры Холлидея, ДНК-оригами, а в качестве действующих частей могут быть i-мотивы, аптамеры и G-квадруплексы, а также дезоксирибозимы (рис. 3). Структурные части ДНК-машин служат их каркасом, к которому присоединяются функциональные, активные части ДНК-машин, которые открывают большой потенциал для их использования в диагностике (рис. 6), доставке лекарственных молекул (рис. 4) и генной терапии (рис. 8).
Рисунок 3. Схематичное представление различных составных частей ДНК-наномашин
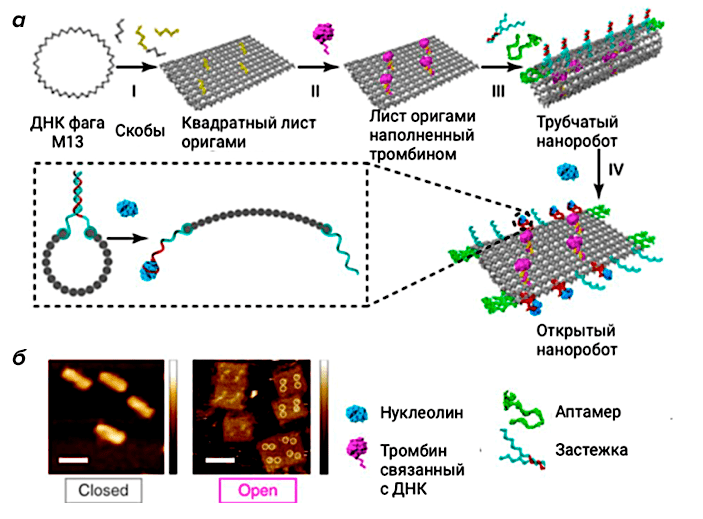
Один из самых известных ДНК-нанороботов создан группой китайских ученых на основе методов ДНК-оригами и ДНК-аптамеров (рис. 4). Их конструкция позволила доставить тромбин — фермент, отвечающий за свертывание крови, — заключенный в трубчатую конструкцию ДНК-оригами, непосредственно в раковые клетки за счет использования ДНК-структур (аптамеров), которые раскручивали ДНК-робота только в присутствии особых белков, специфичных для раковых клеток. Именно этот фермент послужил основным орудием наноробота, который стимулировал свертывание крови внутри кровеносных сосудов и заблокировал кровоток, что в свою очередь привело к смерти тканей опухоли [11].
Рисунок 4. Схематичное изображение ДНК-наноробота для доставки терапевтических молекул (тромбина) в раковые клетки. а — Конструкция и механизм работы ДНК-наноробота. б — Изображения ДНК-конструкции в закрытой и открытой конформациях, полученные при помощи атомно-силовой микроскопии.
В отличие от этой работы, другие исследования концентрируются на непосредственной способности ДНК-конструкций обеспечивать терапевтический эффект, а не только доставлять биологические агенты внутрь раковых клеток.
Терапевтическая функция ДНК-конструкций достигается за счет использования уникальных ДНК-молекул, обладающих каталитической активностью по расщеплению целевых РНК-мишеней, или иначе — дезоксирибозимов.
Дезоксирибозимы — каталитические молекулы ДНК
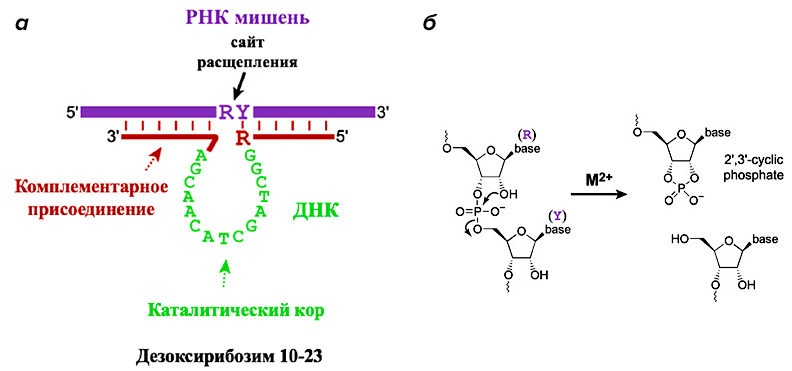
Они способны катализировать расщепление РНК за счет образования сложных структур (рис. 5) [12]. Впервые потенциал дезоксирибозимов (Dz) экспериментально продемонстрировали в 1994 году Р. Брикер и Г. Джойс [13], которые использовали селекцию in vitro (SELEX) для поиска специфичных последовательностей ДНК, способных катализировать расщепление фосфодиэфирной связи в РНК.
Рисунок 5. Работа РНК-расщепляющих дезоксирибозимов. а — Комплекс дезоксирибозима 10–23 (красного и зеленого цветов) и целевой РНК (синего цвета), образованный за счет принципа комплементарности, где R = пурин, Y = пиримидин. б — Химическая реакция расщепления РНК, где М 2+ — ион металла, необходимый для стабилизации переходного состояния.
В отличие от каталитических белков (ферментов) и рибозимов, дезоксирибозимы не обнаружены в живых клетках, и для использования в практических целях их синтезируют искусственно. Вместе с тем они обладают большей химической стабильностью по сравнению с природными рибозимами, и их синтез обходится дешевле.
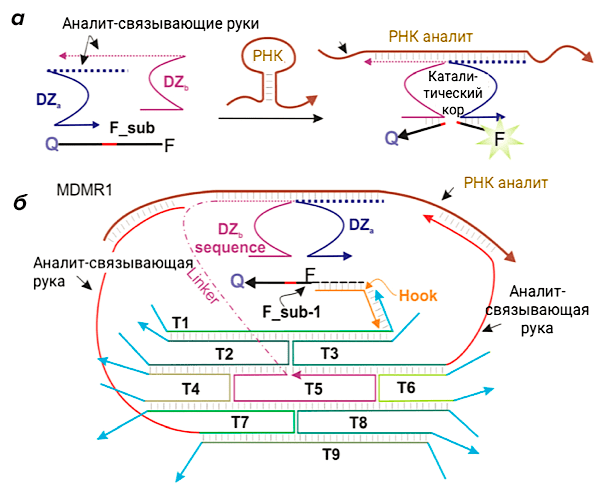
Использование дезоксирибозимов в диагностике заболеваний началось в 2008 году после создания бинарных дезоксирибозимных зондов (рис. 6а). Ранее мы описали способ обнаружения нуклеиновых кислот при помощи молекулярных маяков, но, учитывая низкую селективность в отношении появления несовпадений в последовательности и дорогостоящий синтез для новых целевых нуклеиновых кислот, данная технология требовала серьезной доработки. В результате были разработаны бинарные сплит-Dz-зонды (biDz), которые представляют собой дезоксирибозимы, разделенные на две части (DZa и DZb) [7]. Каждая их часть оборудована «руками», связывающими и расщепляющими флуоресцентный субстрат (F_sub), снабженный флуорофором и гасителем, а также фрагментом, комплементарным анализируемой ДНК или РНК. Расщепление F_sub с помощью бинарного Dz в присутствии целевой ДНК или РНК вызывает заметное увеличение флуоресценции в растворе, как в случае с молекулярным маяковым зондом [14]. Такие бинарные дезоксирибозимные зонды некоторое время применялись в диагностике. Со временем стало ясно, что их можно улучшить, включив в состав ДНК-машин (рис. 6б). Благодаря такому «апгрейду» зонд стал детектировать целевую последовательность, например, рибосомальную 16S рРНК, в концентрации почти 20 раз меньшей, чем детектировал исходный biDz.
Рисунок 6. Конструкция ДНК-наномашины MDMR1 для диагностики. а — Механизм работы бинарного дезоксирибозима. Нити ДНК DZa и DZb комплементарно связываются с фрагментами РНК-аналита и образуют каталитический кор, который позволяет расщепить субстрат, меченный флуорофором (F) и гасителем (Q), вызывая при этом в ответ на разрезание флуоресцентный сигнал. б — Конструкция машины MDMR1.
Инструкция по применению: как использовать дезоксирибозимы в ДНК-машине для терапии рака?
С точки зрения молекулярной биологии, основная причина развития рака — это необратимые нарушения в генетическом материале одной единственной клетки, которые приводят к ее бессмертию и безграничному делению. В конечном итоге накапливается большое количество «сломанных» клеток, и образуется опухоль, а в дальнейшем, если развитие заболевания не будет приостановлено, происходит и метастазирование. Сегодня известно огромное количество отличий в геномах раковых клеток от нормальных геномов. Эти отличия обеспечивают характерный для раковых клеток фенотип.
Основываясь на знаниях о геноме злокачественной опухоли, ученые неоднократно пытались применить дезоксирибозимы для расщепления матричных РНК онкогенов. Расщепление матричной РНК (мРНК) внутри живой клетки приводит к ее деградации и окончательному выключению синтеза целевого белка в соответствии с центральным правилом реализации генетической информации, из которого следует, что передача информации осуществляется от нуклеиновых кислот к белку, но не в обратном направлении.
Сегодня в литературе описано несколько десятков случаев использования расщепляющих РНК дезоксирибозимов для подавления экспрессии онкогенов [15–17]. Более того, было проведено несколько клинических испытаний дезоксирибозимов в терапии рака, как отдельно [18], так и в совокупности с лучевой терапией [19], которые показали низкую токсичность и высокую потенциальную эффективность дезоксирибозимов в терапии рака. Однако сегодня, к сожалению, неизвестно ни одного одобренного подхода терапии опухолей при помощи дезоксирибозимов. Это может быть связано с некоторыми проблемами их применения, например, с труднодоступностью целевых мРНК-мишеней в раковых клетках, ввиду их стабильной вторичной структуры, или с неспособностью этих средств полностью излечить рак. В ряде случаев подавление экспрессии онкогенов ведет лишь к подавлению роста опухоли, а не к гибели раковых клеток.
Для оптимизации лечения опухолей дезоксирибозимами перед нашей научной группой из лаборатории SCAMT (растворной химии передовых материалов и технологий) Университета ИТМО была поставлена цель создать ДНК-наномашину на основе РНК-расщепляющих дезоксирибозимов. Чтобы решить первую проблему, было достаточно добавить к дезоксирибозиму дополнительные РНК-расплетающие руки, такие же, как на рисунке 6б, и ДНК-каркас, который будет удерживать две функциональные группы вместе. Для решения второй проблемы было решено использовать в качестве мишени мРНК генов «домашнего хозяйства».
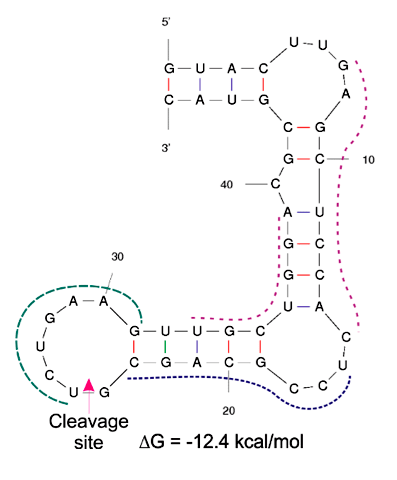
Рисунок 7. Пример вторичной структуры матричной РНК онкогена DAD1
Однако, скажете вы, нацелившись на ген «домашнего хозяйства», мы полностью лишимся избирательности метода, ведь в таком случае дезоксирибозим будет убивать все клетки на своем пути. Здесь на помощь нам пришла технология бинарных дезоксирибозимных зондов (рис. 6а), которая до этого применялась лишь в диагностике заболеваний, но ни разу не была применена в терапии. Таким образом, в качестве экспериментальной мишени мы взяли мРНК гена «домашнего хозяйства» вместо F_sub, а в качестве аналита для образования каталитического ядра избрали мРНК гена DAD1 (defender against cell death 1), отвечающего за апоптоз клетки с высоким уровнем экспрессии преимущественно в раковых клетках (рис. 7).
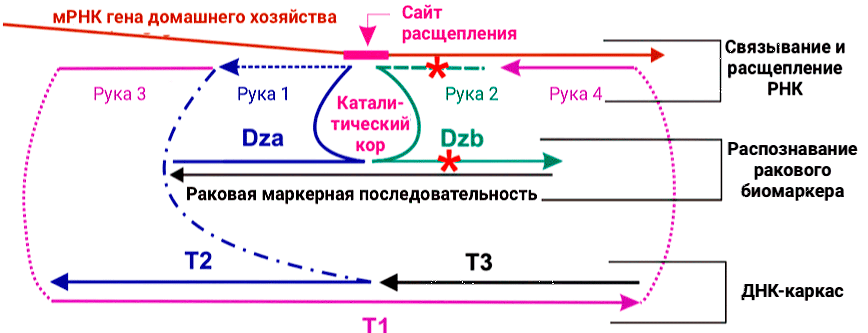
В результате была разработана ДНК-наномашина на основе бинарного дезоксирибозима DZ 10-23, разделенного на две части, благодаря чему ДНК конструкция обладала тремя основными свойствами:
Рисунок 8. Дизайн ДНК-машины для расщепления РНК-мишеней на основе biDz. Часть бинарного дезоксирибозма DZa соединена линкерами (синяя пунктирная линия) с последовательностью T2, которая связывается с последовательностями T1 и T3, которые вместе образуют ДНК-каркас, обеспечивающий стабильность всей структуры. DZb должен связываться с остальной частью ДНК-машины и расщеплять целевую мРНК гена «домашнего хозяйства» только в присутствии онкомаркера. Красные звезды показывают места несовпадений.
Стоит отметить, что разработанный подход принципиально отличается от используемой ранее дезоксирибозимной технологии, в основном за счет использования в качестве мишени мРНК гена «домашнего хозяйства». Кроме того, этот факт обеспечивает нашу ДНК-платформу широкой универсальностью применения. В будущем предложенный подход позволит применять ДНК-наномашину для лечения любого типа рака благодаря подбору новых раковых биомаркеров и адаптации конструкции для активации расщепления целевой мРНК гена «домашнего хозяйства» новой биомаркерной последовательностью.
Несмотря на ряд технических проблем, разработанный нами подход был опубликован в высокорейтинговом научном журнале, а известные масс-медиа (в том числе «РИА Новости» и «Интерфакс») опубликовали статьи о создании «нанокиллеров» раковых клеток [20–22]. Пожалуй, это произошло потому, что повышение качества и продолжительности жизни человека — ключевые факторы развития российской экономики. Для повышения эффективности профилактики, диагностики и лечения социально значимых заболеваний, а также реабилитации пациентов необходимы технологические прорывы в области биомедицины. Они прежде всего связаны с созданием принципиально новых лекарств, продуктов для клеточной и генной терапии, инструментов высокоспецифичной молекулярной диагностики.
Сегодня все наши силы направлены на то, чтобы заставить созданную ДНК-конструкцию эффективно работать в клетках. Для этого мы:
Итак, использование разработанной ДНК-наномашины может открыть новые пути для терапии раковых заболеваний. Однако для его непосредственного применения в терапии на живом организме необходимо провести значительную доработку конструкции.
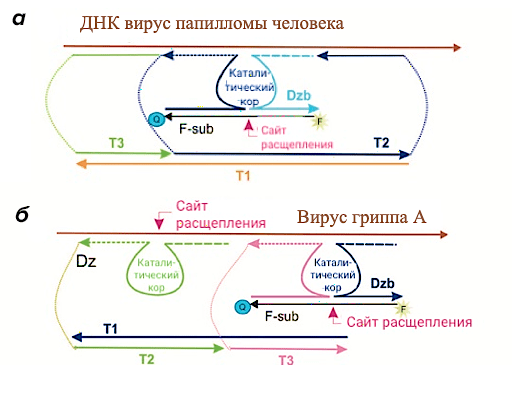
Машины для проведения диагностики и тераностики заболеваний
Наша научная группа занимается не только созданием ДНК-машин для терапии рака, но и созданием ДНК-конструкций, обладающих иными функциями. На рисунке 9а представлена созданная нашей научной группой ДНК-машина для диагностики вируса папилломы человека [23]. Созданная конструкция позволила детектировать ДНК вируса в пикомолярной концентрации, что существенно превышает предел обнаружения ранее разработанных подходов. Кроме того, при объединении в одной ДНК-платформе детектирующей и расщепляющей заданный участок РНК частей, открывается возможность использования ДНК-машин в терапии и диагностике различных заболеваний. Так на рисунке 9б представлена ДНК-наномашина для одновременной детекции и терапии вируса гриппа А. Результаты испытания этой ДНК-конструкции будут в ближайшее время опубликованы.
Рисунок 9. Варианты ДНК-машин для диагностики и тераностики заболеваний
To be continued.
Научные достижения сегодняшнего дня — основа для изменения привычного нам мира завтра. Мы рассмотрели современные тренды в области диагностики и динамики персонализированного лечения и представили, как они изменят мир в будущем.
Помимо того, с появлением новой стратегии в медицине — тераностики, объединяющей диагностику заболеваний и персонализированное лечение пациента с улучшенной эффективностью и безопасностью, — возникают более интенсивные подходы к исследованиям и лечению заболеваний на молекулярном уровне [14], [24–27].
Значительная часть новых ДНК-технологий еще находится на ранней стадии исследований и разработок. При этом стремительные темпы развития в направлении создания ДНК-наномашин, подобных разработанной нами конструкции, позволяют надеяться на скорое внедрение лекарств на основе таких наномашин в практическую медицину.
Молекулярные машины
Нобелевская премия 2016 года в области химии присуждена Жан-Пьеру Саважу, Фрейзеру Стоддарту и Бернарду Феринге «за проектирование и синтез молекулярных машин». Разработанные ими устройства, размеры которых в тысячи раз меньше толщины человеческого волоса, действительно состоят из отдельных деталей, каждой из которых является молекула. Молекулярный мотор, молекулярный лифт и даже способная перемещаться машина-молекула с четырьмя колесами — звучит как фантастика, но все это реальные достижения, удостоенные высочайшей научной награды. Конечно же об этих крошечных механизмах стоит рассказать подробнее.
Интересно, что эру молекулярных машин предсказал тот же человек, который за четверть века до этого в своей ставшей классикой лекции «Там, внизу, полно места!» предрек расцвет нанотехнологий, — лауреат Нобелевской премии по физике 1965 года Ричард Филлипс Фейнман. В публичной лекции 1984 года Фейнман сказал, что рано или поздно появятся миниатюрные машины с подвижными элементами размерами в одну или несколько молекул, подобные жгутикам бактерий, но созданные в лаборатории гигантскими руками человека. Фейнман считал, что способные к совершению механической работы синтетические молекулярные системы появятся в 2010—2020 годах.
Цепи и узлы
Фейнман мог и не знать, что первые шаги к созданию молекулярных машин были сделаны еще за год до его предсказания. В 1983 году Жан-Пьер Саваж, работавший тогда в Университете Луи Пастера над диссертацией под руководством ЖанМари Лена, разработал практически выполнимый метод синтеза первого класса молекул без химических связей — катенанов. ЖанМари Лен, наставник Саважа и один из отцов-основателей супрамолекулярной химии, получит Нобелевскую премию по химии в 1987 году «за разработку и применение молекул со структурноспецифическими взаимодействиями с высокой селективностью».
Катенаны — это системы из двух и более макроциклических соединений, сцепленных как звенья цепи, однако не образующих при этом химической связи друг с другом (само название «катенан» происходит от латинского слова catena — цепь). Конечно, Саваж не первым получил катенаны — цепочку, состоящую из двух переплетенных макроциклов, впервые синтезировали еще в 1964 году. Однако до работ Саважа получение молекулярных цепей было скорее любопытным курьезом органического синтеза — замыкание макроциклов и образование катенанов происходило случайным образом, и их выходы не превышали 2—3%. Саваж впервые предложил методологию направленного синтеза катенанов, даже в первых экспериментах увеличив их выход до 42%.
Как это часто бывает в химии (и в других науках тоже), метод направленного синтеза появился благодаря счастливой случайности. Работа Саважа была связана с фотохимией и разработкой молекулярных комплексов, способных поглощать энергию солнечного света и использовать ее для инициирования химических реакций. Построив модель одного из таких комплексов, отличающихся фотохимической активностью, Саваж неожиданно понял, что этот комплекс похож на катенан — две молекулы, закрученные вокруг находящегося в центре иона меди.
Это существенно изменило направление его исследований. Используя фотохимически активный комплекс с медью в качестве модели, Саваж и его коллеги синтезировали циклическую молекулу и молекулу в форме серпа, после чего обе молекулы присоединили к иону меди за счет координационной связи (рис. 1). Ион меди был не только «якорем», он выступал и в роли шаблона, предопределяющего форму. На следующем этапе синтеза серповидная молекула взаимодействовала с третьим строительным блоком, образуя второй макроцикл, который замыкался вокруг первого, и получались два первых звена молекулярной цепи, механически связанных друг с другом. На заключительном этапе удаляли выполнивший свою работу ион меди.
Данный метод сделал возможным направленные исследования в области топологической химии — ионы металлов использовали в качестве строительных лесов для синтеза структур все более и более сложных, от длинных молекулярных цепей до молекулярных узлов причудливой формы.
Вскоре Саваж и другой лауреат Нобелевской премии по химии 2016 года Фрейзер Стоддарт (в настоящее время профессор Северо-Западного университета США) стали признанными экспертами в области топологической химии. Они получили молекулярные версии многих известных в макромире узлов: трилистный узел (символ, встречающийся в кельтских орнаментах, скандинавских ритуальных изображениях, в христианстве он символизирует Святую Троицу — рис. 2а), кольца Борромео (изображение с герба итальянской семьи Борромео, которое можно встретить и на скандинавских ювелирных изделиях, и на христианских фресках, — рис. 2б), узел Соломона (рис. 2в). К лондонской Олимпиаде 2012 года Стоддарт синтезировал пятизвенный катенан, который в честь пяти олимпийских колец назвал олимпиаданом (рис. 2г).
Рис. 2. Системы механически связанных макроциклических молекул (пояснения в тексте)
Конечно, все это вязание молекулярных узлов было привлекательным с точки зрения химической эстетики. Однако вовсе не усложнение структур катенанов принесло их создателям Нобелевскую премию.
Вал на оси
Второй лауреат, Фрейзер Стоддарт, вписал себя в историю химии XXI века не только и не столько умением завязывать молекулярные узлы: как и его коллега Саваж, он оптимизировал методы синтеза и первым смог получать препаративные выходы другого типа молекул без химической связи — ротаксанов.
Ротаксаны — класс соединений, состоящих из молекулы гантелевидной формы и надетого на эту «гантель» макроцикла. Стоддарт тоже не был первооткрывателем ротаксанов — впервые их получили Иан Гаррисон и Шуэн Гаррисон еще в 1967 году. Но как и в случае их близких родственников катенанов, до работ Стоддарта ротаксаны синтезировали, уповая на удачу, которая не позволяла получать эти молекулы с выходом более пары процентов.
В 1991 году исследователи из группы Стоддарта впервые осуществили направленный синтез ротаксана (рис. 3). Строительными блоками для синтеза стали молекула с положительно заряженными фрагментами, которой предстояло замкнуться в цикл, и ось ротаксана — длинный стержень, уже имеющий на концах фрагменты, которые должны препятствовать «соскальзыванию» макроцикла. Ось ротаксана, в свою очередь, была модифицирована фрагментами, несущими отрицательный заряд, — это позволяло оси ротаксана и заготовке для макроцикла, встретившись в реакционной смеси, образовать ионный мостик между разноименно заряженными фрагментами, что облегчало вдевание оси ротаксана в заготовку макроцикла. На следующем этапе синтеза исследователи замыкали макроцикл и получали ротаксан, опять же с выходом в десятки процентов.
Рис. 3. Синтез ротаксана
В первом ротаксане Стоддарта макроцикл мог свободно перемещаться вдоль оси. Однако, разработав принцип синтеза, он смог получить системы, в которых движение макроцикла удавалось регулировать за счет внешних воздействий (изменение кислотности среды, в которой растворен ротаксан, присутствие в ней определенных типов химических веществ или просто изменения температуры). Первая молекулярная машина на основе ротаксана, в которой макроцикл занимал строго определенные положения, реагируя на изменения окружающей среды, появилась в 1994 году. С этого момента в стенах лаборатории было синтезировано немало молекулярных машин, среди которых молекулярный лифт, способный подниматься на высоту 0,7 нм (рис. 4, «Science» 2004, 303, 5665, 1845—1849), и искусственные мышцы из ротаксанов, сил которых хватало на сгибание тонкой фольги из золота. Сила, которую создает макроцикл одного ротаксана при перемещении, — около 30 пиконьютонов, в то время как сила сокращения одной молекулы мышечного белка миозина колеблется от 5 до 60 пиконьютонов, так что синтетические молекулярные машины вполне конкурентоспособны по сравнению со своими аналогами, созданными эволюцией живых существ.
Рис. 4. Ротаксановый лифт°
В сотрудничестве с другими исследователями Стоддарт разработал состоящую из ротаксанов схему памяти емкостью 20 килобайт. Конечно, объемы молекулярных чипов для памяти еще не могут конкурировать с объемами существующих компьютерных чипов, к тому же их устойчивость (а следовательно, и сохранность записанной на них информации) оставляет желать много лучшего, но апологеты молекулярной электроники напоминают, что были в истории науки и техники времена, когда полупроводниковые схемы не могли составлять конкуренцию теплой ламповой технике.
Мотор
Молекулярные машины, созданные Стоддартом и Саважем (в соавторстве и по отдельности), хорошо справлялись с одним типом движения составляющих их элементов — поступательным. Чтобы добавить разнообразия в мир молекулярных машин, исследователям хотелось получить молекулярные моторы, элементы которых могли бы непрерывно вращаться в одном направлении. В 1990-е годы многие ученые, воодушевленные успехами Саважа и Стоддарта, пытались создать молекулярную машину с вращающимися деталями из отдельных молекул, но большинство потерпело неудачу — молекулы не вращались вообще либо меняли направление вращения случайным образом. Первым, кому удалось решить эту задачу, был голландский химик Бернард Феринга — третий лауреат Нобелевской премии по химии 2016 года.
Молекулярную машину, созданную Ферингой, можно сравнить с двумя уменьшенными копиями лопаток ротора. Эта молекула состоит из двух плоских молекулярных фрагментов, соединенных двойной связью (рис. 5). С каждой из молекулярных лопаток была связана метильная группа, выполняющая ту же задачу, что элементы храпового механизма, — они заставляли детали макромеханизмов вращаться лишь в одном направлении. При облучении системы импульсом ультрафиолета один из роторов проворачивался на 180° вокруг центральной оси — двойной связи, а метильный «храповик» не давал молекуле провернуться обратно. Следующий импульс ультрафиолета обеспечивает следующий поворот на 180°, и так далее.
Рис. 5. Машина Бернарда Феринги: молекулярный ротор вращается под действием УФ-излучения
Самый первый молекулярный мотор не отличался высокой скоростью, но после череды постоянных оптимизаций и модернизаций Феринге с коллегами удалось добиться от него скорости вращения 12 миллионов оборотов в секунду. В 2011 году его же исследовательская группа соорудила четырехколесный молекулярный автомобиль, в котором на молекулярной раме располагалось четыре молекулы, игравшие роль колес. Когда они начинали вращаться, молекулярный автомобиль поступательно двигался по поверхности (см. рис. на заставке).
В другом изящном эксперименте исследователи из группы Феринги показали, как с помощью молекулярных моторов раскрутить стеклянный цилиндр длиной в 28 микрометров (в 10 000 раз больше молекулярных моторов). Химики внедрили молекулярные моторы в жидкие кристаллы, причем модифицировали только 1% от всех макромолекул в их составе. Тем не менее активация работы молекулярных моторов заставляла двигаться все жидкие кристаллы. Стеклянный цилиндр, помещенный на их поверхность, вращался в том же направлении, что молекулярные моторы.
Работы Жан-Пьера Саважа, Фрейзера Стоддарта и Бернарда Феринги не только вдохновили химиков всего мира на создание новых молекулярных машин и механизмов, но и снабдили их необходимым для этого инструментом. Одна из самых интересных молекулярных машин (ее разработали уже не нобелевские лауреаты этого года) — робот на основе ротаксанов, способный захватывать и связывать друг с другом аминокислоты, имитируя синтез белка на рибосоме.
В чем заслуга?
Важное достижение Саважа, Стоддарта и Феринги состоит в том, что всем троим удалось получить молекулярные системы, выведенные из состояния равновесия. Химические системы, с которыми приходится иметь дело в лаборатории, стремятся к положению устойчивого химического равновесия, другими словами — к наиболее выгодному с точки зрения потенциальной энергии состоянию. Химические же системы, лежащие в основе процессов, которые протекают в живой ткани, работают именно в неравновесном режиме. Пока организм жив, он извлекает энергию из пищи, и эта энергия заставляет биологические молекулярные машины выходить из устойчивого равновесия, увеличивая свою потенциальную энергию. Для возвращения в равновесное состояние им приходится совершать механическую работу — и так до тех пор, пока происходит обмен веществ, то есть организм сохраняет жизнеспособность.
Как и молекулярные машины живых организмов, системы, созданные Саважем, Стоддартом и Ферингой, могут выполнять множество задач, и это открывает химикам дверь, ведущую в новую страну интересных идей. Как было сказано в официальном объявлении Нобелевского комитета от 5 октября 2016 года, ситуация с готовностью молекулярных машин к практическому применению в настоящее время напоминает ситуацию с созданием первых прототипов электродвигателей в век угля и пара — 20—30-е годы XIX века. Естествоиспытатели тех времен рассматривали их как бесполезные, хотя и весьма интересные установки, крутящие колеса и поднимающие грузы в лабораториях; никто и не подозревал, что настанет время, когда, говоря словами более поздней песни, «нам электричество пахать и сеять будет». Как считают многие химики, физики и биологи, нынешняя Нобелевская премия по химии — это триумф фундаментальной, академической науки, и ожидание компьютера на молекулярных чипах или механизма, приводимого в движение молекулярными машинами, может надолго затянуться.
Более оптимистично настроенные эксперты говорят, что вручение премии Саважу, Стоддарту и Феринге вполне может ускорить этот процесс. Они приводят в пример ситуацию с Нобелевской премией по физике 2010 года, которая была присуждена за получение двумерной аллотропной модификации углерода — графена, в то время интересного, но непонятно для чего нужного материала. Однако премия Гейма и Новоселова резко увеличила интерес к графену и его аналогам, вовлекла множество людей в работу, что и привело в итоге к созданию в 2013 году европейской десятилетней программы по изучению графена и связанных с ним технологий с ежемесячным бюджетом в 54 миллиона евро. Есть надежда, что Нобелевская премия 2016 года привлечет к делу создания молекулярных машин и новых исследователей, и новые инвестиции. Так это или не так, покажет время.
Вместе с тем не следует забывать, что помимо пользы и эффектов, связанных с практической значимостью молекулярных машин, есть еще и то, что называется «научная значимость», а она заметна уже сегодня. Некоторые закономерности, выявленные при изучении движения и выполнения работы синтетическими молекулярными машинами, позволяют глубже понять принципы молекулярных машин, созданных эволюцией. Появляется возможность посмотреть под новым углом на молекулярную биологию, на неравновесные процессы с участием большого числа атомов и молекул. В любом случае каждая Нобелевская премия по химии — научное событие года, а нынешняя привлекательна еще и тем, что она отметила успехи наиболее важных разделов химии XXI века — химии синтетической и химии супрамолекулярной.
Курамшин А.И.
Белок, который ходит
Нобелевская премия, говорите? За молекулярное устройство, которое перемещается по плоской поверхности? Одноклеточные организмы тихо посмеиваются, крутя жгутиками, покачивая ресничками и ложноножками. Да и каждый из нас, многоклеточных, — такая сложная машина, сделанная из машин, сделанных из еще меньших, но все еще сложных машинок, какая Декарту не могла присниться. Молекулярные моторы (это не метафора, а официальный термин) отвечают за транспорт ионов через мембрану, транспорт пузырьков-везикул, органелл и хромосом внутри клетки, шевеления тех же ресничек и мышечные сокращения. Одни осуществляют движение по кругу (утверждение, что «природа не изобрела колеса», неверно: вращающихся наноколесиков у природы хватает), другие — линейное, туда и обратно. А третьи практикуют бипедальное движение. Кроме шуток, наши клетки густо населены двуногими шагающими наноботами. Всем известна роль актинмиозинового комплекса в мышечном сокращении. Мышечные клетки заполнены миофибриллами, а те состоят из белковых нитей — филаментов, актиновых и миозиновых; еще иногда вспоминают эластичный белок титин, фиксирующий концы миозиновых филаментов. В клетках скелетной мускулатуры филаменты аккуратно уложены в саркомеры — группы сократительных единиц, имеющих одинаковую длину (почему под микроскопом и видна характерная для скелетных мышц поперечная полосатость).
Миозин похож на две клюшки для гольфа, ручки которых скручены в одну спираль, а головки цепляют актиновые филаменты и сдвигают их относительно миозиновых, тем самым сокращая мышцу. Каждая головка развивает усилия в считаные пиконьютоны, но в миозиновом филаменте сотни молекул миозина, в мышечном волокне много миофибрилл, а в мышце много волокон, так что суммарное усилие может быть значительным. Цикл повторяется, пока в цитоплазме есть ионы кальция и АТФ.
На электронной микрофотографии миофибриллы хорошо видны саркомеры, состоящие из актиновых и миозиновых филаментов. Реакцию, которая обеспечивает сокращение мышцы, можно разделить на четыре этапа. 1. Головка миозина связывает молекулу АТФ, при этом разрывается связь между актином и миозином. Теперь миозин может взаимодействовать с новой актиновой субъединицей — сделать «шаг» вдоль нити. (Это взаимодействие пройдет до конца лишь в том случае, если нервный импульс повысит концентрацию ионов кальция в мышечном волокне.) 2. Миозин гидролизует АТФ до АДФ и фосфата и прочно связывается с актином. 3. Фосфат высвобождается, головка миозина сгибается, актиновые филаменты перемещаются относительно миозиновых. 4. Миозин высвобождает АДФ, но сам останется прочно привязанным к актину до появления новой молекулы АТФ.
Но миозины присутствуют не только в мышечных волокнах: в семействе миозинов 18 классов. Мышечные миозины (класс II) перебирают лапками по актину, как гусеница по травинке. Миозин V и похож на римскую пятерку или букву «лямбда»: короткий хвостик и две головки, или, скорее, две ноги, широко шагающие по актиновой нити (длина шага целых 36 нм) — а эти нити пронизывают каждую клетку, образуя цитоскелет. К хвостику могут прицепляться везикулы, РНК, митохондрии, и миозин их тащит куда надо.
Сотрудники физического факультета токийского Университета Васэда в 2007 году приклеили к одной из «ног» миозина тубулиновую микротрубочку с флуоресцентной меткой, чтобы понаблюдать за прогулкой в реальном времени. С тех пор было сделано не одно подобное исследование, и ролики с анимированной реконструкцией гуляющих белков — не только миозина V, но и других, например кинезина, идущего по тубулину, — собирают сотни тысяч просмотров. Конечно, все понимают, что белок не наделен разумом и характером, что это просто биомашинка, но, глядя, как он шлепает вперед с апломбом и грацией диснеевского гнома, да еще тащит за собой огромный мешок везикулы, — невозможно не улыбнуться.
Прогулка миозина V по актиновой нити
Гуляющие белки в рисованных видеороликах так загребают ногами не смеха ради. Наиболее правдоподобные модели — именно те, где походка у них как у сильно пьяного или стукнутого по голове героя мультика. Когда та нога, что сзади, отрывается от актина, передняя наклоняется вперед под острым углом (на это расходуется энергия АТФ). А свободную ногу забрасывает вперед броуновское движение. Действием инерции и силы тяжести для белков в растворе можно пренебречь, а вот тепловое движение молекул учитывать необходимо. Оно и определяет изящество походки.
Автор этой заметки не стремится умалить заслуги лауреатов 2016 года. Если у кого-то (тем более у самой эволюции!) результаты лучше наших, это не повод для огорчения, а новая цель. Кто знает, может быть, моторчик и машинка Бена Феринги — лишь первый шаг, а в конце пути — роботы, состоящие из маленьких механизмов, такие же сложные, как мы сами.
Видеоролики с гуляющими белками