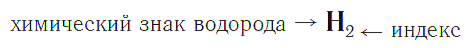что такое молекулярная формула в химии
Урок 5. Химическая формула
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
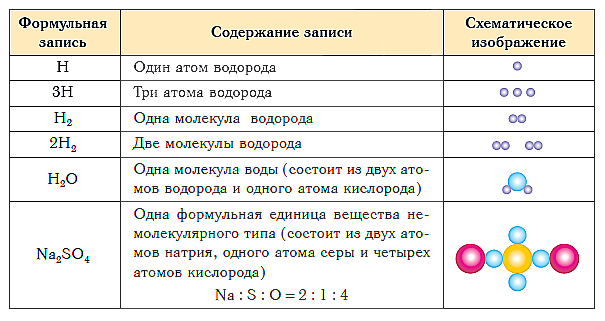
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Молекулярная формула
Что такое молекулярная формула
Современные символы химических элементов были введены в науку в 1813 году Я. Берцелиусом. По его предложению элементы обозначаются начальными буквами их латинских названий. Например, кислород (Oxygenium) обозначается буквой О, сера (Sulfur) – буквой S, водород (Hydrogenium) – буквой Н. В тех случаях, когда названия элементов начинаются с одной и той же буквы, к первой букве добавляется еще одна из последующих. Так, углерод (Carboneum) имеет символ С, кальций (Calcium) – Ca, медь (Cuprum) – Cu.
Химические символы – не только сокращенные названия элементов: они выражают и определенные их количества (или массы), т.е. каждый символ обозначает или один атом элемента, или один моль его атомов, или массу элемента, равную (или пропорциональную) молярной массе этого элемента. Например, С означает или один атом углерода, или один моль атомов углерода, или 12 единиц массы (обычно 12 г) углерода.
Молекулярная формула веществ
Формулы веществ также указывают не только состав вещества, но и его количество и массу. Каждая формула изображает или одну молекулу вещества, или один моль вещества, или массу вещества, равную (или пропорциональную) его молярной массе. Например, H2O обозначает или одну молекулу воды, или один моль воды, или 18 единиц массы (обычно (18 г) воды.
Простые вещества также обозначаются формулами, показывающими, из скольких атомов состоит молекула простого вещества: например, формула водорода H2. Если атомный состав молекулы простого вещества точно не известен или вещество состоит из молекул, содержащих различное число атомов, а также, если оно имеет не молекулярное, а атомное или металлическое строение, простое вещество обозначают символом элемента. Например, простое вещество фосфор обозначают формулой P, поскольку в зависимости от условий фосфор может состоять из молекул с различным числом атомов или иметь полимерное строение.
Формулу вещества устанавливают на основании результатов анализа. Например, согласно данным анализа глюкоза содержит 40% (масс.) углерода, 6,72% (масс.) водорода и 53,28% (масс.) кислорода. Следовательно, массы углерода, водорода и кислорода относятся друг к другу как 40:6,72:53,28. Обозначим искомую формулу глюкозы CxHyOz, где x, y и z – числа атомов углерода, водорода и кислорода в молекуле. Массы атомов этих элементов соответственно равны 12,01; 1,01 и 16,00 а.е.м. Поэтому в составе молекулы глюкозы находится 12,01х а.е.м. углерода, 1,01у а.е.м. водорода и 16,00zа.е.м. кислорода. Отношение этих масс равно 12,01х: 1,01у: 16,00z. Но это отношение мы уже нашли, исходя из данных анализа глюкозы. Следовательно:
12,01х: 1,01у: 16,00z = 40:6,72:53,28.
Согласно свойствам пропорции:
x: у: z = 40/12,01:6,72/1,01:53,28/16,00
или х: у: z = 3,33 : 6,65 : 3,33 = 1 : 2 : 1.
Следовательно, в молекуле глюкозы на один атом углерода приходится два атома водорода и один атом кислорода. Этому условию удовлетворяют формулы CH2O, C2H4O2, C3H6O3 и т.д. Первая из этих формул — CH2O — называется простейшей или эмпирической формулой; ей отвечает молекулярная масса 30,02. Для того, чтобы узнать истинную или молекулярную формулу, необходимо знать молекулярную массу данного вещества. Глюкоза при нагревании разрушается, не переходя в газ. Но ее молекулярную массу можно определить и другими методами: она равна 180. Из сопоставления этой молекулярной массы с молекулярной массой, отвечающей простейшей формуле, ясно, что глюкозе отвечает формула C6H12O6.
Таким образом, химическая формула – это изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков, а молекулярную формулу вещества можно получить, зная простейшую формулу вещества и его молекулярную массу.
Примеры решения задач
| Задание | При сжигании 8,4 г углеводорода получили 26,4 г углекислого газа и 10,8 г воды. Относительная плотность паров углеводорода по воздуху равна 42. Найдите молекулярную формулу углеводорода. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по водороду: |
По массам углекислого газа и воды находим массы углерода и водорода. Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 26,4×12/44 = 7,2 г.
m (H) = 10,8 × 2×1 / 18 = 1,2 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод) и «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом:
Следовательно, простейшая формула углеводорода имеет вид CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12+ 2×1 = 12 + 2 = 14 г/моль].
Чтобы найти истинную формулу оксида хлора найдем отношение полученных молярных масс:
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула углеводорода будет иметь вид C6H12. Это гексен.
| Задание | При сгорании 2,3 г органического вещества, состоящего из углерода, водорода и кислорода, образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров вещества по кислороду равна 1,44 г. Определите молекулярную формулу вещества. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по кислороду: |
Msubstance = 32 × 1,44 = 46 г/моль.
По массам углекислого газа и воды находим массы углерода и водорода, а также кислорода (по разнице между массой вещества и атомов углерода и водорода в нем). Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 4,4×12/ 44 = 1,2 г.
m (H) = 2,7 × 2×1 / 18 = 0,3 г.
m(O) = msubstance — m (C) — m (H) = 2,3 – 1,2 – 0,3 = 0,8 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод), «у» (водород) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 1,2/12 : 0,3/1: 0,8/16;
x:y:z= 0,1 : 0,3: 0,05 = 2 : 6 : 1.
Следовательно, простейшая формула органического соединения имеет вид C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12+ 6×1 + 16= 24 + 6 + 16 = 46 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула органического соединения будет иметь вид C2H6O.
Молекулы. Химические формулы. Молекулярные массы
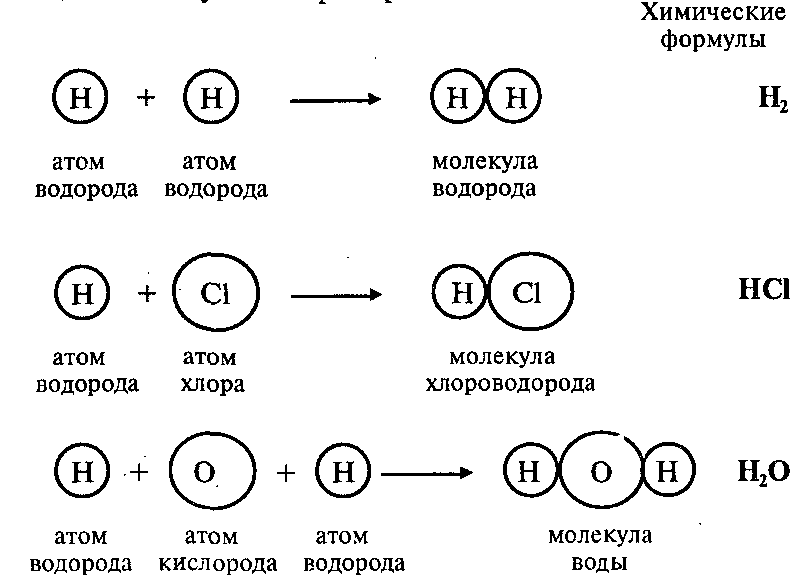
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Что такое молекулярная формула в химии
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Нахождение молекулярной формулы вещества (часть С)
Теория к заданию 35 из ЕГЭ по химии
Нахождение молекулярной формулы вещества
Нахождение химической формулы вещества по массовым долям элементов
Массовая доля элемента — это отношение его массы к общей массе вещества, в состав которого он входит:
Массовая доля элемента ($W$) выражается в долях единицы или в процентах.
2. Количества вещества железа и кислорода равны соответственно:
3. Находим соотношение количества веществ железа и кислорода:
4. Так как в формуле должно быть целое число атомов, то это отношение приводим к целым числам:
$Fe : O=1 : 1.33=2 : 2.66=3·3.99=3 : 4$.
5. Подставляем найденные числа и получаем формулу оксида:
Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии
3. Отношение между атомами:
4. Определяем молекулярную массу углеводорода по относительной плотности ее паров.
5. Вычисляем относительную молекулярную массу углеводорода по простейшей формуле:
3. Отношение между атомами:
5. Молярная масса может быть представлена в виде:
6. Решаем систему двух уравнений с двумя неизвестными:
Нахождение химической формулы вещества по данным об исходном веществе и о продуктах его сгорания (по уравнению химической реакции)
1. Напишем схему уравнения горения углеводорода
$M=1.97$ г/л$·22.4$ л/моль$=44$ г/моль.
3. Определяем количество вещества:
4. Используя величину молярного объема, находим:
Окончательный вид уравнения: