что такое мицелла в химии
Мицелла
Полезное
Смотреть что такое «Мицелла» в других словарях:
МИЦЕЛЛА — (новолат. micella от лат. mica крошечка), частица дисперсной фазы золя, окруженная слоем молекул или ионов дисперсионной среды … Большой Энциклопедический словарь
МИЦЕЛЛА — МИЦЕЛЛА, почти сферическая группа больших молекул, которые, соединяясь, образуют коллоид. Например, молекула мыла или стирального порошка имеет гидрофильную («любящую воду») полярную голову и гидрофобный («ненавидящий воду») неполярный хвост.… … Научно-технический энциклопедический словарь
мицелла — ы, ж. (лат. mīcella букв. крошечка, частичка). хим. В коллоидных растворах: частица малых размеров, окруженная жидкой средой, напр. частица мыла в водном растворе. Толковый словарь иностранных слов Л. П. Крысина. М: Русский язык, 1998 … Словарь иностранных слов русского языка
мицелла — сущ., кол во синонимов: 1 • частица (128) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
МИЦЕЛЛА — (новолат. micella, от лат. mica крошечка), почвенная частица коллоидных размеров, образующаяся в результате соединения гумусных и глинистых частиц и несущая на своей поверхности отрицательный заряд. Экологический энциклопедический словарь.… … Экологический словарь
мицелла — Частица небольших размеров дисперсной фазы в окружении жидкой среды в коллоидной системе. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN micelle … Справочник технического переводчика
мицелла — Термин мицелла Термин на английском micelle Синонимы Аббревиатуры Связанные термины амфифильный, амфотерный сурфактант, биологические нанообъекты, гидрофобное взаимодействие, коллоидная химия, коллоидный раствор, критическая концентрация… … Энциклопедический словарь нанотехнологий
мицелла — (новолат. micella, от лат. mica крошечка), частица дисперсной фазы золя, окружённая слоем молекул или ионов дисперсионной среды. * * * МИЦЕЛЛА МИЦЕЛЛА (новолат. micella, от лат. mica крошечка), частица дисперсной фазы золя (см. ЗОЛИ), окруженная … Энциклопедический словарь
Мицелла — Схематическое изображение мицеллы фосфолипида в водном растворе Мицеллы частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул… … Википедия
мицелла — micelė statusas T sritis chemija apibrėžtis Elektriškai neutrali koloidinio tirpalo dalelė. atitikmenys: angl. micelle rus. мицелла … Chemijos terminų aiškinamasis žodynas
Что такое мицелла в химии
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.2 КОЛЛОИДНЫЕ СИСТЕМЫ
4.2.2 Агрегативная устойчивость лиофобных коллоидов.
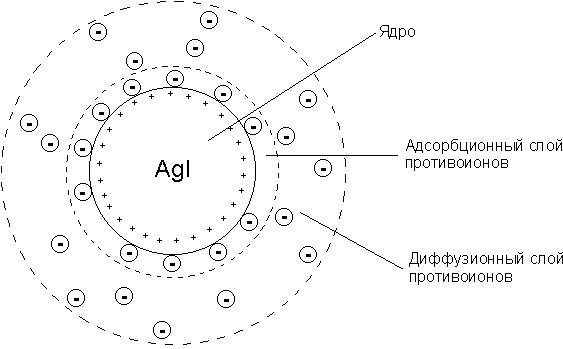
Строение коллоидной мицеллы
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
Рис. 4.9. Строение коллоидной мицеллы
Агрегативная устойчивость золей обусловлена, таким образом, рядом факторов: во-первых, снижением поверхностной энергии дисперсной фазы (т.е. уменьшения движущей силы коагуляции) в результате образования двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания имеющих одноименный заряд коллоидных частиц и противоионов. Еще одна причина устойчивости коллоидов связана с процессом гидратации (сольватации) ионов. Противоионы диффузного слоя сольватированы; эта оболочка из сольватированных противоионов также препятствует слипанию частиц.
4.2.3 Коагуляция лиофобных коллоидов
Для коагуляции золей электролитами установлен ряд эмпирических закономерностей.
2. Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд (правило Шульце – Гарди или правило значности). Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше, чем для однозарядных ионов. Правило значности имеет приближенный характер и справедливо только для неорганических ионов; некоторые однозарядные органические ионы обладают более сильным коагулирующим действием, чем двухзарядные неорганические ионы, что обусловлено их сильной специфической адсорбируемостью.
3. В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие возрастает с уменьшением гидратируемости ионов; например, в ряду однозарядных катионов щелочных металлов коагулирующее действие возрастает от лития к рубидию:
4. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию.
5. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое ( аддитивное ) действие; обычно имеет место взаимное усиление либо ослабление коагулирующего действия ( синергизм либо антагонизм ионов).
Механизм и кинетика коагуляции золей электролитами
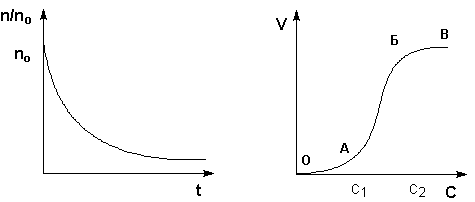
Необходимому для коагуляции сближению частиц дисперсной фазы препятствует, как было показано выше, электростатическое отталкивание имеющих одноименный заряд коллоидных частиц и противоионов и взаимодействие сольватных оболочек противоионов диффузного слоя. При добавлении к золю раствора электролита имеющееся равновесие адсорбции – десорбции между противоионами адсорбционного и диффузного слоев смещается в сторону адсорбции вследствие увеличения в дисперсионной среде концентрации ионов, имеющих заряд, противоположный заряду ядра (ионы с одноименным зарядом в равновесии адсорбции – десорбции не участвуют). Адсорбция дополнительного числа противоионов приводит к уменьшению заряда коллоидных частиц, уменьшению числа противоионов диффузного слоя (уменьшению толщины ДЭС) и, следовательно, к снижению агрегативной устойчивости золя. При достижении некоторого предельного значения заряда коллоидные частицы получают возможность сближения и объединения в более крупные агрегаты за счет ван-дер-ваальсовых сил; иными словами, происходит коагуляция золя.
Очевидно, что, поскольку при адсорбции многозарядных противоионов заряд коллоидной частицы уменьшается быстрее, чем при адсорбции того же числа однозарядных противоионов; адсорбируемость неорганических ионов с увеличением их заряда также возрастает. Следствием этого и является тот факт, что величина порога коагуляции для неорганических ионов будет тем меньше, чем больше заряд иона-коагулянта (величина порога коагуляции γ обратно пропорциональна заряду иона-коагулянта в шестой степени z 6 ).
Рис. 4.10 Коагуляционная кривая. Рис. 4.11 Зависимость скорости
коагуляции от концентрации.
Взаимная коагуляция золей
Коагуляция золя может быть вызвана его взаимодействием с другим золем, частицы которого имеют противоположный заряд. Так, смешение золя гидроксида железа, частицы которого имеют положительный заряд, с отрицательно заряженным золем сульфида мышьяка приводит к их взаимной коагуляции:
В данном случае коагуляция обусловлена тем, что коллоидные частицы одного вида являются как бы очень крупными многозарядными ионами – коагулянтами для частиц другого вида. Взаимная коагуляция коллоидных систем может наблюдаться и тогда, когда частицы золей имеют одноименный заряд; в этом случае причиной потери устойчивости одного из золей является сильная специфическая адсорбция иона – стабилизатора данной системы поверхностью коллоидных частиц другой системы.
Старение золей и пептизация
Термодинамическая неустойчивость лиофобных коллоидных систем является причиной старения золей – самопроизвольной коагуляции (автокоагуляции) золей. Автокоагуляция золей происходит значительно медленнее, чем коагуляция электролитами; так, золи золота могут сохраняться без видимых изменений десятилетиями. Одной из основных причин старения золей является медленно совершающийся процесс перекристаллизации вещества ядра.
Пептизацией (дезагрегацией) называется процесс расщепления коагулировавшего золя (коагулята) на первичные частицы – процесс, противоположный коагуляции. Пептизация возможна лишь тогда, когда структура частиц в коагуляте не изменена по сравнению с первоначальной (т.е. когда еще не произошло полного сращивания частиц и они слабо связаны друг с другом). Различают непосредственную и опосредованную пептизацию.
Непосредственная пептизация происходит в результате добавления к коагуляту электролита, содержащего потенциалопределяющий ион; в результате его специфической адсорбции на поверхности частиц дисперсной фазы их заряд вновь увеличивается, толщина двойного электрического слоя возрастает. Это приводит к тому, что силы отталкивания между частицами начинают преобладать над силами притяжения; происходит деагрегация – распад образовавшегося ранее агрегата из слипшихся частиц.
Опосредованная пептизация вызывается добавлением в систему вещества, химическое взаимодействие которого с поверхностью коагулята приводит к высвобождению потенциалопределяющих ионов. Например, коагулировавший золь гидроксида железа(III) может быть пептизирован добавлением в систему либо какой-либо соли железа (непосредственная пептизация), либо соляной кислоты (опосредованная пептизация).
Мицелла
Мицеллы — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Например, мицелла сульфида мышьяка имеет строение:
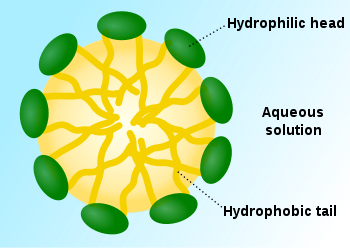
К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ),называемых лиофильными коллоидами. Например, мицеллы додецилсульфата в воде.
Мицеллы могут существовать в состояниях с различными равновесными структурами и в различных внешних формах, устойчивых при различных концентрациях ПАВ в мицеллярном растворе. Такая способность мицелл называется полиморфизмом мицелл.
Смотреть что такое «Мицелла» в других словарях:
МИЦЕЛЛА — (новолат. micella от лат. mica крошечка), частица дисперсной фазы золя, окруженная слоем молекул или ионов дисперсионной среды … Большой Энциклопедический словарь
МИЦЕЛЛА — МИЦЕЛЛА, почти сферическая группа больших молекул, которые, соединяясь, образуют коллоид. Например, молекула мыла или стирального порошка имеет гидрофильную («любящую воду») полярную голову и гидрофобный («ненавидящий воду») неполярный хвост.… … Научно-технический энциклопедический словарь
мицелла — ы, ж. (лат. mīcella букв. крошечка, частичка). хим. В коллоидных растворах: частица малых размеров, окруженная жидкой средой, напр. частица мыла в водном растворе. Толковый словарь иностранных слов Л. П. Крысина. М: Русский язык, 1998 … Словарь иностранных слов русского языка
мицелла — сущ., кол во синонимов: 1 • частица (128) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
МИЦЕЛЛА — (новолат. micella, от лат. mica крошечка), почвенная частица коллоидных размеров, образующаяся в результате соединения гумусных и глинистых частиц и несущая на своей поверхности отрицательный заряд. Экологический энциклопедический словарь.… … Экологический словарь
мицелла — Частица небольших размеров дисперсной фазы в окружении жидкой среды в коллоидной системе. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN micelle … Справочник технического переводчика
мицелла — Термин мицелла Термин на английском micelle Синонимы Аббревиатуры Связанные термины амфифильный, амфотерный сурфактант, биологические нанообъекты, гидрофобное взаимодействие, коллоидная химия, коллоидный раствор, критическая концентрация… … Энциклопедический словарь нанотехнологий
Мицелла — (новолат. micella, уменьшительное от лат. mica крошка, крупинка) отдельная частица дисперсной фазы золя, т. е. высокодисперсной коллоидной системы с жидкой дисперсионной средой. М. состоит из ядра кристаллической или аморфной структуры и… … Большая советская энциклопедия
мицелла — (новолат. micella, от лат. mica крошечка), частица дисперсной фазы золя, окружённая слоем молекул или ионов дисперсионной среды. * * * МИЦЕЛЛА МИЦЕЛЛА (новолат. micella, от лат. mica крошечка), частица дисперсной фазы золя (см. ЗОЛИ), окруженная … Энциклопедический словарь
мицелла — micelė statusas T sritis chemija apibrėžtis Elektriškai neutrali koloidinio tirpalo dalelė. atitikmenys: angl. micelle rus. мицелла … Chemijos terminų aiškinamasis žodynas
МИЦЕЛЛООБРАЗОВА́НИЕ
Том 20. Москва, 2012, стр. 508-509
Скопировать библиографическую ссылку:
МИЦЕЛЛООБРАЗОВА́НИЕ, самопроизвольная ассоциация (самоорганизация) молекул ПАВ в растворе с образованием термодинамически устойчивых коллоидных (наноразмерных) дисперсных систем, в которых наряду с индивидуальными молекулами (или ионами) ПАВ присутствуют ассоциаты характерного размера и строения – мицеллы (от новолатинского micella, уменьшительное от лат. mica – крошка, крупинка). В полярных растворителях образуются прямые, в неполярных – обратные (обращённые) мицеллы. Прямые мицеллы (как правило, в качестве растворителя используется вода) состоят из неполярного ядра, образованного гидрофобными радикалами, и поверхностного слоя из ориентированных к растворителю полярных групп. Прямые мицеллы – ассоциаты из десятков или сотен молекул ПАВ. Число молекул в мицелле называется числом агрегации. Обращённые мицеллы состоят из полярного ядра, образованного гидрофильными группами, а гидрофобные радикалы молекул ПАВ ориентированы в неполярную жидкую фазу. Числа агрегации обращённых мицелл малы́ по сравнению с числами агрегации прямых мицелл. Ассоциация молекул ПАВ в неполярных средах характеризуется низкой кооперативностью и приводит к образованию небольших и полидисперсных частиц. Добавление небольших количеств воды индуцирует кооперативную самоассоциацию ПАВ с образованием обращённых мицелл.
Образование и структура коллоидной мицеллы.
Такие частицы схематически записываются следующим образом:
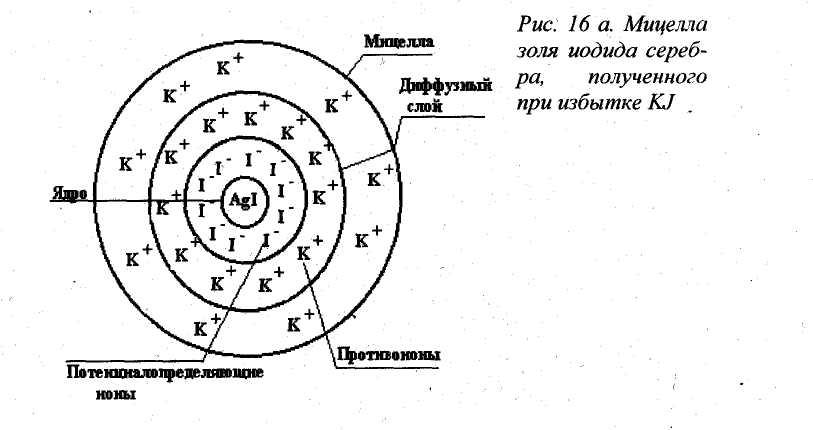
При избытке KI возникает тот же гидрозоль иодида серебра (AgI), но с отрицательно заряженными частицами:
В этих условиях мицелла приобретает следующий вид (рис.16).
Распространяя приведенный пример на более широкий ряд подобных явлений, можно вывести следующее правило: при конденсационном пути образования коллоидных частиц они заряжаются знаком того иона, который
Рис. 16. Мицелла золя иодида серебра, полученного при избытке KI.
находится в избытке и который дает малорастворимое соединение с ионом,
входящим в состав коллоидной частицы. В полярной дисперсионной среде (вода) мицелла приобретает сольватную оболочку.
Зарядившаяся частица, вместе с роем противоионов, называется мицеллой, и является электронейтральной. Ядро мицеллы вместе с потенциалопределяющими ионами и противоионами неподвижного слоя называется гранулой, в отличие от мицеллы она несет электрический заряд.
Гуи и Чэпмен выдвинули теорию диффузного расположения противоионов. По этой теории противоионы не могут быть сосредоточены только у межфазовой поверхности и образовывать моноионный слой, а рассеяны в жидкой фазе на некотором расстоянии от границы раздела. Такая
размытая структура двойного слоя определяется, с одной стороны, электрическим полем у «твёрдой» фазы, стремящимся притянуть эквивалентное количество противоположно заряженных ионов возможно ближе к твердой поверхности, а с другой стороны, тепловым движением ионов, вследствие которого противоионы стремятся рассеяться во всем объеме жидкой фазы. В зависимости от преобладания той или иной силы состояние противоионов оказывается неодинаковым. Действие электрического поля в непосредственной близости от межфазной границы преобладает, с удалением от нее сила поля ослабевает и проявляется все сильнее тепловое движение, рассеивающее противоионы двойного слоя, вследствие чего концентрация противоионов падает и становится равной концентрации тех же ионов, находящихся в жидкой фазе. Таким образом, возникает диффузный слой противоионов, связанный с твердой поверхностью, находящийся с ней в динамическом равновесии (рис.17 II).
дисперсионной среды (электроосмос) в электрическом поле. Эти явления получили название электрокинетических явлений I порядка (под действием электрического поля движется дисперсная фаза или дисперсионная среда).
Электрокинетические явления II порядка – это потенциал течения и
потенциал оседания (под действием движения дисперсной фазы или дисперсионной среды возникает электрический ток).