что такое миорелаксирующее действие препарата
Что такое миорелаксирующее действие препарата
По мере развития медицины возникла необходимость искусственно вызывать вялый паралич скелетных мышц. Он необходим при искусственной вентиляции легких (ИВЛ). Длительную анестезию невозможно больше представить без расслабления мышц и вентиляции легких. Функцию концевой пластинки двигательного нерва можно обратимо нарушить на уровне рецепторов по двум механизмам.
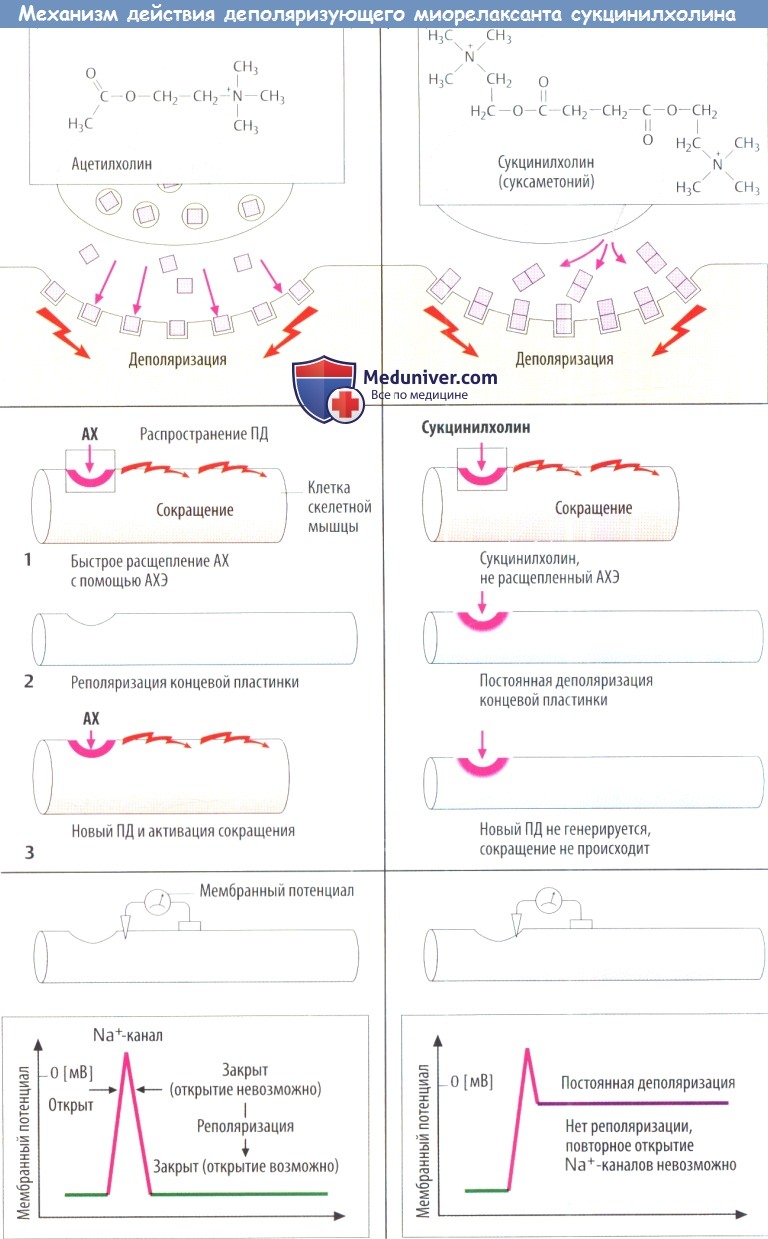
Первый механизм заключается в том, что агонист после связывания с рецептором вызывает одиночный ПД в прилежащей мембране, но остается связанным, тем самым сохраняя деполяризацию концевой пластинки двигательного нерва. По такому механизму действуют деполяризующие миорелаксанты. Ко второй группе относятся недеполяризующие миорелаксанты, которые действуют как антагонисты АХ-рецепторов.
а) Деполяризующие миорелаксанты. Простейшее химическое вещество, которое парализует мышцы, вызывая длительную деполяризацию, — декаметоний:
По химическому строению представляет собой углеводородную цепь с двумя положительно заряженными атомами азота, расположенными на расстоянии 1 нм друг от друга. Метаболически стабильный декаметоний использовался в анестезии, но из-за неудовлетворительных фармакокинетических характеристик его применение прекращено. Он имеет типичную структуру для всех миорелаксантов. Такую же структуру имеет и суксаметоний (сукцинилдихолин).
Структура сукцинилхолина — две молекулы АХ. Он имеет сродство к N-холинорецептору, но не разрушается специфической АХЭ. Неспецифическая сывороточная холинэстераза расщепляет сукцинилхолин медленно,поэтому активная концентрация сохраняется в синаптической щели в течение 5-10 мин (для сравнения: продолжительность действия АХ 1-2 мс).
Побочные эффекты сукцинилхолина — повышение концентрации К + в сыворотке, что может привести к нарушению функции сердца, подъему АД и тахикардии вследствие ганглионарной стимуляции. Сукцинилхолин стимулирует сокращение тонических волокон наружных мышц глаза и повышает внутриглазное давление.
Поэтому сукцинилхолин нельзя применять перед операциями на глазном яблоке. Кроме того, в хронически денервированных мышцах развиваются контрактуры, т. к. после повреждения двигательного нерва на неповрежденной поверхности денервированной скелетной мышцы появляются АХ-рецепторы. Подобная контрактура в сочетании с потерей К + может наблюдаться у пациентов, которым выполняют корректирующую операцию через определенное время послетравмы.
К преимуществам сукцинилхолина относится его очень быстрое начало действия. В последнее время созданы быстродействующие недеполяризующие миорелаксанты, поэтому использование сукцинилхолина сократилось. Сукцинилхолин служит основным миорелаксантом для экстренной интубации.
Деполяризация концевой пластинки двигательного нерва вызывает образование распространяющегося ПД в мембранах окружающих мышечных клеток, что приводит к сокращению мышечного волокна. Непродолжительное время после в/в инъекции наблюдаются мелкие подергивания мышц.
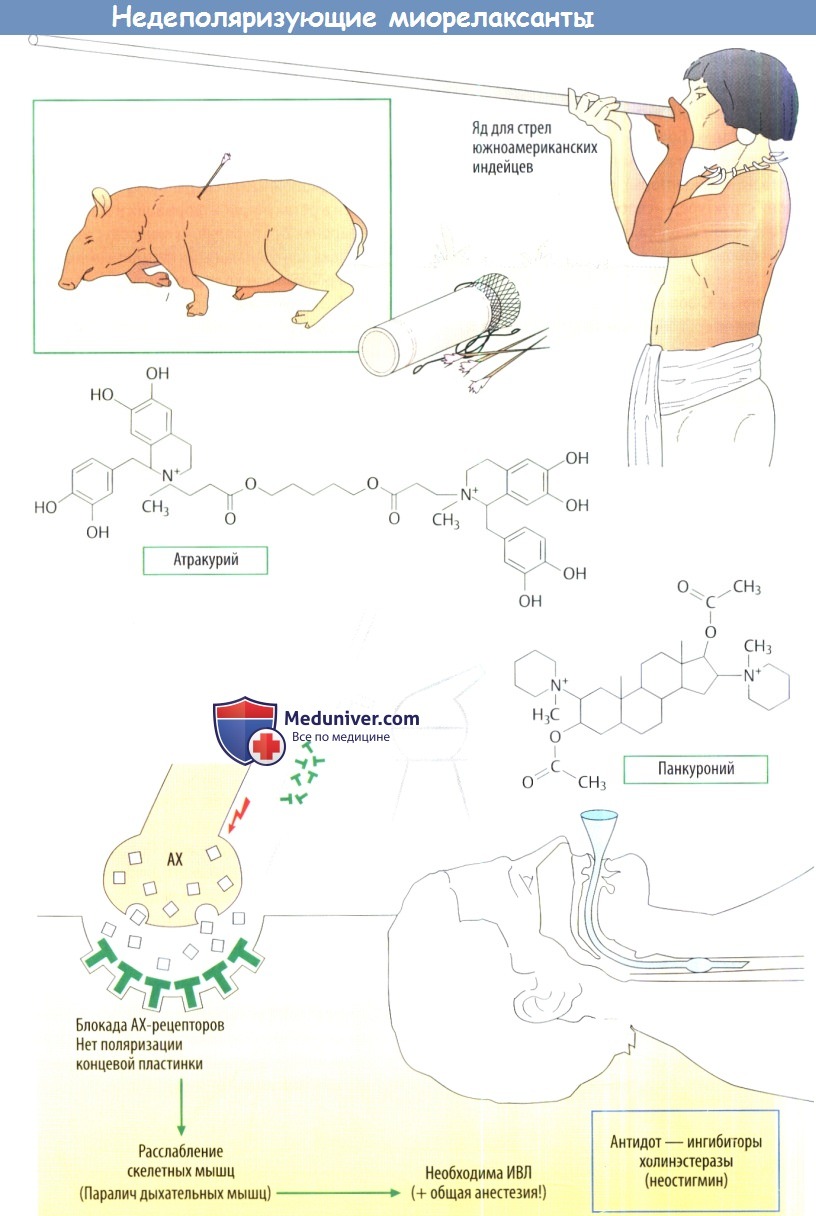
Подобные миорелаксанты имеют более сложную химическую структуру, чем декаметоний. В молекуле недеполяризующих миорелаксантов также имеется два ключевых положительно заряженных атома азота, но они расположены в системе колец. Эти два азотсодержащих кольца соединены либо длинной алифатической цепью, либо стероидной структурой. Формулы двух синтетических миорелаксантов показаны на рис. А. Эти крупные молекулы имеют высокое сродство к N-холинорецепторам, но не обладают собственной активностью, т. е. это чистые антагонисты.
Компонент яда кураре, D-тубокурарин, больше не используется в анестезии из-за неприемлемых побочных эффектов: высвобождение гистамина с падением АД, бронхоспазм и повышение секреции в бронхиальном древе. Также наблюдается ганглиоблокирующий эффект. Новыесинтетические миорелаксанты переносятся лучше. Они различаются по своим фармакокинетическим свойствам, например скорости начала и продолжительности действия.
В хирургии используются следующие препараты: панкуроний (длительного действия), векуроний (среднего действия), мивакурий (короткого действия), рокуроний (быстрое начало действия) и атракурий (расщепляется самопроизвольно после введения и не требует метаболической деградации, что важно для пациентов с заболеваниями печени).
Продолжительность действия недеполяризующих миорелаксантов можно сократить при использовании ингибиторов АХЭ, например неостигмина. АХ, секретируемый концевой пластинкой двигательного нерва, не расщепляется и накапливается в синаптической щели. Отношение антагониста к агонисту смещается в сторону нейромедиатора.
Наконец, следует отметить, что миорелаксанты не проникают в ЦНС. Это означает, что после введения миорелаксантов пациент будет находиться в сознании, однако возможна острая гипоксия вследствие паралича дыхательных мышц. В это время общение с пациентом невозможно из-за паралича всех мышц. При использовании миорелаксантов необходима анестезия и ИВЛ.
Восстановление иннервации происходит за счет роста новой концевой ветви аксона. Этот токсин используется в качестве лекарственного средства. Он вводится в мышцы при лечении болезненных мышечных спазмов, например блефароспазма. Токсин также используется в косметической медицине для модной в настоящее время подтяжки кожи лица.
в) Влияние на сократительную систему. ПД на короткое время деполяризует плазмолемму мышечных клеток, а также распространяется на саркоплазматический ретикулум. Это вызывает высвобождение Са 2+ из саркоплазматического ретикулума, что приводит к укорочению актомиозина. Данный процесс известен как электромеханическое сопряжение. Он ингибируется дантроленом, который используют для лечения болезненных спазмов мышц и злокачественной гипертермии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
БОЛИ В СПИНЕ: болезненный мышечный спазм и его лечение миорелаксантами
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны тел смежных позвонков. Поражение межпозвонкового диска развивается вследствие его повторных травм (подъем тяжести, избыточная статическая и динамическая нагрузка, падения и др.) и возрастных дегенеративных изменений. Студенистое ядро, центральная часть диска, высыхает и частично утрачивает амортизирующую функцию. Фиброзное кольцо, расположенное по периферии диска, истончается, в нем образуются трещины, к которым смещается студенистое ядро, образуя выпячивание (пролапс), а при разрыве фиброзного кольца — грыжу. В настоящее время созданы препараты, оказывающие структурно-модифицирующее действие на хрящевую ткань (старое название — хондропротекторы). Типичным представителем группы является препарат хондро, назначаемый курсом по 4 месяца (эффект сохраняется 2 месяца после отмены). В пораженном позвоночном сегменте возникает относительная нестабильность позвоночника, развиваются остеофиты тел позвонков (спондилез), повреждаются связки и межпозвонковые суставы (спондилоартроз). Грыжи межпозвонковых дисков наиболее часто наблюдаются в нижних поясничных дисках, реже — в нижних шейных и верхних поясничных, крайне редко — в грудных. Грыжи диска в тело позвонка (грыжи Шморля) клинически не значимы, грыжи диска в заднем и заднебоковом направлении могут вызвать сдавление спинно-мозгового корешка (радикулопатию), спинного мозга (миелопатию на шейном уровне) или их сосудов.
Кроме компрессионных синдромов возможны рефлекторные (мышечно-тонические), которые обусловлены импульсацией из рецепторов в ответ на изменения в дисках, связках и суставах позвоночника — болезненный мышечный спазм. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем этот фактор становиться причиной возникновения боли. В отличие от компрессионных синдромов остеохондроза позвоночника, которые встречаются относительно редко, болевые мышечные спазмы возникают в течение жизни практически у каждого второго человека.
Классический пример болезненного мышечного спазма представляет люмбаго (поясничный прострел), который характеризуется резкой, простреливающей болью в пояснице, развивающейся, как правило, при физической нагрузке (подъем тяжести и др.) или неловком движении. Больной нередко застывает в неудобном положении, попытка движения приводит к усилению боли. При обследовании выявляют напряжение мышц спины, обычно сколиоз, уплощение поясничного лордоза или кифоз.
Люмбалгия — боль в спине — и люмбоишиалгия — боль в спине и по задней поверхности ноги — развиваются чаще после физической нагрузки, неловкого движения или переохлаждения, реже — без каких-либо причин. Боли носят ноющий характер, усиливаются при движениях в позвоночнике, определенных позах, ходьбе. Для люмбоишиалгии характерна боль в ягодице, в задненаружных отделах ноги, не достигающая пальцев. При обследовании выявляют болезненность, напряжение мышц спины и задней группы мышц ноги, ограничение подвижности позвоночника, часто сколиоз, симптомы натяжения (Ласега, Вассермана и др.).
На шейном уровне могут возникать рефлекторные мышечно-тонические синдромы: цервикалгия и цервикобрахиалгия, которые чаще развиваются после физической нагрузки или неловкого движения шеи. Цервикалгия — боль в шейной области, которая нередко распространяется на затылок (цервикокраниалгия). Цервикобрахиалгия — боль в шейной области, распространяющаяся на руку. Характерно усиление болей при движениях в шее или, наоборот, при длительном статическом положении (в кино, после сна на плотной высокой подушке и др.). При обследовании выявляют напряжение шейных мышц, часто наблюдается ограничение движений в шейном отделе, болезненность при пальпации остистых отростков и межпозвонковых суставов на стороне боли.
При компрессии нервного корешка (радикулопатии) кроме болезненного мышечного спазма и ограничений подвижности в позвоночнике и конечностях выявляются чувствительные, рефлекторные и (или) двигательные нарушения в зоне пораженного корешка. На поясничном уровне чаще поражаются пятый поясничный (L5) и первый крестцовый (S1) корешки, реже — четвертый поясничный корешок и очень редко — верхние поясничные корешки. Радикулопатии нижних шейных корешков встречаются значительно реже.
Важно помнить, что боли в спине могут быть единственным симптомом при опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга. Боли возникают при деструкции позвонков и поражении нервных корешков вследствие инфекционных процессов (туберкулезный спондилит, спинальный эпидуральный абсцесс), новообразованиях (первичные и метастатические опухоли позвоночника, миеломная болезнь), дисметаболических нарушениях (остеопороз, гиперпаратиреоз, болезнь Педжета). Боль в спине может быть следствием перелома позвоночника, его врожденных или приобретенных деформаций (сколиоза и др.), стеноза позвоночного канала, спондилолистеза, анкилозирующего спондилоартрита.
Она возможна при различных соматических заболеваниях (сердца, желудка, поджелудочной железы, почек, органов малого таза и др.) по механизму отраженных болей.
Обследование пациента с болью в спине требует тщательности. Нельзя любые боли в спине списывать на «остеохондроз» — состояние, которое при рентгенологическом исследовании выявляется у большинства людей среднего и пожилого возраста. Для неврологических проявлений остеохондроза позвоночника и миофасциальных болей характерны болезненный мышечный спазм и ограничение подвижности позвоночника.
Диагноз рефлекторных и компрессионных осложнений остеохондроза основывается на клинических данных и требует исключения других возможных причин болей в спине. Рентгенографию позвоночника используют, в основном, для исключения врожденных аномалий и деформаций, воспалительных заболеваний (спондилитов), первичных и метастатических опухолей. Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, опухоль спинного мозга.
Диагноз миофасциальных болей основывается на клинических данных (выявление болезненного мышечного напряжения одной или нескольких мышц) и требует исключения других возможных причин боли; дифференциальный диагноз с рефлекторными синдромами (мышечно-тоническими синдромами) вследствие остеохондроза позвоночника часто вызывает сложности; возможно сочетание этих заболеваний.
Лечение рефлекторных синдромов и радикулопатий вследствие остеохондроза основывается в остром периоде на обеспечении покоя — больному рекомендуется избегать резких наклонов и болезненных поз. Предписаны постельный режим в течение нескольких дней до стихания резких болей, жесткая постель (щит под матрац), прием миорелаксантов центрального действия, при необходимости — также дополнительно анальгетиков, нестероидных противовоспалительных средств. Для облегчения передвижения в этот период следует надеть шейный или поясничный корсет (фиксирующий пояс). Можно использовать физиотерапевтические анальгезирующие процедуры, втирание обезболивающих мазей, компрессы с 30–50-процентным раствором димексида и новокаином, новокаиновые и гидрокортизоновые блокады. При ослаблении болей рекомендуют постепенное увеличение двигательной активности и упражнения на укрепление мышц.
При хроническом течении рефлекторных синдромов и радикулопатий могут быть эффективны мануальная терапия, рефлексотерапия, физиотерапевтическое лечение, санаторно-курортное лечение. Хирургическое лечение (удаление грыжи диска) необходимо в тех редких случаях, когда возникает сдавление спинного мозга или корешков конского хвоста. Хирургическое лечение также показано при дискогенной радикулопатии, сопровождающейся выраженным парезом, и при длительном (более трех-четырех месяцев) отсутствии эффекта от консервативного лечения и наличии большой грыжи диска. Для профилактики обострений остеохондроза рекомендуют избегать провоцирующих факторов (подъем больших грузов, ношение тяжелой сумки в одной руке, переохлаждение и др.), регулярно заниматься лечебной гимнастикой.
При миофасциальных болях необходимо, чтобы мышца находилась в покое в течение нескольких дней. В качестве лечения можно назначать упражнения на растяжение мышц (постизометрическая релаксация), физиотерапию, рефлексотерапию или местное введение анестетиков в триггерные зоны, компрессы с димексидом и анестетиками.
Как уже было отмечено, и при острых болях, и при хронических болевых синдромах большое значение имеет лечение болезненного мышечного спазма. Тоническое напряжение мышц может не только само по себе быть причиной боли, но и способно вызвать деформацию и ограничивать подвижность позвоночника, а также обуславливать компрессию проходящих вблизи нервных стволов и сосудов. Для его лечения помимо нестероидных противовоспалительных средств, анальгетиков, (например, нимулид в форме трансдермального геля для местной терапии или в форме лингвальных таблеток при остром болевом синдроме), физиотерапии и лечебной гимнастики в качестве препаратов первого ряда применяют миорелаксанты — препараты, способные разорвать «порочный круг» болевого синдрома [2].
Для лечения болезненного мышечного спазма миорелаксанты используются внутрь или парентерально. Снижая рефлекторное мышечное напряжение, миорелаксанты уменьшают боль, улучшают двигательные функции и облегчают проведение лечебной физкультуры. Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают до тех пор, пока сохраняется болевой синдром; как правило, курс лечения составляет несколько недель. В ходе целого ряда исследований удалось доказать, что при болезненном мышечном спазме добавление к стандартной терапии (нестероидные противовоспалительные средства, анальгетики, физиотерапия, лечебная гимнастика) миорелаксантов приводит к более быстрому регрессу боли, мышечного напряжения и улучшению подвижности позвоночника.
В качестве миорелаксантов применяются мидокалм, баклофен и сирдалуд. Миорелаксанты обычно не комбинируют друг с другом. Для снятия болезненных мышечных спазмов можно также использовать диазепам (седуксен, реланиум) в индивидульно подобранной дозе.
Сирдалуд (тизанидин) — агонист α-2 адренергических рецепторов. Препарат снижает мышечный тонус вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга; сирдалуд обладает также умеренным центральным анальгезирующим действием. При приеме внутрь максимальная концентрация сирдалуда в крови достигается через час, прием пищи не влияет на его фармакокинетику. Начальная доза препарата составляет 6 мг в сутки в три приема, средняя терапевтическая доза — 12—24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов отмечаются сонливость, головокружение, незначительное снижение артериального давления; требуется осторожность при приеме препарата больными пожилого возраста.
Мидокалм (толперизон) в течение длительного времени широко используется при лечении рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника (остеохондроз, спондилез, спондилоартроз) и миофасциальных болей [3]. Мидокалм оказывает преимущественно центральное миорелаксирующее действие. Снижение мышечного тонуса при приеме препарата связывается с угнетающим влиянием на каудальную часть ретикулярной фармации и подавлением спинно-мозговой рефлекторной активности. Препарат обладает умеренным центральным анальгезирующим действием и легким сосудорасширяющим влиянием. Прием мидокалма начинают с 150 мг в сутки три раза в день, постепенно увеличивая дозу до получения эффекта, у взрослых обычно до 300—450 мг в сутки. Для быстрого эффекта препарат вводится внутримышечно по 1 мл (100 мг) два раза в сутки или внутривенно по 1 мл один раз в сутки.
Эффективность и безопасность применения мидокалма при болезненном мышечном спазме доказана в ходе двойного слепого плацебо-контролируемого исследования [4]. В восьми исследовательских центрах 110 больных в возрасте от 20 до 75 лет методом рандомизации получали мидокалм в дозе 300 мг в сутки или плацебо в сочетании с физиотерапией и реабилитацией в течение 21 дня. В качестве объективного критерия эффективности лечения рассматривают болевой порог давления, измеряемый с помощью специального прибора (Pressure Tolerance Meter) в 16 симметричных точек туловища и конечностей. Кроме того, пациенты субъективно оценивали свое состояние по интенсивности боли, ощущению напряжения мышц и подвижности позвоночника; врач также оценивал напряжение мышц и подвижность позвоночника. Перед началом лечения и после его окончания проводилось развернутое клиническое и лабораторное обследование, включая ЭКГ, измерение артериального давления, биохимический анализ крови по 16 показателям.
Согласно результатам исследований, применение мидокалма достоверно снижает болезненный мышечный спазм, измеряемый объективно инструментальным методом. Различие между группами лечения и плацебо, которое отмечалось уже на четвертый день, постепенно увеличивалось и становилось статистически достоверным на 10-й и 21-й дни лечения, которые были выбраны в качестве конечных точек для доказательного сравнения. Анализ субъективной оценке результатов лечения, данной врачами и пациентами после его окончания (через 21 день), показал, что в группе больных, получавших мидокалм, достоверно чаще результаты лечения оценивались как очень хорошие, тогда как в группе плацебо эффект существенно чаще отсутствовал. Согласно субъективной оценке результатов лечения, данной больными после его окончания (через 21 день), каких-либо значимых различий, касающихся переносимости мидокалма и плацебо, выявлено не было. У подавляющего большинства больных отмечалась хорошая переносимость мидокалма. Результаты ЭКГ, биохимические и гематологические показатели в группе пациентов, принимавших как мидокалм, так и плацебо, также не различались.
Важно отметить, что более половины (62%) пациентов, включенных в исследование, получали другие виды терапии до начала исследования, и у большинства из них (68%) при этом не отмечалось улучшения. Это свидетельствует об эффективности мидокалма в лечении болезненного мышечного спазма, резистентного к другим видам терапии.
Введение мидокалма парентерально позволяет быстро снять боль и уменьшить мышечное напряжение. При вертеброгенном мышечно-тоническом синдроме внутримышечное введение 100 мг мидокалма ослабляет боль уже через 1,5 ч, а лечение мидокалмом в течение недели по 200 мг/сут в/м, а затем на протяжении двух недель по 450 мг/сут перорально имеет достоверное преимущество над стандартной терапией; при этом терапия мидокалмом не только позволяет уменьшить боль, но и снимает тревожность, повышает умственную работоспособность [1].
При болезненном мышечном спазме достоинствами мидокалма помимо эффективного миорелаксирующего и обезболивающиего эффекта являются отсутствие побочных эффектов и хорошее взаимодействие с нестероидными противовоспалительными средствами, что во многих случаях позволяет уменьшить дозу последних и вследствие этого ослабить или даже полностью устранить их побочные эффекты, не снижая эффективности лечения.
Важным преимуществом мидокалма перед другими миорелаксантами является отсутствие седативного эффекта и мышечной слабости при его приеме. Это преимущество доказано в ходе двойного слепого плацебо-контролируемого исследования [5]. В исследовании вошли 72 здоровых добровольца в возрасте от 19 до 27 лет (средний возраст — 21,7 лет). Исследование проводилось в течение восьми дней, все это время добровольцы методом рандомизации получали 150 или 450 мг мидокалма в сутки в три приема либо плацебо — также в три приема. Нейропсихологические исследования осуществляются утром в первый и последний (восьмой) дни исследования до и после приема мидокалма через 1,5, 4 и 6 ч либо плацебо. Результаты исследования не показали каких-либо существенных различий в скорости сенсомоторных реакций и быстроте выполнения различных психологических тестов через 1,5, 4 и 6 ч после приема мидокалма в дозе 50 или 150 мг либо плацебо. Аналогичные исследования, проведенные на восьмой день с начала приема мидокалма, также не показали существенных различий в сравнении с группой плацебо. Это свидетельствует о хорошей переносимости мидокалма и возможности назначения его в тех случаях, когда по роду деятельности пациенту требуется сохранить быстроту реакций и способность концентрировать внимание, в том числе при вождении автомобиля.
Таким образом, болезненный мышечный спазм представляет собой одну из наиболее распространенных причин болей в спине (вследствие рефлекторных синдромов остеохондроза или миофасциальных болей). В таких случаях рекомендуется применение миорелаксантов в комбинации с различными лекарственными средствами, физиотерапией и лечебной гимнастикой. В последние годы доказана эффективность и безопасность миорелаксанта мидокалма, который не вызывает седативного эффекта и выпускается в форме для парентерального введения с целью быстрого купирования болевого синдрома.
Литература.
В. А. Парфенов, доктор медицинских наук, профессор ММА им. И. М. Сеченова
Т. Т. Батышева, кандидат медицинских наук Поликлиника восстановительного лечения №7 Москвы
Болевой синдром: возможности использования миорелаксантов
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Каждый человек из своего опыта знает, что такое боль, однако крайне сложно дать точное научное описание этого понятия. Международная ассоциация по изучению боли IASP определяет боль как «неприятное чувство или эмоциональное ощущение, связанное с действительным или возможным повреждением ткани или описываемое в терминах такого повреждения». В настоящее время в разных популяциях наиболее часто встречается боль в спине, цефалгия, боль при онкологических заболеваниях, прозоплагия, а также синдром тазовой боли, постгерпетическая невралгия, боль при ВИЧ-инфекции, боль вследствие травмы. Несмотря на выдающиеся достижения современной медицины, проблема терапии боли остается актуальной во всех странах для всех клиницистов. При этом подходы к аналгезии при одном и том же заболевании у различных специалистов могут значительно отличаться [2, 10–12, 16, 29].
Боль в спине, которую хотя бы один раз в жизни испытывает 80–90% взрослого населения, является одной из наиболее частых причин обращения в медицинские учреждения и самой частой причиной нетрудоспособности. Головная боль наблюдается у 80% трудоспособного населения европейских стран, при этом лидирующее положение занимает головная боль напряжения, составляя около 70% всех цефалгий. Около 30% пациентов, впервые обратившихся к онкологу, испытывают боль различной интенсивности. В случае успешного противоопухолевого лечения боль уменьшается или купируется полностью. При генерализации опухолевого процесса боль нередко (в 70–100% случаев) является ведущим симптомом, снижающим качество жизни онкологических больных [1, 9, 13, 20].
Классификация боли представляет собой сложную задачу. Существуют клинические классификации головной, тазовой, онкологической боли и др. Общепринятыми принципами систематизации боли считаются указание этиологии и локализации болевого синдрома, определение степени выраженности и длительности боли. Считается, что острая боль, сохраняющаяся в течение 3–6 мес. без устранения причины, ее вызвавшей, становится самостоятельным патологическим процессом, который можно классифицировать как хронический болевой синдром. Выделяют слабую, умеренную, сильную и нетерпимую боль [11, 16, 25, 29].
По своему биологическому происхождению боль может быть физиологической и патологической. Физиологическая боль – это сигнал опасности и неблагополучия в организме, направленный на мобилизацию защитных процессов, восстановление поврежденной ткани и нормальной жизнедеятельности. Ощущение боли формирует комплекс защитных реакций, направленных на устранение повреждения. По быстрому уменьшению ее интенсивности судят о разрешении болезненной ситуации. Как правило, это острая боль, которая встречается в 80% случаев. При купировании сигнальной функции боли она превращается в самостоятельный повреждающий фактор, вызывая нарушение систем регуляции гомеостаза, приводя к физическому и психическому истощению, социальной дезадаптации пациента. Хроническая боль является патологической. Ее постоянное наличие имеет различные проявления. К ним относят поглощенность болью, ограничение личной, социальной и профессиональной деятельности, аффективные расстройства, частое обращение за медицинской помощью и употребление большого количества медикаментов, когда человек сживается с ролью больного [40]. Хотя важность этих факторов признавалась и ранее, только в последние десятилетия предприняты систематические попытки создания модели боли [6]. Грань, разделяющая эти два варианта боли, достаточно условна и во многом зависит от физиологического и психологического состояния человека. Степень ответных реакций организма и характер испытываемой боли во многом определяются не только самим повреждением, но и индивидуальным опытом человека, его отношением к повреждению. Так, одно и то же раздражение в одних условиях может вызвать нестерпимую боль, в других – оказаться незамеченным.
Патофизиологическая классификация предполагает выделение трех вариантов боли: ноцицептивную, нейропатическую и дисфункциональную. Ноцицептивная боль (синонимы: соматогенная, соматическая) возникает в ответ на раздражение болевых рецепторов (ноцицепторов) механическими, термическими, химическими стимулами или в ответ на воспаление так называемых «молчащих» ноцицепторов. В большинстве своем эта боль является адаптативной защитной реакцией организма и способствует выживанию индивида. Примерами ноцицептивной боли являются боли вследствие травмы, повреждения, ожога, боль в суставах при остеоартрозе, артрите, миофасциальные болевые синдромы, сосудистые боли, стенокардитические боли, боли при желчекаменной болезни и др. По своему характеру боль может быть различной: ноющей, колющей, режущей, сжимающей и др. Она обычно ощущается в месте повреждения, усиливается при движении и ослабевает в покое [33, 47]. Основным патофизиологическим механизмом этой боли является воспаление, что оправдывает применение нестероидных противовоспалительных препаратов (НПВП) при фасеточном синдроме, в течение первых недель после травмы. При остеоартрозе в механизмах воспаления и боли участвуют также фактор роста нервов NGF и некоторые цитокины (интерлейкин-6 и др.). Это позволяет использовать ингибиторы NGF (танезумаб) и некоторые структурно-модифицирующие препараты (хондропротекторы – хондроитин, глюкозамин), обладающие антицитокининовыми свойствами, как потенциальные средства для уменьшения боли. При ревматоидном артрите боль обусловлена участием в воспалительном процессе фактора некроза опухоли TNFα, поэтому ингибиторы TNFα (инфликсимаб, адалимумаб, этанерцепт и др.) также эффективны при данном заболевании. При ноцицептивной боли, в основе которой лежит мышечный спазм, показаны миорелаксанты, у каждого из которых имеются свои точки приложения, что необходимо учитывать при индивидуальном подборе препарата.
Нейропатическая (синоним неврогенная) боль возникает вследствие повреждения или болезни, затрагивающей соматосенсорную систему [25]. Эта боль обычно возникает при хронических заболеваниях, в результате повреждения или компрессии периферического нерва, спинномозгового узла, спинного мозга, поражения области зрительных бугров. Ощущение боли проецируется в область иннервации конкретного нерва [21, 47]. Примерами нейропатического болевого синдрома являются тригеминальная, постгерпетическая невралгии, боли при полинейропатиях различного генеза, возникающие при повреждении спинного мозга, сирингомиелии, боли постинсультного генеза. Нейропатические боли сопровождаются как позитивными (спонтанная боль, аллодиния, гипералгезия, дизестезия, парестезия), так и негативными (гипестезия, гипоалгезия, аналгезия) сенсорными проявлениями [25, 27, 47]. Для купирования нейропатической боли НПВП неэффективны, т.к. воспалительная реакция, на которую они влияют, не играет значимой роли в развитии такой боли. В развитии нейропатической боли выделяют ряд механизмов. Во-первых, это периферическая сенситизация (при полинейропатиях, туннельных синдромах, травмах периферических нервов). При этом на мембранах сенсорных периферических нейронов активизируются натриевые каналы, что приводит к снижению порога активации ноцицепторов. В сенситизированных тканях даже обычные стимулы могут вызвать болевые ощущения. В этой ситуации предпочтительнее назначать препараты, блокирующие данные каналы: лидокаин, антиконвульсанты (карбамазепин, окскарбазепин, ламотриджин, топирамат). Препараты капсаицина, блокаторы калиевых каналов А-типа уменьшают боль за счет действия на специальные рецепторы TRPV1. В последнее время для купирования периферической нейропатической боли стали использовать ботулотоксин, который снижает афферентную ноцицептивную активность в периферических нервах. Важным механизмом нейропатической боли является центральная сенситизация (гипервозбудимость центральных чувствительных нейронов). Клинически она проявляется аллодинией и вторичной гипералгезией. В этой ситуации используются препараты, уменьшающие центральную сенситизацию (антиконвульсанты типа габапентина и прегабалина, которые связываются с α2-δ субъединицей потенциалзависимых кальциевых каналов и снижают частоту деполяризации ноцицептивных нейронов на уровне задних рогов спинного мозга). Уменьшению возбудимости центральных нейронов в спинном мозге способствует флупертин за счет активации выхода из них ионов калия. Еще одним не менее важным механизмом развития хронической нейропатической боли является дизингибиция (дефицит нисходящих антиноцицептивных влияний). В этом случае наиболее эффективными средствами являются трициклические антидепрессанты (амитриптилин) и селективные ингибиторы обратного захвата серотонина и норадреналина (дулоксетин, венлафаксин, милнаципран), снижающие дизингибицию. При выраженном интенсивном болевом синдроме к лечению добавляют опиоиды. При необходимости проводят комбинированную терапию [6, 12, 17].
Дисфункциональная боль возникает при отсутствии органической причины болевого синдрома. Она обусловлена изменением функционального состояния систем, контролирующих боль, т.е. так называемый «синдром центрального усиления боли». Основными факторами, способствующими развитию дисфункциональных болей, являются психологические, социальные факторы, эмоциональный стресс. При этом нарушается адекватная работа нисходящих антиноцицептивных систем (норадренергической и серотонинергической), что приводит к восприятию неболевых стимулов как болевых. Типичными примерами таких болей являются головные боли напряжения, фибромиалгии, психогенная боль (соматоформные расстройства). Т.к. основными механизмами развития дисфункциональной боли являются дизингибиция и центральная сенситизация с патогенетической точки зрения обоснованно применение антидепрессантов, прегабалина, габапентина и флупиртина. Однако при этом виде боли особую роль играет биопсихосоциальный подход, который включает себя не только лекарственную терапию, но и когнитивно-поведенческие, психологические, физиотерапевтические методы коррекции, кинезиотерапию, социальную реабилитацию пациента [6]. Некоторые варианты боли нельзя трактовать однозначно и в большинстве случаев хронической боли приходится сталкиваться со смешанным ее типом, что требует комплексной терапии.
Существенным фактором в усугублении хронического болевого синдрома является рефлекторное напряжение мышц. С одной стороны, повышение возбудимости ноцицепторов вызывает рефлекторную активацию мотонейронов передних рогов в соответствующих сегментах спинного мозга и тоническое сокращение мышц. При этом длительное напряжение ухудшает кровоснабжение мышечной ткани, в ней развиваются гипоксия, ацидоз, выделение медиаторов воспаления, которые, связываясь с рецепторами на мембране периферических окончаний мышечных ноцицепторов, сенситизируют их. Появляются локусы болезненных мышечных уплотнений, что в свою очередь усиливает афферентный поток ноцицептивных импульсов в задние рога спинного мозга и другие отделы ЦНС, и повышается возбудимость центральных ноцицепторов. Таким образом, мышечный спазм становится не только дополнительным источником боли, но и формирует порочный круг, обеспечивающий хронизацию соматогенного болевого синдрома. Поэтому наряду с обезболиванием у пациентов с хроническим болевым синдромом необходимо использовать препараты, снижающие тонус поперечно-полосатых мышц.
Миорелаксанты широко применяются при органических заболеваниях нервной и костно-мышечной систем. Помимо миорелаксирующего действия эта группа преапаратов обладает легким анальгезирующим эффектом. К миорелаксантам с центральным механизмом действия относят тизанидин, баклофен, толперизона гидрохлорид, флупиртин, бензодиазепины, с периферическим – ботулинический токсин типа А.
Однако у каждого из противоспастических средств есть свои точки приложения. Баклофен – агонист ГАМКВ-рецепторов, угнетающий моно- и полисинаптические спинальные рефлексы, что приводит к снижению мышечного тонуса и умеренному обезболивающему эффекту. Нежелательные явления чаще проявляются сонливостью, головокружением, нарушением походки, иногда возникают тошнота, запор, диарея, артериальная гипотония. Требуется осторожность при лечении пожилых пациентов.
Толперизон блокирует натриевые каналы интернейронов, что приводит к подавлению рефлекторной активности на спинальном уровне в результате угнетающего влияния ретикулярной формации. Из нежелательных явлений наиболее характерны головная боль, снижение артериального давления, тошнота, рвота, аллергические реакции.
Бензодиазепины обладают ГАМК-ергическим действием и облегчают ГАМК-ергическую передачу. Их точкой приложения является ретикулярная формация ствола мозга. Эти препараты обладают анксиолитическим, противосудорожным, миорелаксирующим эффектом. Бензодиазепины могут использоваться в терапии хронического болевого синдрома, сопровождающегося тревогой, в качестве анксиолитика и миорелаксанта. Главным нежелательным явлением при применении этой группы лекарственных средств является риск развития зависимости.
Ботулинический токсин типа А влияет на нервно-мышечный синапс, блокируя выделение ацетилхолина и вызывая стойкую (до 3–6 мес., иногда до 12 мес.) хемоденервацию инъецированной мышцы, т.е. является миорелаксантом локального действия [3, 8].
Сирдалуд (тизанидин) относится к производным имидазолина и является селективным α2-адренергическим агонистом. Препарат имеет структурное сходство с клонидином, однако, в отличие от последнего, проявляет избирательное действие в отношении мышечного тонуса, являясь центральным миорелаксантом. Миорелаксирующий эффект препарата обусловлен стимулирующим влиянием на α2-адренорецепторы, что подавляет высвобождение возбуждающих нейромедиаторов (норадреналина и аспартата) как в спинном, так и в головном мозге, уменьшая их воздействие на NMDA-рецепторы и снижая возбудимость мотонейронов спинного мозга. Воздействуя на структуры спинного мозга, тизанидин преимущественно угнетает полисинаптические рефлексы, которые отвечают за гипертонус мышц, тем самым вызывая снижение тонуса сгибательной и разгибательной мускулатуры и уменьшение болезненных мышечных спазмов. Воздействуя на структуры головного мозга (на уровне синего пятна – locus ceruleus), тизанидин создает центральный умеренно выраженный анальгезирующий эффект. Кроме того, тизанидин влияет и на имидазолиновые рецепторы [34]. Возможно, ингибирующее влияние тизанидина на спинальные рефлексы на супраспинальном уровне обусловлено его влиянием именно на имидазолиновые рецепторы, а на спинальном уровне – как на имидазолиновые, так и на α2-адренорецепторы. В дополнение к этому тизанидин ингибирует высвобождение субстанции P из сенсорных афферентных нервных волокон и замедляет проведение возбуждения по нисходящим подкорково-спинальным путям. Вполне вероятно, что анальгезирующий эффект Сирдалуда может быть реализован через снижение центральной сенситизации [26]. Таким образом, уменьшение боли под влиянием тизанидина обусловлено не только миорелаксирующим действием, но и анальгетическим эффектом, в основе которого лежит непрямое антиноцицептивное действие, осуществляемое через неопиоидную нейрональную систему. Привыкание к анальгетическому действию препарата при длительном применении не развивается. Препарат позволяет устранять не только острые болезненные мышечные спазмы, но и оказывает антиспастическое действие при хронических спастических состояниях спинального и церебрального происхождения.
Известно, что Сирдалуд обладает противовоспалительной активностью и потенцирует действие НПВП. Еще одним основанием для использования комбинации Сирдалуда с НПВП является способность тизанидина нивелировать побочные эффекты НПВП, связанные с воздействием на желудочно-кишечный тракт. Гастропротективная активность Сирдалуда обусловлена его влиянием на α2-адренорецепторы в центральной нервной системе и желудке [36]. Тизанидин уменьшает базальную и индуцированную секрецию кислоты в желудке; снижает содержание в слизистой оболочке низкомолекулярного гликопротеина и нормализует синтез высокомолекулярного гликопротеина. Доказано снижение ульцерогенного эффекта ацетилсалициловой кислоты, индометацина, мелоксикама, нимесулида и напроксена [36], ибупрофена [23] и диклофенака [43] при их сочетании с Сирдалудом.
Структурное сходство с клонидином обусловливает риск развития гипотензии и брадикардии, однако при использовании тизанидина в дозе 6–8 мг/сут. эти побочные эффекты выражены слабо и носят преходящий характер. Однако при одновременном применении Сирдалуда с ингибиторами цитохрома Р450 1А2 (CYP1A2) ципрофлоксацином и флувоксамином, а также ингибиторами АПФ и другими антигипертензивными препаратами возможно значительное усиление гипотензии и брадикардии. Стимулируя α2-адренорецепторы и являясь деконгестантом, Сирдалуд может вызывать сухость во рту [32, 41, 46].
Как α2-адренергический агонист, Сирдалуд оказывает седативное действие, что, являясь по сути побочным эффектом, может быть полезным при нарушении сна и эмоционального фона пациента, а также способствует субъективному изменению восприятия боли. Сирдалуд предназначен исключительно для приема внутрь, при этом он быстро и практически полностью всасывается из желудочно-кишечного тракта, создавая максимальную концентрацию в плазме крови через 1–2 ч. Экскреция тизанидина и его метаболитов осуществляется в основном с мочой, период полувыведения составляет 3–5 ч [17].
Сирдалуд имеет ряд преимуществ перед другими миорелаксантами центрального действия: обладает помимо миорелаксантного действия анальгезирующим эффектом; миорелаксирующий эффект не сопровождается снижением мышечной силы [48]; гастропротективный эффект позволяет использовать препарат в комбинации с НПВП; побочные эффекты менее выражены, чем при использовании аналогичных миорелаксантов (баклофен, бензодиазепины, дантролен) [22, 32, 37, 48].
В настоящее время Сирдалуд не только широко используется для лечения мышечных спазмов, но может применяться в комплексной терапии болевых синдромов различной этиологии. В неврологической практике он доказал свою эффективность при лечении тригеминальной невралгии [28], миофасциальной [39], головной [14, 31, 41, 42], нейропатической [38] боли, боли при дорсопатиях [5, 35, 45], боли у пациентов со спастическими парезами.
Важным условием эффективного и безопасного применения Сирдалуда является индивидуальный подход при подборе дозы, определении длительности приема препарата, использование рациональных комбинаций и исключение нежелательного взаимодействия с другими лекарственными препаратами.
При острой слабой боли, обусловленной мышечным спазмом, достаточна монотерапия Сирдалудом в сочетании в последующем с лечебной физкультурой и физиотерапией. Назначение Сирдалуда можно ограничить приемом 2–4 мг препарата на ночь коротким курсом до прекращения боли (не более 1 нед.). Результаты исследований позволяют рекомендовать Сирдалуд как препарат выбора среди миорелаксантов для лечения боли, связанной с мышечным спазмом [35].
При умеренно выраженной боли, обусловленной мышечно-тоническим или миофасциальным синдромом, целесообразно использование препарата в 3 приема. Первый прием лучше назначить на ночь в дозе 2–4 мг, суточная доза препарата может быть постепенно (с интервалами не менее 3 дней) увеличена с 6 до 12 мг/сут. При необходимости можно дополнительно назначить 2–4 мг Сирдалуда на ночь. Положительный эффект обычно наступает через 3–5 дней терапии, продолжительность курса достигает 2 нед.
При сильной боли и/или сочетании мышечного спазма с воспалительными изменениями целесообразна комбинация Сирдалуда и НПВП, что позволяет не только потенцировать анальгезирующий эффект препаратов, но и нивелировать ульцерогенное воздействие НПВП за счет гастропротективного эффекта Сирдалуда [23, 26, 43].
При лечении хронической боли монотерапия как миорелаксантами, так и НПВП, равно как и сочетание этих двух групп препаратов, как правило, оказываются неэффективными. Как известно, ведущую роль в лечении хронических болевых синдромов играют антиконвульсанты и антидепрессанты. Однако сочетание их с миорелаксантами, в т.ч. с Сирдалудом, нередко не лишено смысла, особенно при сохранении миофасциального синдрома. При этом важно учитывать взаимодействие тизанидина с указанными препаратами. Показано, что Сирдалуд потенцирует действие трициклических антидепрессантов (амитриптилина) [24]. В то же время необходимо помнить, что противопоказано сочетание Сирдалуда и флувоксамина, являющегося ингибитором цитохрома Р450 1А2 (CYP1A2).
При хронических болевых синдромах суточная доза (12–24 мг/сут.) Сирдалуда распределяется на 3–4 приема, наращивается постепенно от 2–4 мг/сут., длительность курса лечения составляет 2–4 нед.; продолжительность лечения, а также доза препарата может варьировать в зависимости от его эффективности и переносимости [7].
Для лечения головной боли рекомендуются дозы от 2–4 до 18 мг/сут. курсом от 2 до 8 нед. [11, 15, 30, 42]. Наиболее эффективным считается назначение Сирдалуда при головной боли напряжения, сочетающейся с напряжением перикраниальных мышц.
При лечении боли, обусловленной спастичностью при поражении центрального мотонейрона, оптимальный терапевтический эффект достигается при суточной дозе от 12 до 24 мг. Суточная доза (12–24 мг/сут.) Сирдалуда распределяется на 3–4 приема, наращивается постепенно от 2–4 мг/сут., длительность курса лечения составляет несколько месяцев; продолжительность лечения и доза препарата зависят от его эффективности и переносимости. В максимально возможно ранние сроки при лечении спастичности необходимо назначать лечебную физкультуру и физиотерапию, возможно использование локального введения препаратов ботулинического токсина [15, 19, 32, 37, 48].
После подбора эффективной дозы препарата в случаях, когда планируется его длительное применение, можно использовать лекарственную форму тизанидина в виде капсул с модифицированным освобождением (Сирдалуд МР), которые выпускаются в дозе 6 мг, что позволяет увеличить комплаентность пациентов. Отмена препарата должна производиться постепенно.
Тизанидин используется для лечения невралгии тройничного нерва [39], миофасциальной боли жевательных мышц [4], фантомной боли [44], успешно применяется в ревматологической практике [12].
Сирдалуд является эффективным и безопасным препаратом для лечения болевых синдромов, связанных с повышением мышечного тонуса, что позволяет использовать его как препарат выбора для монотерапии острой миофасциальной боли и как препарат первой очереди для лечения хронической миофасциальной боли в комбинации с другими лекарственными средствами.