что такое мезенхимальная дифференцировка
Что такое мезенхимальная дифференцировка
Эпителиально-мезенхимальный переход (Epithelial-mesenchymal transition, EMT) — сложный процесс изменения эпителиальными клетками эпителиального фенотипа на мезенхимальный, происходящий в эмбриональном развиитии, заживлении ран, а также при патологических процессах — например, при фиброзе, а также при опухолевой прогрессии.
Существует также и обратный процесс — мезенхимально-эпителиальный переход (Mesenchymal-epithelial transition).
Среди механизмов EMT можно выделить несколько ключевых моментов:
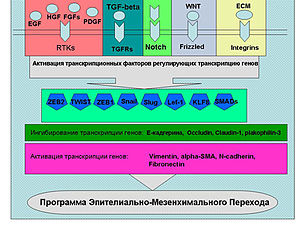
Растворимые факторы роста (на схеме), цитокины, молекулы внеклеточного матрикса активируют сигнальные пути ведущие к реализации программы ЭМП. Эти пути активируют ряд транскрипционных факторов (Snail, Twist, Slug, ZEB1, ZEB2, Lef-1 и др.), которые связываются с промоторами генов ответственных за ЭМП.
Одним из основных процессов, происходящих во время регенерации тканей является превращение эпителиальных клеток в мезенхимальные и наоборот, из мезенхимальных клеток в эпителиальные.
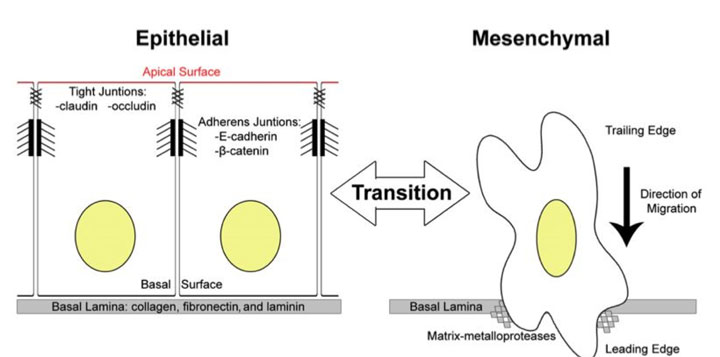
На рисунке выше показана разница между этими двумя основными фенотипами клеток. Важно, что нет никаких других многоклеточных тканей. Эпителиальные клетки плотно связаны друг с другом и с внеклеточным матриксом. Внеклеточный матрикс является базальной пластинкой, которая служит своего рода «колыбелью» для эпителиальных клеток. Мезенхимальные клетки расположены в 3D внеклеточной матрицы. Они биполярны, а это значит, что у них есть другое расположение цитоскелета и распределение органелл внутри них.
Утрата характерных черт эпителия (структуры ткани, клеточных взаимодействий, контроля специфическими факторами роста, приобретение подвижности и морфологии фибробластов) – это так называемое EMT, эпителиально-мезенхимальное превращение. ЕМТ свойственно нормальному эпителию в процессе развития, особенно раннего, например при гаструляции, когда эпителий приобретает подвижность и активно внедряется в подлежащие слои. ЕМТ имеет место при временных повреждениях ткани, при этом эпителиальные клетки теряют полярность, прекращают синтез кадхеринов, образуют виментин и фибронектин и одновременно с этим приобретают подвижность. Они прекращают синтез клеточных ядерных трансфакторов и образование антигенов, характерных для эпителиальных тканей. Эпителиальные клетки становятся типичными фибробластами. ЕМТ, по-видимому, лежит в основе инвазии и метастазирования: клетки эпителиальной опухоли становятся подвижными и приобретают способность расселяться по разным территориям организма. При этом очень существенно, что клетки претерпевают физиологическое, а не генетическое превращение, так как ЕМТ обратимо.
Метастазы, возникшие на основе ЕМТ, могут приобретать морфологию исходной опухоли, а эпителий в краевых районах раны может приобретать фибробластные свойства. Индукция ЕМТ имеет место при взаимодействии опухолей, экспрессирующих онкоген Ras и TGFр. Но так или иначе ЕМТ выглядит как заключительный этап прогрессии эпителиальной опухоли, когда опухоль теряет эпителиальные признаки (полярность клеток, специфические клеточные контакты, характерную морфологию и тканеспецифическую антигенную структуру) и одновременно приобретает черты фибробластов (экспрессию виментина, подвижность, независимость от территории роста).
Можно думать, что понимание этого процесса и факторов, в нем участвующих, создадут основу для рациональной терапии инвазии и метастазирования – главных свойств злокачественности. При этом непонятно, что будет дальше. Ведь прогрессия должна быть бесконечна, а EMT как бы завершает ее.
Источник: Nature Reviews Molecular Cell Biology 15,178–196, (2014)
Что такое мезенхимальная дифференцировка
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Развивающимся направлением клеточной медицины является использование уникальных свойств прогениторных клеток, обладающих высокой биологической активностью и потенциалом дифференцировки. Мультипотентные мезенхимные стромальные клетки (ММСК) являются полипотентными клетками, обладающими рядом важных для клинического применения свойств. Применение ММСК, культивированных «ex vivo», открывает вопрос об оценке качества и безопасности культуры для клинического применения. Целью настоящего обзора являлась разработка программы культивирования и исследования значимых свойств человеческих ММСК для клинического применения. Приведена характеристика этапов оценки качества и безопасности ММСК, включая культивирование клеток «ex vivo», оценку иммунофенотипа, ростовых, иммуномодулирующих, регенеративных и прогениторных свойств, оценку генетической и микробиологической безопасности. Проведена оценка «in vitro» тестов для определения качества и безопасности ММСК. Подчёркивается, что выраженность свойств каждого отдельного образца различна и зависит от источника и условий культивирования клеток.
Остаётся открытым вопрос об оценке качества и безопасности ММСК, культивируемых для клинического применения. Очевидно, что каждый образец ММСК, который будет применён для лечения, должен быть оценен с позиции наличия у клеток необходимых в данной клинической ситуации полезных биологических свойств и безопасности для пациента.
Целью настоящего обзора литературы являлось определение основных этапов исследований индивидуальных значимых свойств образцов человеческих ММСК в процессе культивирования для клинического применения.
Источники получения ММСК
Очевидно, что эксплантация источников ММСК взрослого организма (костный мозг, жировая ткань) требуют инвазивного вмешательства, чреватого осложнениями. Неонатальные же источники ММСК могут быть получены без какого-либо значимого вмешательства в процесс родов.
Таким образом, контроль качества материала для экспансии ММСК должен включать комплекс медицинских, этических и правовых мероприятий, связанных с забором материала для экспансии, особенно связанного с инвазивными процедурами. Важен возраст донора в случае культивирования ММСК из взрослых тканей, в случае забора плацентарной ткани требуется оценка доли клеток фетального происхождения и доли материнских ММСК.
Условия культивирования ММСК
Таким образом, различные условия культивирования ММСК существенно влияют на их свойства. Следовательно, изменяя условия культивирования образцов ММСК можно добиться улучшения их клинически значимых характеристик.
Оценка «чистоты» полученной культуры ММСК
При изучении свойств ММСК было обнаружено большое количество поверхностных кластеров дифференцировки, экспрессируемых клетками. Если взять все описанные для ММСК маркеры, использующиеся для идентификации или селекции ММСК, то их число превысит несколько десятков. Данные по экспрессии поверхностных маркеров ММСК представлены в таблице.
Оценка способности ММСК к дифференцировке
Таким образом, оценка дифференцировочного потенциала ММСК проводится в двух направлениях:
1) качественное, цель которого подтвердить способность данной культуры к дифференцировке;
2) количественное, с целью оценить клиническую ценность данного конкретного образца.
Определение пролиферативного потенциала ММСК и старения клеток в культуре
Взаимодействие ММСК с другими клетками
Важнейшим свойством ММСК, которое является основой большинства случаев их клинического применения, является способность взаимодействовать с другими клетками как in vitro, так и in vivo. Взаимодействие с другими клетками реализуется как за счет непосредственных клеточных контактов, так и посредством продукции паракринных факторов. Виды взаимодействия ММСК с другими клетками организма, определяющие клинический эффект, можно подразделить на:
– взаимодействие ММСК с клетками иммунной системы (иммуномодулирующий и противовоспалительный эффект);
– взаимодействие с клетками повреждённых тканей (трофический и антиапоптотический эффект);
– стимуляция ангиогенеза (улучшение васкуляризации тканей);
– формирование стромы для гемопоэтических предшественников (обеспечение гемопоэза).
Оценка генетической стабильности ММСК
Исходя из данных литературы, можно сделать вывод, что оценка генетической стабильности ММСК является неотъемлемой частью системы контроля качества культивируемых ex vivo клеток. Однако литературные источники говорят, что большинство нарушений, выявляемых в трансформированных ММСК, проявляются на генном уровне и лишь в ходе опухолевой прогрессии начинают проявляться грубые поломки генома.
Следует добавить, что исследования генетической стабильности ММСК важны не только для реципиента ММСК, но и для донора. Вероятно, наличие генетических поломок в культуре ММСК является неблагоприятным прогностическим признаком в плане возможного возникновения онкологических заболеваний у донора в будущем.
Микробиологическая безопасность культуры ММСК
Не нуждается в комментариях то, что ММСК, полученные для клинического применения, должны быть безопасны в плане отсутствия контаминации микрофлорой. Бактериологическая безопасность образцов ММСК достигается путём соблюдения ряда правил и норм асептики и антисептики, касающихся всего процесса экспансии ММСК – от забора материала до выдачи готовой к применению культуры. Более интересным и неисследованным является вопрос о вирусологической безопасности ММСК, так как возможен перенос вирусов как вне клеток вследствие загрязнения материала, полученного от донора – носителя вируса, так и внутри самих ММСК при наличии тропизма вируса к клеткам.
Из приведённых данных следует вывод, что вирусологическое исследование образца ММСК должно включать как обследование самого донора, так и тестирование культуры ММСК на наличие в ней генома вирусов, тропных к ММСК.
Заключение
Таким образом, на основании анализа данных литературы можно привести основные этапы исследования клинически значимых свойств образцов ММСК. Контроль качества ММСК можно разделить на:
1. Общий контроль качества – безопасность полученных клеток и их общебиологических свойств, включающий:
а) оценку микробиологической безопасности:
– бактериологическое исследование среды, в которой культивировались клетки;
– серологическое исследование донорской сыворотки на антитела и антигены ВИЧ, гемотрансмиссивных гепатитов, парвовируса, цитомегаловируса, ВПГ1 и герпеса 6 типа;
– ПЦР исследование МСК с целью выявления вирусов: парвовирус, цитомегаловирус, ВПГ 1, герпес 6 типа;
б) иммунофенотипирование полученных ММСК – иммунологический минимум для подтверждения принадлежности к ММСК: определение экспрессии CD105, CD73 и CD90 в сочетании с отсутствием экспрессии CD45, CD34; CD14 или CD11b; CD79α или CD19 и HLA-DR;
в) оценка пролиферативных свойств и темпа старения ММСК в культуре – определение кумулятивного времени удвоения популяции, определение относительного количества КОЕ-Ф, МТТ-тест, качественная или количественная оценка активности ассоциированной со старением β-галактозидазы, оценка длины теломер;
г) качественная оценка способности к дифференцировке в остеогенном, хондрогенном и адипогенном направлении – с целью подтверждения принадлежности культуры к ММСК – культивирование в соответствующих дифференцировочных средах.
2. Специальный контроль качества – набор лабораторных тестов (в зависимости от поставленной конкретной клинической задачи):
а) оценка генетической стабильности включает:
– кариотипирование, выявление транслокаций и делеций участков 12, 20 и других хромосом, сравнительная геномная гибридизация (CGH);
– определение экспрессии генов p14, c-Myc, p21, p53, CDK-1, CDK-2, CDK-6, c-Myc, HGMA2, INK4A и RB;
– определение длины теломер и активности теломеразы;
б) количественная оценка способности к остеогенной и хондрогенной дифференцировке – с целью оценки активности образца ММСК в перспективе дальнейшего приживления in vivo и замещения дефектов целевых тканей. Остеогенная дифференцировка может быть определена по экспрессии генов CDC20, HIST2H2AA3, Runx2, ИЛ11, количественной оценке уровня щелочной фосфатазы, глюкозоаминогликанов. Хондрогенная дифференцировка может быть оценена по экспрессии генов агрекана Aggrecan, Sox9, Col2a1, можно дополнительно определять уровень miR-140;
в) оценка иммуномодулирующих свойств ММСК – способность подавлять в культуре пролиферацию NK клеток и Т-лимфоцитов, уровень экспрессии цитокинов TGFβ, ИЛ6, ИЛ10, ИЛ12, TNF-α, простагландина Е2, индоламин 2,3-дезоксигеназы, HGF;
г) оценка поддержки ГСК – определение уровня цитокинов SDF1, ГМ-КСФ, Г-КСФ, SCF, ИЛ6, EPO;
д) оценка паракринной функции – определение уровня цитокинов b-NGF, NT-3, NT-4, BDNF нейрорегулин-1, IGF-1, VEGF, М-КСФ, ИЛ6, ИЛ11, ИЛ15, SCF, SDF-1,sICAM-1, TGF-b, HGF, FGFIGF, имеющих помимо всего прочего нейротрофическое, ангиогенное и противоапоптотическое действие;
е) проведение HLA-типирования в случае, если клинический эффект предполагает приживление и дифференцировку аллогенных ММСК.
Указанный перечень, сформулированный нами на основе анализа значительного объема экспериментально-клинических данных, является обобщенным – для каждой конкретной ситуации, в зависимости от цели клинического применения культуры ММСК из приведенного списка должны быть выполнены отдельные, наиболее значимые пункты.
Медицинские интернет-конференции
Языки
Эпителиально-мезенхимальная трансформация как фактор прогрессирования хронической болезни почек
Маслякова Г.Н., Россоловский А.Н., Напшева А.М.
Резюме
Ключевые слова
Статья
Введение
Согласно определению, под термином «хроническая болезнь почек» стоит понимать наличие любых маркеров повреждения почек, персистирующих в течение трех месяцев вне зависимости от нозологического диагноза. При этом среди маркеров повреждения почек отмечаются такие показатели, как альбуминурия, стойкие изменения в осадке мочи, результаты данных визуализирующих методов исследования, снижение скорости клубочковой фильтрации, а также результаты прижизненного морфологического исследования нефробиопсий. Термин ХБП появился в 2002 году, когда официально был опубликован новый раздел Рекомендаций DOQI (Dialysis OutcomeQualityInitiative), названный Рекомендациями по хроническим болезням почек [1]. Появление этого термина стало необходимым, так как в нефрологии сложилась такая ситуация, когда, по сути, развившееся последствие какой-либо патологии почек стало играть роль основного заболевания и потребовало соответствующих лечебных мероприятий. По данным различных исследований, в популяции 10-17% людей имеют признаки ХБП различной степени выраженности. Диагностируется болезнь на ранних стадиях лишь у 1% населения. Так, например, по данным крупного исследования NEORICA, проводимом в Великобритании, среди 40 097 200 обследованных жителей страны в возрасте старше 18 лет, ХБП 3-5-й стадии выявлена у 3 547 654 человек, что составляет 8,8%. В то время как ежегодный прирост диализной ХПН (5 стадия ХБП) составляет 100-150 человек на 1 млн. населения [2]. По данным ряда исследователей, наблюдающийся в настоящее время прогрессивный рост числа пациентов с терминальной ХПН приобретает характер пандемии [3].
В настоящее время в научных публикациях активно дискутируется вопрос о механизме развития и прогрессирования ХБП. Наряду с получившей широкое распространение теорией В.М. Brenner о первостепенной роли в прогрессировании ХБП уменьшения массы действующих нефронов, а также «гипоксической теории» L.C. Fine, в последнее десятилетие стал рассматриваться вопрос о первостепенной роли изменений тубулоинтерстициальной зоны в развитии и прогрессировании ХБП и возникновении терминальной ее стадии. Роль канальцевого эпителия в формировании тубулоинтерстициальных изменений обусловлена несколькими механизмами. С одной стороны, цитокины, продуцируемые клетками, инфильтрирующими почечные клубочки, способны проникать в тубулоинтерстициальное пространство и активировать синтез тубулярными клетками хемокинов, вызывающих, в свою очередь, клеточную воспалительную реакцию в интерстиции [4]. С другой стороны, повышенная продукция цитокинов, секретируемых эпителиальными клетками, непосредственно способствует повреждению клубочков [5]. Кроме того, эпителиальные клетки не только опосредуют интерстициальное воспаление, но также стимулируют секрецию интерстициальными фибробластами таких цитокинов, как тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF-2) и трансформирующий фактор роста (TGF- β 1). Кроме того, канальцевые эпителиальные клетки принимают участие в синтезе экстрацеллюлярного матрикса как напрямую, так и в результате эпителиально-мезенхимальной трансформации (ЭМТ) [6,7].
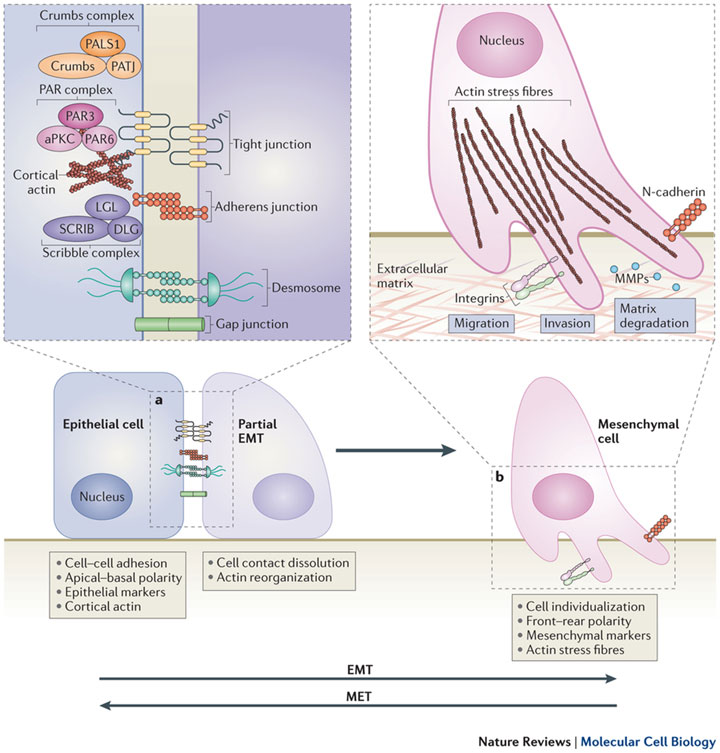
В настоящее время эпителиально-мезенхимальная трансформация является новым аспектом реакции почек на повреждение. ЭМТ демонстрирует способность гломерулярных и канальцевых клеток к фенотипическим изменениям в процессе ремоделирования. Эпителий почечных канальцев имеет мезенхимальное происхождение, поэтому он может иметь некоторые общие фенотипические характеристики с фибробластами. Очевидно, что при определенных обстоятельствах фенотипическое сходство канальцевых эпителиоцитов с фибробластами может усиливаться, в связи с чем они начинают экспрессировать ряд экстрацеллюлярных матриксных белков, в т. ч. проколлагены типа I и III, а также фибронектин и ламинин. По мнению ряда авторов, нельзя исключать также и возможность наличия на территории почечного тубулоинтерстиция определенного количества недифференцированных мезенхимальных клеток, которые могут активироваться и непосредственно модулировать фиброгенез [8]. По мнению ряда исследователей, ЭМТ стимулируется группой биологически активных веществ, продуцируемых активированными эпителиоцитами [9]. Такими веществами являются TGF- β 1, эпителиальный фактор роста, интерлейкин-1, ангиотензин II, матриксная металлопротеиназа-2 [10]. Так, например, ангиотензин II вызывает фенотипические изменения фибробластов, превращая их в миофибробласты (гладкомышечные актин-позитивные клетки). Пролиферирующие активизированные фибробласты могут занимать перигломерулярные и перитубулярные пространства, способствуя отложению матрикса в тубулоинтерстициальной зоне. При этом присутствие миофибробластов в интерстиции тесно коррелирует с распространенностью тубулоинтерстициального склероза и прогнозом состояния функций почек при различных повреждениях [11]. В процессе ЭМТ канальцевые эпителиальные клетки в ответ на повреждение теряют апикально-базальную полярность, начинают экспрессировать мезенхимальные маркеры, такие как виментин и фибробластно-специфический белок, и снижают экспрессию эпителиальных маркеров: цитокератина, Е-кадгерина и др. Потеря функционального E-кадгерина – критическое событие в ЭМТ. Процесс ЭМТ условно подразделяют на 4 составляющих, включающих утрату адгезивных свойств, экспрессию de novo альфа-актина гладкомышечными клетками, разрушение базальной мембраны канальцев и собственно нарастающую клеточную трансформацию из эпителиального в мезенхимальный фенотип [12].
Первоначально было установлено, что эпителиальные клетки трансформируются в мезенхимальные в процессе эмбриогенеза. Мезенхимальные клетки имеют две важные в процессе эмбриогенеза характеристики: они могут мигрировать черезвнеклеточный матрикс и дифференцироваться в последующем в другие клетки. ЭМТ в процессе эмбриогенеза имеет название тип 1. Результаты более поздних исследований позволили выявить тип 2, который возникает при прогрессировании фиброза, и тип 3, имеющий место при прогрессии и метастазировании злокачественных новообразований.
В экспериментальных исследованиях установлено, что контакт канальцевых клеток с базальной мембраной оказывает стабилизирующее действие на эпителиальный фенотип. Напротив, разрыв коллагена IV типа – главного компонента тубулярной базальной мембраны – стимулирует эпителиально-мезенхимальную трансформацию [13, 14,15].
Материалы и методы
В проведенном исследовании мы попытались определить ЭМТ при изучении послеоперационного материала, полученного от 154 больных, находившихся на стационарном лечении по поводу мочекаменной болезни. По результатам определения скорости клубочковой фильтрации все пациенты были разделены согласно последним рекомендациям NKF-K/DOQI (2005) на 5 групп.
Иммуногистохимическое исследование проводилось с набором цитокератинов (34βЕ, 10/13, 5/6 и 8), выявляющих эпителиальные клетки, а также Е-кадгерином.
Результаты
По результатам определения экспрессии цитокератинов 34βЕ, 10/13, 5/6 сделать достоверные выводы о снижении уровня экспрессии при прогрессировании ХБП не представлялось возможным. Поскольку и интенсивность экспрессии, и количество экспрессирующих клеток не имело никаких достоверных различий ни в одной из стадий ХБП.
При дальнейшем проведении иммуногистохимического исследования получены достоверные данные, подтверждающие, что при прогрессировании ХБП в эпителиоцитах канальцев почек снижается экспрессия Е-кадгерина. Согласно результатам данного исследования, снижение экспрессии происходит постепенно от 2 стадии до отрицательных результатов в 4 и 5 стадиях ХБП, что подтверждено получением статистически значимого уровня p=0,021, что ˂0,05. При этом снижение экспрессии антигена происходило именно в эпителиоцитах, уменьшенных в размерах, приобретающих вытянутую, веретенообразную форму уже со 2 стадии ХБП, что свидетельствовало об исчезновении в них фенотипических признаков эпителиальной ткани. Мы считаем это морфологическим проявлением нарушения нормальной последовательности развития репаративных процессов: пролиферация – дифференцировка.
Обсуждение
Полученные результаты свидетельствуют о нарушении процесса дифференцировки клеток и начале склеротических изменений. Учитывая, что экспрессия цитокератина-8 отмечается как в ранние стадии ХБП, так и в терминальном периоде при массивном фиброзе ткани почек у пациентов 5 стадии ХБП, говорить о приобретении эпителиоцитами фенотипических признаков мезенхимальных клеток не представляется возможным. Таким образом, для подтверждения ЭМТ как фактора прогрессирования фиброза почек при ХБП необходимы дальнейшие исследования с применением широкого спектра иммуногистохимических, морфологических и, возможно, молекулярных методов.
Научная электронная библиотека
5.4.2.3.1. Хондрогенная дифференциация мезенхимальных стволовых клеток. Эффекты факторов роста и сигнальной трансдукции
Мезенхимальные стволовые клетки становятся многообещающим источником клеток для регенерации хряща из-за способности к росту in vitro, без потери своего фенотипа. Значительное внимание уделяется повышению способности хондрогенной дифференциации. Несмотря на то, что МСК продемонстрировали большие перспективы в регенерации хряща, необходимо выполнение ряда условий, чтобы они могли эффективно дифференцироваться в хондроциты и поддерживать этот дифференцированный фенотип перед имплантацией. Эти условия включают методы и материалы для культивирования МСК, которые обеспечивают микроэкологический контроль их хондрогенеза. При оптимальных условиях культивирования, содержащих определенные экзогенные факторы, MSC могут быть направлены на хондрогенную дифференциацию. Фаза дифференцировки стволовых клеток в направлении хондрогенеза может быть разделена на различные стадии, включая прикрепление клеток, пролиферацию/дифференцировку и дифференцировку/гипертрофию (Mrugala D. et al., 2009).
Обычная система хондрогенеза стволовых клеток in vitro использует культуру гранул, где гранулы, содержащие от 200 000 до 500 000 клеток, подвергают хондрогенной индукции с базальной средой, содержащей коктейль дексаметазона, аскорбиновой кислоты, инсулина, трансферрина и селеновой кислоты. Трансформирующий фактор роста (TGF)-β (TGF-β1, 2 и 3) является наилучшим индуктором хондрогенеза, который приводит к образованию хряща с осаждением сульфатированных гликозаминогликанов (s-GAG) и коллагена II типа. Система культивирования гранул рекапилизует мезенхимальную конденсацию с взаимодействием клеток, необходимых для хондрогенеза (Toh W.S. et al., 2013). Однако эта обычная система культивирования с трансформирующим фактором роста-β может быть недостаточной для поддержания фенотипической стабильности образования хряща, и для индукции хондрогенеза в направлении стабильного образования хряща требуется более сложные сигналы (Toh W.S. et al., 2011b).
Хондрогенная дифференциация МСК также зависит от конкретных факторов роста и сигнальной трансдукции. Несмотря на то, что тканеинженерные конструкции хорошо разработаны для 3D-культуры, поддержание хондрогенного фенотипа проблематично при культивировании МСК только на каркасах, то есть без других локальных факторов in vivo. Чтобы преодолеть эти проблемы, используют ряд новых биоматериалов, инновационных технологий культивирования клеток и недавно обнаруженных факторов роста в соответствии с направлениями применения клеточных средств для тканевой инженерии. Факторы роста являются ключевыми регуляторами правильной дифференциации МСК (Hwang N.S., et al., 2006; Park S., et al., 2007). Факторы роста, которые способствуют хондрогенезу или демонстрируют хондрогенный эффект как in vivo, так и in vitro, включают морфогенетические белки (BMP), трансформирующие факторы роста-β (TGF-β1, TGF-β3), инсулин-подобные факторы роста (Linkhart T.A., et al., 1996; O′Driscoll S.W., 1999; Kil S.J. Carlin C., 2000). Продемонстрированы различия в требованиях к факторам роста для хондрогенной индукции стволовых клеток из разных источников, которые могут определяться особенностями пула рецепторов фактора роста, экспрессируемых клетками (Handorf A.M., Li W.-J, 2014). Своевременное применение факторов роста при оптимальной концентрации, комбинации и воздействии в зависимости от экспрессии соответствующих рецепторов фактора роста необходимо для улучшения хондрогенеза стволовых клеток в направлении стабильного образования хряща
Гипоксическая среда являются биоактивным агентом для индуцирования оптимального хондрогенеза МСК. Применение гипоксии во время хондрогенеза, дает последовательные результаты расширенной экспрессии хондрогенных генов и осаждения матриц в различных источниках МСК. Это подчеркивает роль гипоксии во время хондрогенеза, влияние которой опосредованного преимущественно гипоксически-индуцируемыми транскрипционнами факторами, (HIF-1α и HIF2α). Было показано, что HIF-1α улучшает хондрогенез МСК путем индуцирования экспрессии коллагена II типа во взаимодействии с промотором Sox9 (Robins J.C.et al., 2005). Гипоксия усиливает хондрогенную дифференцировку MSC с повышением активности коллагена II типа и аггрекана посредством активации пути АКТ и p38 MAPK (митоген-активированные протеинкиназы) (Kanichai M. et al., 2008; Hirao M. et al., 2006). В дополнение к хондрогенным эффектам гипоксия также оказывает антигипертрофическое и антикатаболическое действие на МСК и хондроциты с понижающей регуляцией экспрессии коллагена X типа, щелочной фосфатазы и матричной металлопротеиназы-13 (Sheehy et al., 2012; Strobel et al., 2010). Гипоксическая репрессия гипертрофии представляет собой комбинированный эффект регуляции посредством активации HDAC4 и Nkx3.2, а также ингибирование Smad6, что приводит к подавлению Runx2 и, следовательно, коллагена X типа (Kawato Y. et al., 2011). Однако в настоящее время взаимосвязь и основные механизмы HIF-1α и HIF-2α в катаболической регуляции хондрогенеза, приводящие к гипертрофии, до сих пор неясны.
Кроме вышеуказанных факторов индуцировать хондрогенез могут механические воздействия на хондроциты. Электромагнитное поле и комбинация усилий сдвига/динамического сжатия являются лучшими физическими стимуляторами соревания хондроцитов. (Ahmed T.A., Hincke M.T., 2014). Механическая стимуляция с использованием гидростатических нагрузок и растяжения клеток, среди других сил, была применена для активации путей механотрансдукции и содействия хондрогенезу в клетках. (Ogawa H., et al., 2014). Показано, что динамическая стимуляция (например, циклический сдвиг или динамическое сжатие) клеток приводит к образованию более прочного хряща по сравнению с стимуляцией клеток статическими силами. (Grodzinsky A.J., et al., 2000). При развитии хряща механические факторы играют важную роль взаимодействуя с сигнальным контуром Ihh-ПТГрП, регулирующим поддержание и дифференциацию суставных хондроцитов (Chen X., et al., 2008; Vortkamp A., et al., 1996).
Экспрессия мРНК ПТГрП возрастает с увеличением амплитуды циклического механического растяжения в культивируемых пластинчатых хондроцитах (Tanaka N. et al., 2005). Механическая стимуляция хондроцитов приводит к секреции ПТГрП, что существеннейшим образом влияет на хондрогенез (Xu T., et al., 2013). Таким образом, есть очевидные доказательства того, что биомеханическая стимуляция хондроцитов является значимым фактором способствующим хондрогенезу. Эти факты стали предпосылками для использования физиологической динамической деформационной нагрузки или скользящей контактной нагрузки при формировании тканеинженерного хряща на основе хондроцитов, что привело к улучшению его механических свойств и биохимических показателей (Lima E.G., et al., 2007; Mauck R.L. et al., 2000, 2002; Bian L., et al., 2010). Такие нагрузочные схемы имитируют циклические воздействия на хрящ in vivo в физиологических условиях, которые, необходимы для поддержания структуры и функции хондроцитов (Buckwalter J.A., Mankin H.J., 1998), а также для усиления конвекции питательных веществ через ткань (Mauck R.L., et al., 2003; Albro M.B., et al., 2008) Кроме того, сложное взаимодействие содержания коллагена и протеогликана обуславливаетк уникальные структурно-функциональные характеристики суставного хряща. Таким образом, применение физико-химических стимулов может модулировать структурную организацию (Kelly T.N., et al., 2006), количество и тип внеклеточного матрикса, что приводит к должным механическим свойствам сконструированной хрящевой ткани.
В последние годы реакции хондроцитарной клеточной среды и фенотипические изменения были исследованы в области биоакустофлюидики с использованием ультразвукового поля стоячей волны. В недавнем исследовании была разработана и охарактеризована новая акустофлуидная биореакторная система культивирования агрегатов человеческих суставных хондроцитов, которая применяет акустические силы для механического стимулирования клеток в долгосрочной культуре для создания 3D-гиалиноподобного хряща. Применяя ее исследовали и количественно определяли, как текучие сдвиговые напряжения, создаваемые биореактором, могут быть модулированы в электронном виде и оцениваются в результате различий в качестве образования хряща. Изменяя акустические параметры (амплитуда, частотная развертка и частота повторения развертки), клетки стимулировались колебательными напряжениями сдвига жидкости, которые динамически модулировались с разной частотой повторения развертки.
Механизм механической стимуляции, который способствовал образованию хряща, затем дополнялся фактором роста ПТГрП для улучшения образования гиалиноподобного хряща со структурными и механическими свойствами, сопоставимыми со свойствами человеческого хряща, что оценивалось иммуногистологией и наноиндексацией, соответственно. Поскольку создаваемая ткань представляет собой гиалиноподобный хрящ, его качество оценивали по матричной композиции протеогликанов и коллагена II типа. Затем фракции для этих маркеров сравнивали с коллагеном I типа (маркер для фиброартиляжа) и коллагена X типа (маркер для гипертрофического хряща).