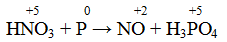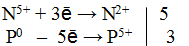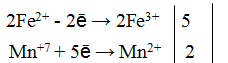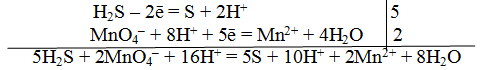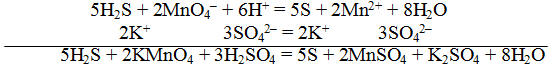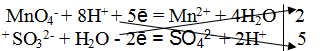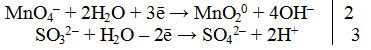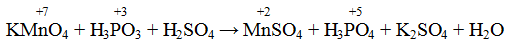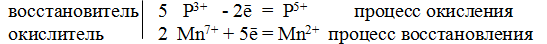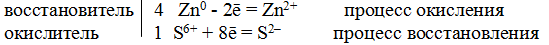что такое метод электронного баланса в химии
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Алгоритм составления ОВР методом электронного баланса » 4ЕГЭ
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl – участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).
Вы смотрели конспект урока по химии «Метод электронного баланса».
Видео
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + NH3 = Cu + N2 +H2O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
Использование онлайн-калькулятора
В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
Метод электронного баланса
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР.Для правильного уравнивания следует придерживаться определённой последовательности действий:
Теперь рассмотрим конкретный пример
N присоединяет электроны, он-окислитель
Li отдаёт электроны, он-восстановитель
6Li + N2 = 6Li +1 + 2N −3
Рассмотрим более сложный пример
В результате реакции происходит окисление атомов железа, окисление атомов серы и восстановление атомов кислорода.
Суммарно для обоих процессов можно записать так:
Fe +2 + S −2 — 7e = Fe +3 + S +4
Записываем полуреакцию для кислорода:
4*| Fe +2 + s −2 — 7e = Fe +3 + S +4
4Fe +2 + 4S −2 + 7O2 = 4Fe +3 + 4S +4 + 14O −2
Полезное
Смотреть что такое «Метод электронного баланса» в других словарях:
Химическое уравнение — Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную… … Википедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
ПОЛИГРАФИЯ — техника многократного получения одинаковых изображений (оттисков) путем переноса красочного слоя с печатной формы на бумагу или другой материал. Собственно процесс переноса изображения с печатной формы на бумагу называется печатанием. Но это… … Энциклопедия Кольера
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Электронные деньги — (Electronic money) Электронные деньги это денежные обязательства эмитента в электронном виде Все, что нужно знать об электронных деньгах история и развитие электронных денег, перевод, обмен и вывод электронных денег в различных платежных системах … Энциклопедия инвестора
система — 4.48 система (system): Комбинация взаимодействующих элементов, организованных для достижения одной или нескольких поставленных целей. Примечание 1 Система может рассматриваться как продукт или предоставляемые им услуги. Примечание 2 На практике… … Словарь-справочник терминов нормативно-технической документации
Денежно-кредитная политика — (Monetary policy) Понятие денежно кредитной политики, цели денежно кредитной политики Информация о понятии денежно кредитной политики, цели денежно кредитной политики Содержание >>>>>>>>>> … Энциклопедия инвестора
Оптовые запасы — (Wholesale Inventories) Определение оптовых запасов, торговые и складские запасы Информация об определении оптовых запасов, торговые и складские запасы Содержание Содержание Виды запасов и их характеристики Торговые и складские запасы Принципы… … Энциклопедия инвестора
Рецессия — (Recession) Содержание >>>>>>>>> Рецессия это, определение это производительности, которое характеризует нулевой или отрицательный основной показатель внутренний валовый продукт, протекающий на протяжении полугода и более … Энциклопедия инвестора
Метод электронного баланса — правила и алгоритмы уравнивания реакций
При составлении химических уравнений окислительно-восстановительных реакций удобно использовать метод электронного баланса. Алгоритм расставления коэффициентов состоит всего из шести простых пунктов. В его основе лежит закон сохранения массы веществ. При этом для сложных соединений существует возможность выполнить уравнивание на онлайн-калькуляторе.
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.
Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями. Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + NH3 = Cu + N2 +H2O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O.
Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + H2SO4 → 5 Br2 + 2MnSO4+ K2SO4 + H2O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
В итоге полным правильным уравнением будет следующая химическая формула: 2KBr + 10KMnO4 + 8H2SO4 → 5 Br2 + 2MnSO4+ 6K2SO4 + 8H2O. Полученное выражение дальше править уже не нужно. Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Использование онлайн-калькулятора
В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
Составление уравнений окислительно-восстановительных реакций
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Составление уравнений окислительно-восстановительных реакций.
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
3) Составить электронный баланс
4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
1. Составить схему реакции
2. Составить электронно-ионные уравнения
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
2. Составить электронно-ионное уравнение
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn +7 ). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Составляем уравнение реакции: