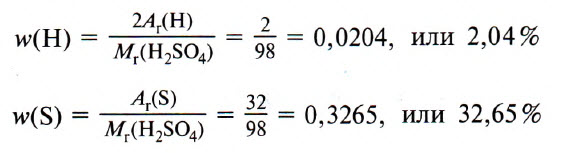что такое массовые доли элементов
Урок №13. Массовая доля химического элемента в соединении
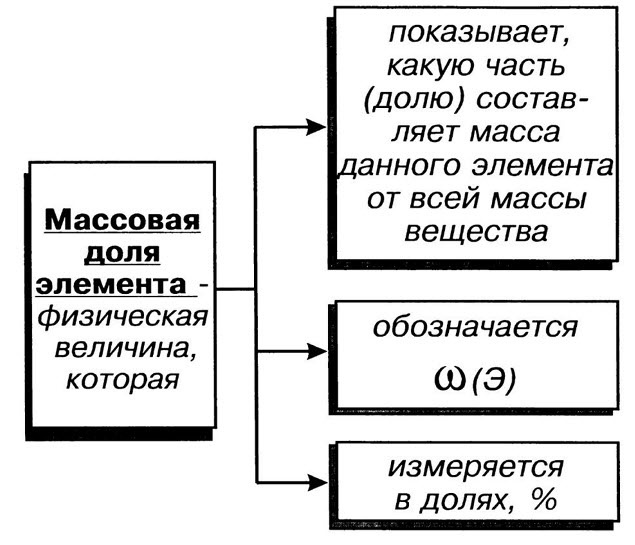
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса молекулы вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H 3 PO 4 , с точностью до сотых.
Дано :
Найти :
Решение :
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
2. Вычисляем относительную молекулярную массу соединения
Mr(H 3 PO 4 ) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w (элемента) = (n· Ar(элемента) · 100%) / Mr( молекулы )
w(H) = n(H)·Ar(H)·100% / Mr(H 3 PO 4 ) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H 3 PO 4 ) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H 3 PO 4 ) = 4·16·100% / 98 = 65,31%
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Массовая доля вещества
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
Раствор — однородная смесь различных веществ в жидком виде.
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
Масса раствора находится сложением масс компонентов, входящих в раствор
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Электронная форма учебника (ЭФУ) Химия. 8 класс включена в состав учебно-методического комплекта (УМК) по предмету Химия 8 класса Габриелян О. С. Химия. 8 класс соответствует требованиям Федерального государственного образовательного стандарта. ЭФУ рекомендована Министерством образования и науки Российской Федерации.
Итак, с теорией разобрались. Переходим к практике.
Дано: Директор школы подозревает, что один из его поваров нечист на руку и ворует сахарозу, которая предназначена для школьных завтраков. Вы работаете экспертами-криминалистами в лаборатории и для исследования вам доставили три стакана с растворами, выданными школьникам в три разных дня.
1. Сначала определяем растворитель и растворенное вещество.
В нашем случае это вода и сахароза соответственно.
2. Используя формулу (2) составляем уравнение для первого раствора.
ω (сахарозы)= m (сахарозы)/m (р-ра)*100%
х=20 (г) — сахарозы содержится в первом стакане.
3. Аналогично находим содержание сахарозы в остальных стаканах.
Ответ : В первом растворе содержится 20 граммов сахарозы, во втором 16 граммов, а в третьем всего 10 граммов. Учитывая это, можно предположить, что третий повар ворует больше всех. А вот словить его за руку – задача специалистов другого профиля.
На ферме по выращиванию крокодилов опытным путем установили, что лучше всего крокодилы развиваются в 7% растворе NaСl. Работник фермы оставил на подоконнике склянку со 100 граммами 2% раствора и склянку с 200 граммами 4% раствора. Уборщице тете Мане нужна была пустая склянка, чтобы полить цветы, и она слила растворы в одну емкость. Необходимо определить, сколько граммов NaСl нужно добавить к полученному раствору, чтобы получить 7% раствор.
Задачу лучше решать с помощью таблицы.
| 2% р-р | 4% р-р | х%р-р | 7%р-р |
| m (в-ва) | |||
| m (р-ра) | |||
| ω (в-ва) |
1. Заполняем известные данные.
100+200 = 300 г ( масса полученного раствора и масса нужного 7% раствора)
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | ||||
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
2. Используя формулу (2), рассчитываем массу вещества в 2% и 4% растворах.
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
математически преобразовываем формулу, чтобы найти неизвестное.
m (в-ва)=ω (в-ва)/100%* m (р-ра)
х=2 (г) — содержалось в первом растворе
х=8 (г) — содержалось во втором растворе
3. Определяем, сколько граммов содержится в третьем растворе
2+8=10 (г) — содержится в третьем растворе.
4. Определяем, сколько граммов NaСl должно быть в четвертом растворе.
х=21 (г) — должно содержаться в третьем растворе
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | 2 | 8 | 10 | 21 |
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
5. Определяем, сколько граммов NaСl нужно добавить в третий раствор, чтобы получить нужную концентрацию.
Ответ: 11 граммов NaСl нужно добавить в третий раствор, чтобы получить 7% концентрацию.
Массовая доля элемента
На странице «Масса атомов и молекул» мы познакомились с атомной единицей массы (а.е.м.), относительной атомной (Ar) и молекулярной (Mr) массой.
Напомним, что относительная атомная и молекулярная массы являются безразмерными величинами.
Зная относительную атомную масса элемента, относительную молекулярную массу вещества, в которое входит данный элемент, а также количество атомов этого элемента, мы можем определить массовую долю элемента в веществе.
| Массовая доля элемента ω показывает какую часть масса этого элемента составляет от всей массы вещества, в которое он входит |
Единицей измерения массовой доли элемента являются доли единиц или проценты.
Формула для определения массовой доли элемента:
В качестве примера найдём массовые доли азота и водорода в молекуле аммиака NH3.
Делаем проверку: 82,35+17,65=100%
Определение химической формулы по массовой доле
Зная массовые доли всех элементов, входящих в конкретное вещество, можно вывести химическую формулу этого вещества.
В качестве примера определим химическую формулу вещества, в котором присутствует O (48%), Ca (40%), C (12%).
Собственно, задача сводится к определению стехиометрических индексов, поскольку все элементы, входящие в вещество, нам известны.
На первом этапе записываем формулу незнакомого вещества с числовыми индексами, которые необходимо будет определить.
На втором этапе через массовые доли элементов рассчитаем соотношение числовых индексов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Что такое массовые доли элементов
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии.
3.1 Массовая доля элемента в соединении
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Массовая доля водорода в алкине CnH2n-2 составляет 12,2%. Определите число атомов углерода
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Что такое массовые доли элементов
Ключевые слова конспекта: массовая доля элемента в соединении, вычисления по химическим формулам.
Относительная атомная масса элемента ( Аr ) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная молекулярная масса ( Мr ) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Она складывается из относительных атомных масс элементов, составляющих молекулу:
Массовая доля химического элемента ( ω ) в сложном веществе показывает, какая доля от всей массы сложного вещества приходится на массу этого элемента.
Массовая доля элемента в соединении равна отношению его массы в данном веществе к относительной молекулярной массе этого вещества
Вывод химических формул,
если известны массовые доли химических элементов,
входящих в состав данного вещества
Задача. Известно, что массовые доли натрия, серы и кислорода в данном веществе соответственно составляют 29,1 %, 40,51 % и 30,38 %. Вычислите индексы в химической формуле вещества NaxSyOz
Решение. Прежде всего из условия задачи следует, что в 100 единицах массы вещества: 29,1 единицы натрия, 40,51 единицы серы и 30,38 единицы кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов; то в таком случае находим число атомов каждого элемента в 100 единицах вещества:
29,1 : 23 = 1,265 атома Na
40,51 : 32 = 1,266 атома S
30,38 : 16 = 1,899 атома О
В результате можно определить соотношение чисел атомов в формуле вещества:
х : у : z = 1,265 : 1,266 : 1,899
Чтобы получить соотношения целых чисел; разделим все числа атомов на наименьшее из них (на 1,265):
1 : 1 : 1,5
Для того чтобы количество атомов кислорода было выражено целым числом; полученные числа атомов умножаем на два:
х : у : z = (1 • 2) : (1 • 2) : (1,5 • 2) = 2 : 2 : 3
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества — Na2S203.
Конспект урока «Массовая доля элемента в соединении».






m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
_m.jpg)
_0.jpg)
_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)
_5.jpg)