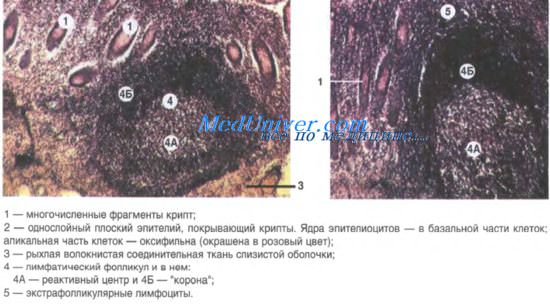
что такое лимфоидный фолликул в слизистой оболочке
Что такое лимфоидный фолликул в слизистой оболочке
Имеется вариабельность в строении лимфатических узлов из различных анатомических областей. Для лимфатических узлов шеи характерна типичная структура фолликулов, паракортикальной зоны, мозгового вещества и синусов. Подмышечные лимфатические узлы в состоянии покоя имеют вид ободка лимфоидной ткани вокруг жировой ткани в центре.
При злокачественных лимфомах и других лимфопролиферативных состояниях эта жировая ткань заселяется опухолевыми клетками и может полностью исчезнуть. Брыжеечные лимфатические узлы имеют более широкие синусы и обычно менее заметные фолликулы и паракортикальную зону.
Лимфоидные фолликулы отвечают за Т-зависимое образование антител. Они являются местом образования различных антител и переключения изотипов. Первичные фолликулы построены из малых В-клеток, несущих на поверхности IgM и IgD, и фолликулярных дендритных клеток. Если рассечь вторичный фолликул в области полюса, не затрагивая центр размножения, он будет выглядеть как первичный фолликул.
Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность, выражающуюся в формировании темной зоны из бластных клеток (из-за выраженной базофилии цитоплазмы при окрашивании по Гимза) и светлой зоны из центроцитов. В клетках темной зоны выявляются многочисленные митозы и высокая степень пролиферации; во многих клетках могут определяться признаки апоптоза.
Обычно полярность фолликулов лучше видна в лимфоидных фолликулах слизистых оболочек (таких как слизистая миндалины) и лимфатических узлах.
В-клетки центра размножения не экспрессируют BCL-2 и, таким образом, подвержены апоптозу. Допускается, что только В-клетки, обеспечивающие хорошую аффинность антител, реэкспрессируют BCL-2 и выживают. Апоптозу подвергается значительная доля В-клеток фолликулярных центров, которые захватываются макрофагами центра (макрофаги «окрашенных телец»).
Центр размножения окружен мантийной зоной, состоящей из малых В-лимфоцитов с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных фолликулах. В-клетки маргинальной зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Часто такие клетки обнаруживаются в брыжеечных узлах, но обычно не заметны в других местах. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК).
ФДК захватывают и удерживают иммунные комплексы на своей поверхности для презентации В- и Т-клеткам. ФДК имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются в срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Эти отростки также выявляются окрашиванием на CD21 и CD23.
Центры размножения с обратным развитием часто содержат интерстициальное эозино-фильное протеиногеннос вещество. Иногда в центрах роста реактивных лимфатических узлов обнаруживаются плазматические клетки. Лимфоидные фолликулы содержат различное число малых Т-клеток, многие из которых экспрессируют CD3, CD4 и CD57.
Что такое лимфоидный фолликул в слизистой оболочке
Более часто встречающаяся лимфоретикулосаркома обычно поражает идеоцекальную область, характеризуется протяженным подслизистым ростом. При эндоскопическом исследовании слизистая оболочка как бы натянута на подслизистые узлы (валики), цвет ее обычный или же она отечна, инфильтрирована, изъязвлена за счет сдавления. При ощупывании биопсийными щипцами или концом эндоскопа отмечается значительная плотность этих образований. При биопсии слизистая оболочка не тянется за щипцами, отрывается от подлежащих слоев.
Лимфофолликулярная гиперплазия. Это своеобразное поражение подслизистого аппарата толстой и тонкой кишки. Иногда в процесс могут вовлекаться все органы пищеварительного тракта, а также подкожные лимфатические узлы и лимфатические узлы органов брюшной полости, в первую очередь брыжейки.
Практически у всех детей, которым проводилась илеоскопия, независимо от заболевания толстой кишки обнаружена лимфофолликулярная гиперплазия подвздошной кишки, границы которой иногда не удавалось установить. Это позволяет считать локальную лимфофолликулярную гиперплазию тонкой кишки без сопутствующих изменений слизистой оболочки и стенки кишки одним из вариантов нормы. В тех случаях, когда лимфофолликулярная гиперплазия захватывает значительные участки тонкой кишки и сопровождается выраженными воспалительными изменениями слизистой оболочки или стенки кишки, она может сопровождаться разнообразными клиническими проявлениями (повышение температуры тела, значительное снижение массы тела, кровотечения, гипоальбуминемия и т. д.).
Больной 11 мес был обследован по поводу стойкой анемии, не поддающейся лечению. Реакция кала на скрытую кровь была стойко положительной. Во время колоноилеоскопии выявлена массивная лимфофолликулярная гиперплазия терминального отдела подвздошной кишки. Лимфоидные фолликулы были слиты в группы, поверхность над ними местами эрозирована. Диагноз: лимфофолликулярная гиперплазия подзвдошной кишки, терминальный илеит. Произведена резекция илеоцекального отдела. Диагноз подтвержден. Наблюдается после операции в течение 3 лет. Практически здоров.
Лимфатический аппарат терминального отдела подвздошной кишки является одним из участков иммунной защиты организма, что позволяет провести определенную аналогию с состоянием миндалин у детей.
Гипертрофия лимфоидной ткани может быть следствием острой и хронической респираторной инфекции, глистной инвазии, лямблиоза и т. д., поэтому после полного клинического обследования ребенка лечение должно быть патогенетически обоснованным.
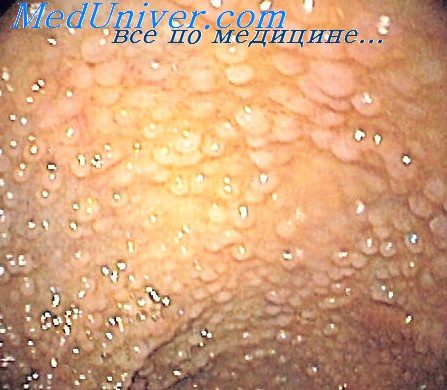
Обычно при эндоскопии находят круглые, с ровными контурами, диаметром 1-3 мм образования, располагающиеся в подслизистом слое и просвечивающие сквозь слизистую оболочку. Просвет кишки обычно не сужен, стенка эластична, сосудистый рисунок не изменен. При биопсии слизистая оболочка подвижна и лимфоидные образования легко смещаются относительно подлежащих слоев. Если наряду с лимфофолликулярной гиперплазией имеются воспалительные изменения слизистой оболочки, а лимфоидные фолликулы представляют собой пакеты или продольные цепочки, деформирующие просвет кишки, покрытые инфильтрированной слизистой оболочкой и плохо смещающиеся относительно подслизистого слоя, то можно предполагать колит или энтерит.
— Вернуться в оглавление раздела «Хирургия»
Нодулярная лимфоидная гиперплазия (НЛГ)
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
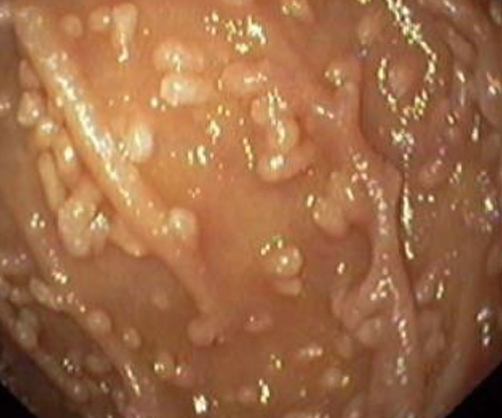
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии

Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желе
Abstract. Gastritis is a reaction of the mucous membrane (MM) of the stomach to damage and is characterized by the formation of inflammatory, dystrophic and dysregenerative changes in the MM of the stomach, as well as atrophy of epithelial cells with replacement of normal glands with fibrous tissue. The progression of chronic gastritis (CG) is accompanied by the development of MM atrophy, dysplasia and becomes a significant factor in the formation of gastric malignant neoplasms. The article presents the modern etiological classification of CG, approaches to the diagnosis of CG, assessing the stage of gastritis on a scale of progressive increase in the likelihood of developing stomach cancer, presents the histological characteristics, and also substantiates etiopathogenetic approaches to the treatment of various forms of CG, including methods for optimizing the eradication therapy of H. pylori infection. which can be used to increase the effectiveness of not only standard triple therapy, but also other anti-Helicobacter treatment regimens. The use of proton pump inhibitors in the treatment of gastritis is considered. For citation: Dolgalev I. V., Kareva E. N., Lyalyukova E. A. Chronic gastritis: from histological protocol to substantiation of etiopathogenetic therapy // Lechaschy Vrach. 2021; 2 (24): 30-34. DOI: 10.26295/OS.2021.76.84.006
Резюме. Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Прогрессирование хронического гастрита (ХГ) сопровождается развитием атрофии, дисплазии СО и становится значимым фактором формирования злокачественных новообразований желудка. В статье приводятся современная этиологическая классификация ХГ, подходы к диагностике ХГ, оценке стадии гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка, представлены гистологические характеристики, а также обоснованы этиопатогенетические подходы к терапии различных форм ХГ, включая методы оптимизации эрадикационной терапии инфекции H. pylori, которые могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения. Рассмотрено примение ингибиторов протонной помпы в терапии гастрита.
Хронический гастрит (ХГ) – широко распространенное заболевание пищеварительной системы, регистрируемое у 15-30% населения в различных популяциях и составляющее 80-85% всех заболеваний желудка 1. Медико-социальная значимость проблемы заключается в том, что прогрессирование ХГ сопровождается развитием атрофии, дисплазии слизистой оболочки (СО) и становится значимым фактором формирования злокачественных новообразований желудка [4, 5].
Целью данного обзора было представить гистологическую характеристику и обосновать этиопатогенетические подходы к терапии различных форм ХГ.
Дефиниции
Гастрит представляет собой реакцию СО на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Развитие этого заболевания сопровождается нарушением секреторной и моторной функций желудка.
К настоящему времени сложилось устойчивое мнение о том, что диагноз гастрита должен быть верифицирован морфологически. Основным гистологическим признаком заболевания являются инфильтрация собственной пластинки воспалительными клетками и структурные изменения железистого аппарата слизистой желудка [5]. При гистологическом исследовании гастрит подтверждается наличием нейтрофилов или мононуклеарных клеток 2-й степени по крайней мере в одном участке биопсии желудка либо нейтрофилов или мононуклеарных клеток 1-й степени по меньшей мере в двух участках [6]. Воспалительный инфильтрат представлен лимфоцитами, плазматическими клетками, гистиоцитами и гранулоцитами, расположенными диффузно или в виде скоплений в собственной пластинке СО, иногда – внутри желез. Активность воспалительного процесса определяется степенью инфильтрации полиморфноядерными лейкоцитами (нейтрофилами и ацидофильными гранулоцитами) собственной оболочки (lamina propria) слизистой желудка [7].
Международная группа патологов Оперативного звена для оценки гастрита (Operative Link for Gastritis Assessment – OLGA) предложила интегральный метод оценки выраженности морфологических изменений СО желудка и стандартизировала гистологические фенотипы по степени и стадии развития (OLGA Staging System) 9. Локализация нейтрофилов определяет степень: нейтрофилы в собственной пластинке оболочки – легкая (+-) активность; нейтрофилы в эпителии – умеренная (++-) активность и нейтрофилы в просвете железы – выраженная (+++) активность.
Прогрессирование заболевания сопровождается замещением собственных железистых структур lamina propria фиброзной тканью (неметапластическая атрофия) или заменой желез метапластическими железами. Метапластическая атрофия может иметь два фенотипа: кишечная метаплазия (КМ), поражающая слизистые железы, и псевдопилорическая метаплазия, которая также известна как метаплазия псевдопилорических желез. Система позволяет оценить стадию гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка – риск от самого низкого (стадия 0) до самого высокого (стадия IV). Таким образом, под степенью гастрита подразумевается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии. Такая система дает достаточно полную характеристику гастрита и отражает его динамику.
Альтернативная система определения стадии заболевания (Operative Link on Gastric Intestinal Metaplasia Assessment – OLGIM) предлагает рассматривать только КМ для оценки атрофии [9]. Различение неатрофического и атрофического гастрита необходимо, чтобы получить информацию о том, за какими пациентами требуется клиническое/эндоскопическое наблюдение.
Этиология ХГ
Современная этиологическая классификация ХГ была предложена в 2015 г. на Международном консенсусе в Киото (Япония) [12].
С учетом этиологического фактора различают следующие формы гастрита:
I. Аутоиммунный ХГ (АИГ) (этиология неизвестна; аутоиммунный патогенез).
II. Инфекционный ХГ.
III. Экзогенный ХГ (лекарственный, алкогольный, радиационный, вызванный химическими веществами).
IV. ХГ, вызванный воздействием специфических причин (лимфоцитарный, гигантский гипертрофический (болезнь Менетрие), аллергический, эозинофильный).
V. Вторичный ХГ, вызванный другими заболеваниями (при саркоидозе, васкулитах, болезни Крона).
Аутоиммунный хронический гастрит
В общей популяции встречается нечасто – менее чем в 1% случаев, а среди больных ХГ – до 5% [13]. Заболевание вызывает поражение фундального отдела и тела желудка. АИГ является наследственно обусловленным и передается как аутосомно-доминантный признак, часто сочетаясь с другими аутоиммунными заболеваниями (сахарным диабетом 1 типа, тиреоидитом Хашимото, синдромом Шегрена) [14]. Патогенетически это аутоиммунная патология, связанная с наличием антител, направленных против париетальных клеток желудка и их компонентов (внутренний фактор и протонная помпа) с формированием атрофии СО желудка. Прогрессивное снижение количества париетальных клеток приводит к гипохлоргидрии вплоть до анацидного состояния. Снижение синтеза соляной кислоты стимулирует G-клеточную гиперплазию и таким образом способствует повышению уровня гастрина в сыворотке крови. В свою очередь гипергастринемия создает условия для гиперплазии энтерохромаффиноподобных клеток, которые иногда трансформируются в злокачественную опухоль желудка [15]. Относительный риск развития аденокарциномы желудка у этих больных возрастает в 3 раза [16]. Снижение образования внутреннего фактора приводит к мальабсорбции витамина В12 и его дефициту в организме, что может стать причиной пернициозной (мегалобластной) анемии, а также множественных неврологических расстройств (фуникулярный миелоз) [15].
Типичные гистологические паттерны аутоиммунного гастрита 16
Другие гистологические паттерны
ХГ, ассоциированный с инфекцией H. pylori
Инфекция H. pylori – наиболее частая причина развития ХГ. Заболевание первоначально развивается как хронический активный гастрит, при котором H. pylori обнаруживается как в антральном отделе, так и в теле желудка (обычно в большем количестве в антральном отделе). Длительно сохраняющийся активный гастрит, ассоциированный с H. pylori, создает условия для развития вторичной атрофии СО желудка. Так, по результатам 10-летнего проспективного наблюдения больных хеликобактерным активным гастритом, атрофия выявлена у 6% пациентов через 2 года, у 22% – через 4 года, у 34% – через 6 лет и у 43% – через 10 лет наблюдения, при этом в группе контроля (Нр-негативные) атрофия не развивалась [19].
Гистология процесса представлена следующим образом: полиморфноядерные лейкоциты инфильтрируют собственную пластину, железы и фовеолярный эпителий, образуя небольшие микроабсцессы. Наблюдаются лимфоидные агрегаты и лимфоидные фолликулы, расширяющие собственную пластинку СО, иногда лимфоциты проникают в эпителий. Инфекция H. pylori – основная причина вторичной атрофии СО желудка. Атрофические изменения (как метапластические, так и неметапластические) в образце биопсии из угла и антрального отдела в первую очередь следует рассматривать как доказательства хеликобактерного гастрита. На поздних стадиях атрофии, связанной с хронической инфекцией H. pylori, как в теле, так и в антральном отделе наблюдается обширное замещение КМ, связанной с развитием гипохлоргидрии. По мере распространения КМ количество бактерий H. pylori, обнаруживаемых в желудке, уменьшается, так как H. pylori исчезает из участков метапластического эпителия. Особое значение этой проблеме придает то, что атрофический гастрит является начальной ступенью каскада изменений СО, приводящего к злокачественному новообразованию желудка (каскад Корреа) [20]. Вероятность развития рака желудка возрастает по мере нарастания тяжести атрофии слизистой, и этот риск находится в прямой зависимости от степени атрофических изменений, выявляемых в антральном отделе и в теле желудка, в особенности при наличии метаплазии [21]. Длительное течение гастрита, ассоциированного с H. pylori, повышает вероятность развития злокачественной опухоли желудка в 6 раз [21].
Типичные гистологические паттерны
Варианты гистологических паттернов
Последствия
Цитомегаловирусный (ЦМВ) гастрит
Единственная вирусная инфекция желудка с отчетливой патологической картиной. Преимущественно поражает детей и пациентов с ослабленным иммунитетом. Обычно поражаются разные участки желудочно-кишечного тракта. Эндоскопически СО желудка может выглядеть полностью нормальной или иметь эрозии и язвы. В редких случаях это может быть образование, называемое псевдоопухолью. Гистологически многочисленные включения ЦМВ в эпителиальных клетках можно увидеть реже, чем в эндотелиальных, а также в макрофагах с незначительным воспалением или его отсутствием. В этом случае иммунологический статус пациентов обычно сильно подавлен. В других случаях может наблюдаться обильная грануляционная ткань с серьезной воспалительной реакцией, в то время как включения ЦМВ трудно увидеть без методов иммуногистохимии или гибридизации in situ. Эозинофильные инфильтраты также могут быть важным компонентом воспаления при ЦМВ-гастрите [7].
Гастрит, вызванный лекарственными средствами; алкогольный гастрит; лучевой гастрит, рефлюкс-гастрит
Химические агенты увеличивают обновление эпителия желудка, что приводит к фовеолярной гиперплазии. Эти состояния часто протекают бессимптомно, но они могут привести к множественным эрозиям или язвам, даже с кровотечением. Атрофические изменения встречаются редко [7].
Диагноз основан на микроскопическом исследовании СО желудка, и, согласно существующему определению, основным его признаком является наличие не менее 25 интра-эпителиальных лимфоцитов на 100 эпителиальных клеток желудка. Большинство этих лимфоцитов имеют фенотип CD3+ и CD8+. Известно, что инфекция H. pylori связана с ЛГ, достигая от 0% до 27% случаев. Связь между ЛГ и глютеновой болезнью установлена и колеблется от 10% до 38% [7].
Эозинофильный гастрит (ЭГ)
Является частью семейства эозинофильных желудочно-кишечных расстройств, которое включает эозинофильный эзофагит, эозинофильный гастроэнтерит и эозинофильный энтерит/колит, связанные с триггерами пищевых аллергенов. У многих пациентов в анамнезе были атопические состояния, включая астму, аллергический ринит или атопический дерматит, а также аллергию на лекарственные продукты или пыльцу. Рекомендованы два основных критерия диагностики ЭГ: 1) в биоптате желудка средняя плотность эозинофилов > 127/мм 2 (или > 30 эозинофилов/поле высокого увеличения (HPF) на микроскопах, оснащенных широкоугольными окулярами (FN 22), по крайней мере в пяти отдельных HPFs); 2) отсутствие известных ассоциированных причин эозинофилии (например, инфекция H. pylori, болезнь Крона, паразитарные инфекции, а также гематологические или лимфоидные нарушения) [7].
Диагностика ХГ
Диагностика ХГ включает клиническое обследование, cерологическое исследование (пепсиногены и антитела против инфекционных агентов и/или аутоантигены), эндоскопию верхних отделов желудочно-кишечного тракта (с применением стандартизированных протоколов биопсии) и последующее гистологическое исследование. Гистологическое изучение биоптата является «золотым стандартом» в диагностике заболевания. Прицельная биопсия из пяти мест: антральный отдел, большая (А1) и малая кривизна (А2), угол (А3) и тело желудка, большая (С1) и малая кривизна (С2).
Стандартизация морфологических признаков ХГ нашла отражение в полуколичественных системах гистологической классификации гастритов, которые были заложены Сиднейской системой (Sydney Systems, 1990) и получили дальнейшее развитие в Хьюстонской модифицированной классификации (1994) и системах OLGA и OLGIM (2008) 22.
Подходы к терапии отдельных форм ХГ
Своевременная диагностика и верное определение классификационной группы ХГ имеют основополагающее значение для успешного лечения этого заболевания.
Особенности АИГ зависят от стадии, наличия инфекции H. pylori, текущего дефицита питательных веществ, сопутствующих аутоиммунных состояний и риска злокачественной трансформации. Так как инфекция H. pylori может играть решающую роль в патогенезе АИГ, необходим скрининг на H. рylori пациентов с диагностированным АИГ, атрофией желудка, КМ/дисплазией и гипо- или ахлоргидрией. При положительном результате на H. pylori пациенты нуждаются в последующем лечении. Исследования подтверждают, что эрадикация H. pylori была связана со снижением уровней антител к париетальным клеткам и антител против внутреннего фактора на ранних стадиях AИГ.
Пероральный прием витамина B12, железа и фолиевой кислоты рекомендуется на ранних стадиях АИГ. При появлении неврологических симптомов следует назначать витамин B12 парентерально.
Поскольку различные аутоиммунные заболевания признаются сопутствующими AИГ, необходимо уделять внимание их скринингу и последующему лечению.
Тактика лечения AИГ с предотвращением осложнений требует надлежащего длительного наблюдения в соответствии с текущими симптомами, серологическими результатами и данными визуализации. Для этого необходим правильный мониторинг показателей – один раз в год (общий анализ крови, уровень гастрина, железа и витамина B12) [25, 26].
ХГ, вызванный Н. pylori, в том числе у «бессимптомных» лиц, является показанием к проведению эрадикационной терапии инфекции Н. pylori. Эрадикация способствует излечению хронического неатрофического гастрита, может привести к регрессии атрофического гастрита и снижает риск развития рака желудка у пациентов с неатрофическим и атрофическим гастритом. Эрадикация H. pylori у пациентов с КМ тяжелой степени, судя по всему, не приводит к существенному снижению риска развития рака желудка, как минимум в краткосрочной перспективе, однако обеспечивает снижение выраженности воспаления и атрофии, и у таких пациентов следует рассмотреть возможность ее проведения [27].
В России терапией первой линии эрадикации служит стандартная тройная терапия, включающая ИПП, кларитромицин и амоксициллин. Стандартную тройную терапию следует проводить, применяя различные меры, повышающие ее эффективность. Среди методов оптимизации, позволяющих повысить эффективность эрадикационной терапии инфекции H. pylori, следует отметить увеличение продолжительности лечения до 14 дней, выбор надежного ИПП или увеличение дозы ИПП, добавление висмута трикалия дицитрата или пробиотика. В качестве альтернативного варианта эрадикационной терапии первой линии может быть использована классическая четырехкомпонентная схема на основе висмута трикалия дицитрата или без препаратов висмута, которая включает ИПП, амоксициллин, кларитромицин и метронидазол. Квадротерапию с висмута трикалия дицитратом применяют также как основную схему терапии второй линии при неэффективности стандартной тройной терапии. Другая схема второй линии включает ИПП, левофлоксацин и амоксициллин. Тройная терапия с левофлоксацином может быть назначена только гастроэнтерологом по строгим показаниям. Терапию третьей линии подбирают индивидуально в зависимости от предшествующих схем лечения.
Методы оптимизации эрадикационной терапии инфекции H. pylori могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения, а комбинирование этих методов позволяет добиться наилучшего результата у конкретного пациента [28].
Эрадикация H. pylori позволяет купировать симптомы диспепсии и активность гастрита.
Если все варианты терапии исчерпаны, обычное лечение будет направлено на снижение секреции кислоты СО желудка и защиту слизистого барьера.
В клинической практике кислая среда в желудке играет решающую роль в развитии гастрита, вызванного H. рylori, и ассоциированных с ним симптомов диспепсии, поэтому ИПП являются важной стратегией лечения пациентов с симптоматическим гастритом [29].
Кислотообразующая АТФаза, известная как АТФаза вакуо-лярного типа, помимо париетальных клеток имеется также в лизосомах лейкоцитов, и на ее активность тоже влияют ИПП [31]. Противовоспалительный эффект ИПП включает торможение хемотаксиса и дегрануляции нейтрофилов, взаимодействие нейтрофилов с эндотелиоцитами, выработку нейтрофилами свободных радикалов [32]. Противовоспалительная активность ИПП подтверждена результатами клинических и экспериментальных исследований. В частности, в экспериментальном исследовании было оценено влияние омепразола на адгезивную активность нейтрофилов, стимулированную H. pylori. Адгезия нейтрофилов увеличивалась за счет присутствия H. рylori, тогда как введение ИПП (омепразола), напротив, значительно снижало адгезию дозозависимым образом [31].
Использование авторадиографии позволило выявить накопление 3H-лансопразола в цитоплазматических гранулах нейтрофилов, инфильтрирующих СО желудка. За счет повышения внутривакуолярного уровня pH в лизосомах нейтрофилов, ИПП ослабляют активацию нейтрофилов и высвобождение ими токсичных метаболитов [33].
В исследованиях in vivo было показано, что омепразол (1-100 мкМ) дозозависимо увеличивал рН в лизосомах, ингибировал подвижность активированных нейтрофилов, подавлял выработку ими токсичных продуктов и снижал работу лизосомальных ферментов. У здоровых добровольцев, которым вводили омепразол в дозе 40 мг/сут в течение 7 дней, выявлено значительное снижение хемилюминисценции (отражающей активности) периферических нейтрофилов [34].
Учитывая, что длительное воспаление в СО желудка сопряжено с повреждением ДНК и риском канцерогенеза, своевременное и эффективное лечение гастрита, особенно на ранних его стадиях, является важным аспектом канцеропревенции в гастроэнтерологии.
Таким образом, не вызывает сомнений тот факт, что класс ИПП является наиболее востребованным при лечении кислотозависимых заболеваний с позиции доказательной медицины. Согласно реестру Сomcon (2020) [35], омепразол занимал и продолжает занимать лидирующие позиции в назначениях докторов и полностью отвечает критериям эффективности и безопасности при лечении кислотозависимых заболеваний [36].
Среди препаратов омепразола, представленных на российском фармацевтическом рынке, одним из самых изученных и надежных, а также известных [37] является Омез®. Полный цикл производства лекарственного препарата Омез® соответствует международным стандартам GMP [сертификат, подтверждающий производство Омеза по стандартам GMP], что обеспечивает высокое качество препарата и достижение должного уровня рН в желудке у пациентов, необходимого для кислотосупрессии. Омез® включен в Оранжевую Книгу FDA с терапевтической эквивалентностью категории «А», что подтверждает его качество на мировом уровне и идентичность оригинальному омепразолу [38].
Сравнительное исследование по оценке эффективности генериков омепразола, назначаемых в течение 7 дней в параллельных группах (в одной из которых использовали ИПП Омез®, в других – небрендированные омепразолы разного производства), показало, что уровень кислотосупрессии желудка достоверно выше на фоне применения Омез® в дозе 20 мг 2 раза в сутки. Использование других генериков омепразола в приведенном исследовании не приводило к целевому снижению уровня кислоты в желудке, что очевидно отражает их потенциальную клиническую неэффективность. Полученные различия могут быть связаны как с качеством субстанции, так и различиями лекарственных форм. Все молекулы ИПП являются кислотонеустойчивыми, и потому для сохранения действующего вещества в нативном виде для всасывания в кровь в кишечнике абсолютно необходимо защитить молекулу от кислоты. Для этого в лекарственной форме имеется кишечнорастворимая оболочка. Из капсулы Омез®, которая растворяется в желудке, высвобождаются гранулы (пеллеты), покрытые кишечнорастворимой оболочкой (MUPS – multi-unit pellet system). Пеллеты правильной формы и одинакового размера, который позволяет им смешаться с химусом и без задержек отправиться в тонкую кишку. Здесь происходит растворение оболочки, выход омепразола в жидкую среду и абсорбция его энтероцитами. Этот процесс должен происходить дружно, и пик концентрации омепразола должен совпасть с пиком активации протонных насосов (для этого обязательно принять пищу через 30 мин после приема препарата ИПП), только в активированном состоянии они доступны для связывания и блокады. Очевидно, что оптимизация лекарственных форм отражается на клинической эффективности препаратов. Но это статья расходов, на которой дженериковые компании зачастую экономят. Поэтому при выборе медикаментозной кислотосупрессивной терапии следует учитывать потенциальные возможности лекарственных препаратов, ориентируясь на должный уровень эффективности [39].
Омез® – один из немногих препаратов омепразола, имеющих форму выпуска – капсулы 40 мг. Пациентам с низкой приверженностью к терапии можно рекомендовать Омез® 40 мг 1 раз в сутки за 30 минут до завтрака [40]. Эта доза является оптимальной и для быстрых метаболизаторов. Еще одним несомненным достоинством препарата является его доступная цена при высоком качестве субстанции и уникальной лекарственной форме, что дает возможность в сложившихся социально-экономических условиях поддерживать на высоком уровне качество жизни большого числа больных кислотозависимыми заболеваниями.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ВО Сибирский ГМУ Минздрава России, Томск, Россия
** ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, Москва, Россия
*** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
**** ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
***** ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва, Россия
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии/ И. В. Долгалёв, Е. Н. Карева, Е. А. Лялюкова, Н. В. Павлова
Для цитирования: Долгалёв И. В., Карева Е. Н., Лялюкова Е. А., Павлова Н. В. Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии // Лечащий Врач. 2021; 2 (24): 30-34.
Теги: хеликобактерная инфекция, слизистая оболочка, дисплазия, факторы риска