что такое культуральная жидкость
Культуральная жидкость повышает качество белка в колбасе
ВЛИЯНИЕ КУЛЬТУРАЛЬНОЙ ЖИДКОСТИ ПРОПИОНОВОКИСЛЫХ БАКТЕРИЙ НА АМИНОКИСЛОТНЫЙ СОСТАВ ВАРЁНЫХ КОЛБАС
Немного о культуральной жидкости
Было установлено, что в культуральной жидкости, побочном продукте, получаемом при производстве концентратов пропионовокислых бактерий (ПКБ), накапливается значительное количество ценных метаболитов.
Культуральная жидкость (culture broth) [лат. cultus — возделывание, обрабатывание] — жидкая среда, получаемая при культивировании различных про- и эукариотических клеток in vitro и содержащая остаточные питательные вещества и продукты метаболизма этих клеток. Т.к. речь идет о пробиотических микроорганизмах (прокариотах), то культуральная жидкость, в нашем случае – это жидкость, содержащая остаточные клетки пропионовокислых бактерий и продукты их жизнедеятельности, которая выходит из ферментера в виде водной суспензии, для которой характерно, как правило, невысокая концентрация основного компонента (микробной биомассы) и наличие многих примесных веществ.
Культуральные жидкости бывают разными, и если растворенные в них метаболиты не представляют практической ценности, то жидкую фазу не перерабатывают. Ее считают жидким отходом производства и направляют на очистные сооружения, где инактивируются все содержащиеся в ней органические соединения.
ОБ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЯХ
В статье приведены результаты экспериментальных исследований влияния культуральной жидкости пропионовокислых бактерий на аминокислотный состав вареных колбас. Установлено, что введение в рецептуру вареных колбас дезинтегрированной культуральной жидкости позволит повысить их биологическую ценность.
Введение
В составе пробиотических заквасочных культур, бактериальных концентратов и микробной биомассы для производства пробиотических мясных продуктов и биологически активных добавок к пище широко используются отдельные штаммы (или консорциумы штаммов), принадлежащие к роду Propionibacterium spp [1].
Пропионовокислые бактерии характеризуются хорошо развитой биосинтетической способностью и как представители прокариот способны синтезировать все аминокислоты, входящие в состав клеточных белков. Одной из важнейших функций аминокислот является их участие в синтезе белков, выполняющих каталитические, регуляторные, запасные, структурные, транспортные, защитные и другие функции.
Современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
На российском рынке колбасных изделий особое место занимают вареные колбасы, пользующиеся стабильным спросом населения. С учетом того, что доля вареных колбас составляет 60–70 % колбасного производства, представляется актуальным совершенствование технологии их производства. Учитывая, что при формировании специфического вкуса и аромата колбасных изделий исключительную функцию играют как сами аминокислоты, так и продукты их различных превращений, представляет интерес изучение количественного и качественного состава кислот.
В данной статье представлены результаты исследования влияния культуральной жидкости пропионовокислых бактерий на аминокислотный состав вареных колбас.
Материалы и методы исследований
В качестве материала исследований служила культуральная жидкость пропионовокислых бактерий P. Freudenreichii subsp. Shermani АС-2503 (полученных из фонда Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов, Москва). Пропионовокислые бактерии предварительно активизировали разработанным ранее методом и выращивали на сывороточной среде с добавлением ростовых компонентов. Предварительная активизация и подобранная среда культивирования способствовали получению максимального количества клеток. Для исследований использовали КЖ, полученную после отделения биомассы и подвергнутую дезинтеграции ультразвуком.

Полученные результаты исследований статистически обработаны с использованием пакета стандартных программ (р
Результаты и их обсуждение
На первом этапе был изучен аминокислотный состав культуральной жидкости. Результаты исследований представлены в табл. 1.
В результате анализа количественного и качественного аминокислотного состава КЖ идентифицировано 16 аминокислот суммой 0,692 г/л, в том числе 6 незаменимых (0,286 г/л).
Относительно группы незаменимых аминокислот следует отметить отсутствие ароматических кислот – триптофана и фенилаланина, а содержание условно незаменимой кислоты тирозина составляет 0,049 г/л.
На долю комплекса трех аминокислот с разветвленной цепью, действующих совместно (валин, лейцин и изолейцин), приходится 65 % суммы незаменимых аминокислот. При этом лейцин занимает лидирующее положение не только в данном комплексе, но и среди всех обнаруженных аминокислот.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
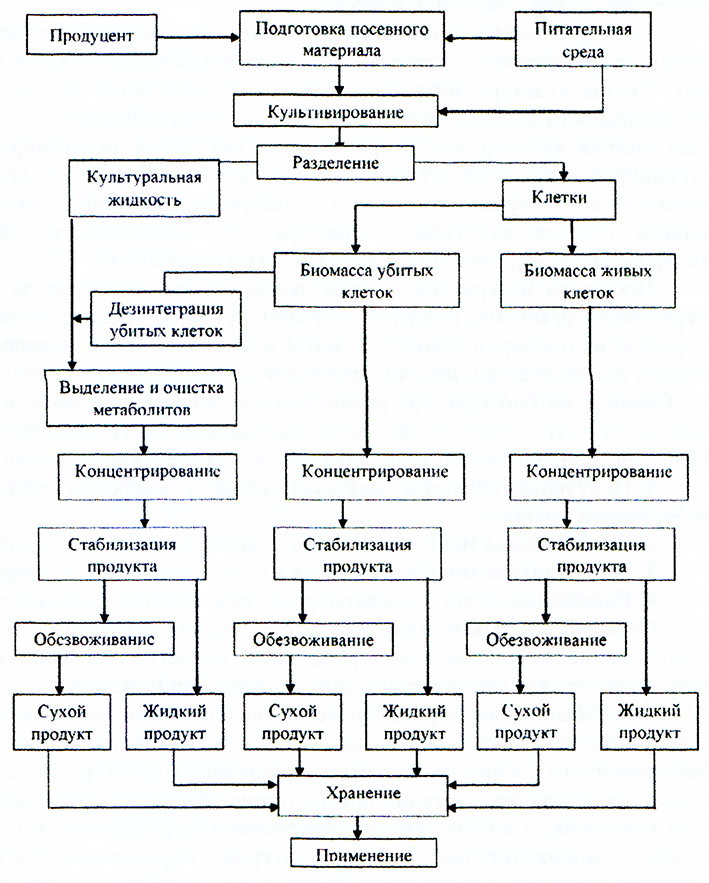
4.4. ОБЩАЯ БИОТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА ПРОДУКТОВ МИКРОБНОГО СИНТЕЗА
Большое разнообразие биотехнологических процессов, нашедших промышленное применение, приводит к необходимости рассмотреть общие, наиболее важные проблемы, возникающие при создании любого биотехнологического производства. Процессы промышленной биотехнологии разделяют на 2 большие группы: производство биомассы и получение продуктов метаболизма. Однако такая классификация не отражает наиболее существенных с технологической точки зрения аспектов промышленных биотехнологических процессов. В этом плане необходимо рассматривать стадии биотехнологического производства, их сходство и различие в зависимости от конечной цели биотехнологического процесса.
На рисунке 15 представлена принципиальная биотехнологическая схема производства продуктов микробного синтеза.
Принципиальная биотехнологическая схема производства продуктов микробного синтеза
Существует 5 стадий биотехнологического производства.
Две начальные стадии включают подготовку сырья (1) и биологически действующего начала (2). В процессах инженерной энзимологии они обычно состоят из приготовления раствора субстрата с заданными свойствами (рН, температура, концентрация) и подготовки партии ферментного препарата данного типа, ферментного или иммобилизованного. При осуществлении микробиологического синтеза необходимы стадии приготовления питательной среды и поддержания чистой культуры, которая могла бы постоянно или по мере необходимости использоваться в процессе. Поддержание чистой культуры штамма-продуцента — главная задача любого микробиологического производства, поскольку высокоактивный, не претерпевший нежелательных изменений штамм может служить гарантией получения целевого продукта с заданными свойствами.
Каждый конкретный вид микроорганизмов, используемых в биотехнологии, строго избирателен к питательным веществам. Потребность микроорганизма в тех или иных соединениях определяется физиологическими особенностями данного вида микроба, но во всех случаях среда должна быть водным раствором этих веществ и обеспечивать в определенном количестве их приток в клетку.
В самом приближенном виде физиологические потребности микроорганизма в питательных веществах можно выявить, определив химический состав микробной клетки.
Культуры микроорганизмов-продуцентов заводы получают из коллекций в пробирках на агаризованных питательных средах или в ампулах. Чистая культура микроорганизма может постоянно или по мере необходимости использоваться в производстве. При длительном хранении чистых культур могут происходить случайные нерегулируемые мутации. Во избежание мутаций следует не только соблюдать правила хранения и поддержания исходной культуры, но и периодически проводить пересев культуры и проверку ее однородности как по морфологическим, так и по физиологическим признакам.
Посевным материалом — инокулятом — называют чистую культуру микроорганизма, которую получают путем ее последовательного пересева из пробирки в колбу, а затем в аппараты увеличивающегося объема до количества, необходимого для промышленного производства. Сначала чистую культуру размножают в лаборатории, затем в цехе чистых культур и инокуляции, далее направляют на культивирование. Приготовление посевного материала состоит из следующих стадий.
Передачу чистых культур из одного аппарата в другой осуществляют в конце логарифмической фазы роста. Качество полученного посевного материала контролируют путем микроскопирования.
Третья (3) стадия — стадия ферментации, на которой происходит образование целевого продукта. На этой стадии идет микробиологическое превращение компонентов питательной среды сначала в биомассу, затем, если это необходимо, в целевой метаболит.
Для культивирования микроорганизмов в промышленных масштабах применяют ферментеры (ферментаторы) — реакционные емкости, в которых при определенных условиях находятся микроорганизмы. Основное назначение ферментатора — своевременно обеспечить микробные клетки необходимыми питательными веществами и кислородом (при необходимости) и отвести продукты обмена веществ, создать однородный состав среды при условии слабого потока культуральной жидкости (при непрерывном культивировании). Для поддержания кислородного режима ферментатор снабжается устройством подвода воздуха, для лучшего перемешивания среды — мешалками различной конструкции. Для поддержания температуры среды предусмотрены системы охлаждения.
На четвертом (4) этапе из культуральной жидкости выделяют и очищают целевые продукты. Для промышленных микробиологических процессов характерно, как правило, образование очень разбавленных растворов и суспензий, содержащих помимо целевого большое количество других веществ. При этом приходится разделять смеси веществ очень близкой природы, находящихся в растворе в сравнимых концентрациях, весьма лабильных, легко подвергающихся термической деструкции.
Стадия выделения продукта существенно зависит от того, накапливается продукт в клетках или он выделяется в культуральную жидкость, или же продуктом является сама клеточная масса. Разделение биомассы и культуральной жидкости — сепарация — осуществляется несколькими методами.
Если целевым продуктом является биомасса клеток, применяют следующие методы выделения: отстаивание, фильтрация, флотирование, сепарирование и т. д. (механические способы); выпаривание и сушка (физические способы).
Фильтрация — простой и широко применяемый процесс разделения твердых частиц и жидкости, скорость которого зависит от пористо- ста фильтрующего материала и давления. Фильтрование при помощи вакуумных насосов существенно ускоряет процесс.
Флотирование применимо для выделения дрожжевых клеток. Процесс флотирования клеток осуществляется путем вспенивания культуральной жидкости. Вместе с пеной из культуральной жидкости удаляется и основная масса дрожжей.
Сепарирование осуществляют в сепараторах, в которых на клетки действует центробежная сила, отбрасывающая клетки к периферии сосуда, а культуральная жидкость будет собираться в центре сепаратора. Этот процесс протекает гораздо быстрее, чем отстаивание клеток под действием силы тяжести.
Вели целевой продукт содержится в самих клетках, то проводят разрушение клеток— дезинтеграцию— физическими, химическими и ферментативными методами.
К физическим методам можно отнести разрушение клеток под действием ультразвука, замораживания-оттаивания, баллистическую дезинтеграцию. Баллистическая дезинтеграция клеток осуществляется в мельницах, куда помещают суспензию клеток и вспомогательные мелющие вещества: песок, стеклянные или полимерные шарики.
К химическим методам дезинтеграции относят разрушение клеток с помощью толуола, бутанола и других химических соединений.
При использовании ферментативной дезинтеграции клеток используют ферменты, способные разрушать определенные структурные компоненты клеточных стенок микроорганизмов. Например, для разрушения бактериальных клеток применяют лизоцимы яиц, бактерий, актиномицетов или грибов. Для разрушения дрожжей и плесневых грибов используются фосфоманназа и β-глюконаза или применяют автолиз — разрушение клеток дрожжей или плесневых грибов под действием собственных гидролитических ферментов. Для этого суспензию клеток инкубируют при 35-45°С.
Выделение продукта из культуральной жидкости или гомогената разрушенных клеток проводят путем его осаждения, экстракции, кристаллизации или сорбции.
Осаждение в виде нерастворимых солей производят путем добавления химического осадителя в эквимолярных количествах. Применяют при получении лимонной, молочной кислоты.
Экстракция — добавление к раствору экстрагента (растворителя), который поглощает целевой продукт. Затем эмульсию разделяют и выделяют целевое вещество. Используют при получении витаминов, антибиотиков.
Кристаллизация — после предварительной обработки культу- ральной жидкости и выпаривания при охлаждении осуществляют кристаллизацию. Данный метод выделения и очистки используется при получении глутаминовой, итаконовой и других кислот.
Затем выделенный продукт концентрируют центрифугированием, ультрафильтрацией, выпариванием или обратным осмосом.
Центрифугирование — расслоение раствора с частицами большей плотности на осадок и надосадочную жидкость при воздействии центробежной силы.
Ультрафильтрация — обработка раствора на мембранных фильтрах с определенным размером пор (т. е. разделение веществ на фракции по размерам их молекул). Применяется для ферментов и других белков.
Заключительная стадия биотехнологического производства (5) — приготовление товарных форм продуктов. Общим свойством большинства продуктов микробиологического синтеза является их недостаточная стойкость к хранению, поскольку они склонны к разложению и в таком виде представляют прекрасную среду для развития посторонней микрофлоры. Это заставляет технологов принимать специальные меры для повышения сохранности препаратов промышленной биотехнологии. Кроме того, препараты для медицинских целей требуют специальных решений на стадии расфасовки.
Микробное брожение. Культивирование микроорганизмов. Технологии ферментации.
МИКРОБНАЯ ФЕРМЕНТАЦИЯ
ОБЩИЕ СВЕДЕНИЯ О КУЛЬТИВИРОВАНИИ МИКРООРГАНИЗМОВ
В общем смысле, ферментация – это биохимическая переработка сырья под воздействием ферментов, содержащихся в нем самом и в сапротрофах (чайного листа, листьев табака), а также вызываемая микроорганизмами. Однако в нашем случае мы рассматриваем исключительно микробную ферментацию (или микробное брожение).
В этой самой старой из всех методик, применяемых в биотехнологии, для производства желаемых продуктов используются живые клетки или молекулярные компоненты их «производственного оборудования». В качестве живых клеток, как правило, используются одноклеточные микроорганизмы, такие как дрожжи или бактерии; из молекулярных компонентов чаще всего находят применение различные ферменты – белки, катализирующие биохимические реакции.
Практически синонимами слова «ферментация» можно считать такие термины, как культивирование, выращивание микроорганизмов, биосинтез (см. типы ферментации )
Следует отличать микробную ферментацию от биокатализа (в котором уже полученный ранее фермент или биомасса микроорганизмов используются как катализаторы биохимического процесса синтеза продукта из исходного сырья и реагентов) и от биотрансформации (в этом процессе также применяется биокатализатор в виде фермента или биомассы микроорганизмов, но исходное вещество по химической структуре мало отличается от продукта биотрансформации).
Итак, разновидность ферментации – микробное брожение – неосознанно использовалось человеком в течение не одной тысячи лет для производства пива, вина, дрожжевого хлеба и консервированных продуктов – квашеных овощей, соленой (на самом деле – ферментированной) рыбы и т.п. Когда в середине 18 века была открыта роль микроорганизмов в брожении и люди осознали, что именно биохимическим процессам их жизнедеятельности мы обязаны существованием всех этих продуктов, применение методов ферментации значительно расширилось. В настоящее время мы используем довольно широкий спектр возможностей природных микроорганизмов, которые обеспечивают производство необходимых нам продуктов, таких как антибиотики, противозачаточные средства, аминокислоты, витамины, промышленные растворители, красители, пестициды и добавки, необходимые для приготовления пищи.
Микробная ферментация, в комбинации с методом рекомбинантных ДНК, используется для изготовления большого количества продуктов биологического происхождения: человеческого инсулина; вакцины против гепатита В; фермента, используемого для изготовления сыра; разлагаемой микроорганизмами пластмассы; ферментов, входящих в состав стиральных порошков и многого другого. Кроме того, ферментеры используются для выращивания культур самых разных животных и растительных клеток.
Ферментация – это совокупность процессов, результатом которых является культуральная жидкость.
РОСТ И РАЗМНОЖЕНИЕ БАКТЕРИЙ НА ЖИДКОЙ ПИТАТЕЛЬНОЙ СРЕДЕ
При описании процессов ферментации мы не редко упоминаем о «росте» и «размножении» микроорганизмов. Но многие часто путают значения этих слов или ошибочно считают их разными названиями одного и того же процесса. Это не так. Под ростом прокариотной клетки понимают согласованное увеличение количества всех химических компонентов, из которых она построена.
Рост бактерий является результатом множества скоординированных биосинтетических процессов, находящихся под строгим регуляторным контролем, и приводит к увеличению массы (а, следовательно, и размеров) клетки. Но рост клетки не беспределен. После достижения определенных (критических) размеров клетка подвергается делению, т.е. размножается.
Размножение бактерий определяется временем генерации. Это период, в течение которого осуществляется деление клетки. Продолжительность генерации зависит от вида бактерий, возраста, состава питательной среды, температуры и др.
Процесс культивации микроорганизмов – ферментация – начинается с того момента, когда заранее подготовленный посевной материал вводится в реактор. Размножение культуры микроорганизма характеризуется четырьмя временными фазами: лаг-фаза; экспоненциальная; стационарная; вымирание.
Рис.1. Фазы размножения бактериальной клетки на жидкой питательной среде
Рис. 2. Процесс деления бактериальной клетки
О СТАДИИ ФЕРМЕНТАЦИИ
Стадия ферментации является основной стадией в биотехнологическом процессе, так как в ее ходе происходит взаимодействие продуцента с субстратом и образование целевых продуктов (биомасс, эндо- и экзопродуктов). Эта стадия осуществляется в биохимическом реакторе (ферментере) и может быть организована в зависимости от особенностей используемого продуцента и требований к типу и качеству конечного продукта различными способами. Ферментация может проходить в строго асептических условиях и без соблюдения правил стерильности (так называемая «незащищенная» ферментация).
Ферментация в жидкой и в твердофазной среде
Культивирование на жидких средах можно разделить на поверхностную и глубинную ферментацию. Поверхностная протекает в кюветах со средой. Кюветы располагают в вентилируемые воздухом камеры. В результате процесса на поверхности среды образуется биомасса в виде пленки или твердого слоя.
Глубинная ферментация происходит во всем объеме жидкой среды. Данный вид ферментации осуществляется как периодическим, так и непрерывным способами.
Твердофазная ферментация, в твердой, сыпучей либо пастообразной среде влажностью от 30 до 80 % осуществляется тремя способами (рис. 3):
Ферментация (культивирование) может протекать как в аэробных, так и в анаэробных условиях:
Аэробное культивирование применяют в тех случаях, когда в процессе задействованы аэробные микроорганизмы-продуценты. Аэрацию смеси осуществляют подачей воздуха или других газов через газоподводящие трубки, форсунки и т. д.
Анаэробные процессы протекают в герметичных емкостях либо посредством продувания культивируемой среды инертными газами. Конструкция ферментера при анаэробной ферментации проще, чем при аэробной.
Для каждого вида процесса ферментации разработаны различные конструкции ферментеров (рис. 2).
КЛАССИФИКАЦИЯ ПРОЦЕССОВ ФЕРМЕНТАЦИИ
Рис. 3. Классификация процессов ферментации
По признаку целевого продукта процесса ферментация может быть следующих типов:
Исходную среду в процессах ферментации или ее основной компонент часто обозначают словом субстрат .
По основной фазе, в которой протекает процесс ферментации, различаются:
В условно асептической ферментации допускается некоторый уровень попадания посторонней микрофлоры, которая способна сосуществовать с основной или по содержанию не превышает определенного предела.
ПРОЦЕССЫ ФЕРМЕНТАЦИИ ПО СПОСОБУ ОРГАНИЗАЦИИ :
Все эти виды ферментации (по способу их организации) легко идентифицировать но способу загрузки сырья и выгрузки продукта.
В периодических процессах загрузка сырья и посевного материала в аппарат производится единовременно, затем в аппарате в течение определенного времени идет процесс, а после его завершения полученная ферментационная жидкость выгружается из аппарата.
В объемно-доливных процессах ферментация в промежутках между загрузкой и разгрузкой аппарата протекает как периодическая, но после некоторого времени, определяемого по состоянию процесса, часть ферментативной среды выгружают и заменяю свежей средой.
В периодическом процессе с подпиткой субстрата часть среды загружается в начале ферментации, а другая часть добавляется Непрерывно по мере протекания процесса (рис. 4.5). Естественным завершением процесса является переполнение аппарата, поэтому необходимо переходить на строго периодический процесс с максимальным объемом среды и быстро завершать его.
БИОРЕАКТОРЫ (ФЕРМЕНТЕРЫ)
Рис. 4. Классификация ферментеров
Применяется в биотехнологической промышленности при производстве лекарственных и ветеринарных препаратов, вакцин, продуктов пищевой промышленности (ферменты, пищевые добавки, глюкозные сиропы), а также при биоконверсии крахмала и производстве полисахаридов и нефтедеструкторов.
Различают механические, аэрлифтные и газо-вихревые биореакторы, а также аэробные (с подачей воздуха или газовых смесей с кислородом), анаэробные (без подачи кислорода) и комбинированные — аэробно-анаэробные.
ОБЩАЯ СХЕМА МИКРОБИОЛОГИЧЕСКОГО ПРОИЗВОДСТВА

Обычный ферментер представляет собой закрытый цилиндр, в котором механически перемешиваются среда вместе с микроорганизмами. Через него прокачивают воздух, иногда насыщенный кислородом. Температура регулируется с помощью воды или пара, пропускаемых по трубкам теплообменника. Конструкция ферментера должна позволять регулировать условия роста: постоянную температуру, pH (кислотность или щелочность) и концентрацию растворенного в среде кислорода.
1. Подготовка питательной среды
Питательная среда служит источником органического углерода – основного строительного элемента жизни. Микроорганизмы поглощают широкий спектр органических соединений – от метана (СH4), метанола (СH3OH) и углекислоты (СO2) до природных биополимеров. Кроме углерода клетки нуждаются в азоте, фосфоре и других элементах (K, Mg, Zn, Fe, Cu, Mo, Mn и др.) Важный элемент подготовки питательных сред – стерилизация с целью уничтожения всех посторонних микроорганизмов. Ее проводят термическим, радиационным, фильтрационным или химическим методами.
2. Получение чистых штаммов для внесения в ферментер.
Прежде чем начать процесс ферментации, необходимо получить чистую высокопродуктивную культуру. Чистую культуру микроорганизмов хранят в очень небольших объемах и в условиях, обеспечивающих ее жизнеспособность и продуктивность (обычно это достигается хранением при низкой температуре). Необходимо все время поддерживать чистоту культуры, не допуская ее заражения посторонними микроорганизмами.
3. Ферментация – основной этап биотехнологического процесса.
По окончании ферментации образуется смесь рабочих микроорганизмов, раствора непотребленных питательных компонентов и продуктов биосинтеза. Ее называют культуральной жидкостью или бульоном.
4. Выделение и очистка конечного продукта.
По завершении ферментации продукт, который желали получить, очищают от других составляющих бульона. Для этого используют различные технологические приемы: фильтрацию, сепарирование (осаждение частиц взвеси под действием центробежной силы), химическое осаждение и др.
5. Получение товарных форм продукта.
Последней стадией биотехнологического цикла является получение товарных форм продукта. Они представляют собой либо смесь, либо очищенный продукт (особенно если он предназначен для использования в медицинских целях).
Подробнее о технологии ферментации
Образование продуктов метаболизма и биомассы в культуре микроорганизмов. Технологии ферментации.
Выше мы лишь кратко коснулись вопроса о культивировании микроорганизмов и микробной ферментации. Однако тема это довольно обширная, т.к. касается не только вопросов наращивания микробной массы, но и использования процессов ферментации для получения самых различных продуктов, таких как витамины, ферменты, аминокислоты, антибиотики и т.д., что подразумевает под собой применение специальных ферментеров (технологий ферментации), питательных сред, производственных режимов и очистки биологических продуктов. Поэтому в дополнение к выше изложенному материалу предлагаем ознакомиться с иллюстрированной информацией, затрагивающей такие вопросы, как:
Микроорганизмы: рост в искусственных условиях
ВВЕДЕНИЕ. Микроорганизмы культивируют как на твердых, так и в жидких средах. Для лабораторной работы в первом случае обычно используют чашки с агаризованной питательной средой, во втором – качалочные колбы небольшого объема (обычно до 0,5 л). Культивирование промышленных микроорганизмов осуществляется в биореакторах. Полноценный состав питательной среды, своевременное добавление тех или иных компонентов в процессе роста клеток и оптимальные условия культивирования обеспечивают максимальный выход продукта. Во избежание заражения промышленной культуры другими микроорганизмами все операции по возможности проводятся в стерильных условиях.
КАЧАЛОЧНЫЕ КОЛБЫ используют для культивирования микроорганизмов в жидкой питательной среде. В лабораторной практике широко распространены конические колбы объемом 50–500 мл – колбы Эрленмейера, названные по имени немецкого ученого, впервые применившего колбы такой формы. Специальные перемешивающие платформы, на которые помещают колбы с культурой микроорганизмов, обеспечивают доступ кислорода ко всем клеткам. Для культивирования анаэробных микроорганизмов среду стерилизуют, деаэрируют и все последующие операции проводят в бескислородной среде в присутствии восстанавливающих агентов, например тиогликолята.
ОПТИМИЗАЦИЯ СОСТАВА КУЛЬТУРАЛЬНОЙ СРЕДЫ. Большинство микроорганизмов, использующихся в промышленности, растут в аэробных условиях и являются гетеротрофами. Для их роста необходимы органические соединения в качестве источника углерода и энергии, а также азот, соли и микроэлементы (например, ионы некоторых переходных металлов и витамины). Подбороптимального состава питательной среды для каждогомикроорганизма проводят при выращивании культуры в качалочных колбах небольшого объема. Важнейшими показателями, определяющими пригодность той или иной среды роста, является выход продукта, а также относительная стоимость сырья, необходимого для ее приготовления. Так, в производстве этанола или лимонной кислоты стоимость сырья составляет более 50% стоимости полученного продукта. Экономически более выгодно использовать в промышленности дешевые натуральные среды, имеющие не очень строго контролируемый состав, такие как кукурузный крахмал, меласса или соевая мука. В лабораторных исследованиях обычно готовят искусственные среды, в которые входят только химически чистые соединения (например, глюкоза и смесь аминокислот) в определенной концентрации.
СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД. В лабораторных условиях питательные среды стерилизуют главным образом в автоклавах. Споры термофильных бактерий теряют жизнеспособность после 15-минутного прогревания среды при 121°С (за тестовый организм принят Bacillus stearothermophilus). В этих условиях многие питательные вещества, в том числе глюкоза и витамины, нестабильны, поэтому растворы, содержащие эти вещества, стерилизуют фильтрацией через специальные бактериальные фильтры. Промышленную стерилизацию больших объемов питательных сред (более 10 л) ранее осуществляли обработкой паром под давлением 1,4–3 бар. Этот процесс является чрезвычайно продолжительным (для нагревания и охлаждения емкостей требуется несколько часов) и энергоемким. Кроме того, в результате длительной термообработки некоторые компоненты питательной среды претерпевают необратимые изменения. В современной промышленности применяют биореакторы с непрерывной стерилизацией, когда питательная среда нагревается струей перегретого пара до 140 °С в течение 2–3 мин. Противоток пара препятствует образованию конденсата, и при этом экономится до 90% энергии. Подаваемый вместе с паром воздух предварительно очищают пропусканием через фильтр, так как 1 м 3 воздуха может содержать до 2000 различных штаммов микроорганизмов, среди которых 50% – споры грибов, 40% – грамотрицательные бактерии. Если в биореакторе интенсивность аэрации составляет один объем воздуха на один объем жидкости в минуту, то для стерилизации биореактора с рабочим объемом 100 м3 требуется около 6000 м3 стерильного воздуха в час.
Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
КИНЕТИКА РОСТА ОДНОКЛЕТОЧНЫХ МИКРООРГАНИЗМОВ. К одноклеточным микроорганизмам относятся большинство бактерий, а также дрожжи. Этиорганизмы размножаются делением. За ростомклеточной массы можно наблюдать с помощью оптических методов, например непрерывно измеряяоптическую плотность (поглощение света определенной длины волны) среды. Для клеток, культивируемых в условиях периодической ферментации, выделяют шесть фаз клеточного роста. За лаг-фазой, вовремя которой происходит адаптация клетки к новымусловиям и синтез ферментов, необходимых для роста, следует короткая промежуточная фаза I (фазаускорения), а затем в течение относительно длительного периода удельная скорость роста клеток остается постоянной. Эта фаза называется экспоненциальной: рост клеток описывается кинетическимуравнением первого порядка. За экспоненциальнойфазой следует промежуточная фаза II: замедлениеклеточного роста происходит из-за истощения питательной среды, накопления токсичных для клетки метаболитов и высокой плотности популяции. Культурапереходит в стационарную фазу: в это время числоклеток остается постоянным, однако именно в этовремя может происходить образование важнейшихвторичных метаболитов, в том числе антибиотиков. Завершающая стадия – фаза отмирания – период, когда все процессы метаболизма в клетке останавливаются. Самые важные параметры, которые можно определить по кривой роста:
1) продолжительность лаг-фазы, которая зависит от физиологического состояния посевного материала к моменту инокуляции, а также от различия между составом среды, где клетки росли ранее, и составом новой культуральной среды;
2) удельная скорость роста (ч –1 ) связывает скорость роста клеточной массы и концентрацию клеток в реакторе. В экспоненциальной фазе величина постоянна, однако для промежуточной фазы II удельная скорость роста зависит от концентрации лимитирующего субстрата S.
Эта зависимость выражается уравнением Моно: = max * S/(KS + S), где KS (мг/л) – концентрация лимитирующего клеточный рост питательного вещества, при которой удельная скорость вдвое ниже максимального значения. Уравнение Моно имеет ту же форму, что и уравнение скорости ферментативной реакции, предложенное Михаэлисом и Ментен, и является математическим упрощением при моделировании. Иногда вместо удельной скорости роста используют время генерации или время удвоения – время, за которое происходит удвоение числа клеток в экспоненциальной фазе. Часто оказывается, что количество клеточной массы, образующейся в процессе клеточного роста, пропорционально массе утилизированного клетками субстрата. Экономическим коэффициентом называют соотношение между приростом клеточной массы и потребляемым субстратом, при этом под субстратом в данном случае понимают не только химические вещества (кислород, источники азота и углерода, фосфаты), но и физические параметры, например температуру. Если среда содержит несколько источников углерода, то иногда можно наблюдать ряд последовательных лаг-фаз. Это явление, называемое диауксией (двух фазным ростом), обусловлено изменением метаболизма в процессе роста: сначала клетки используют один источник углерода, а затем, когда он истощается, «перестраивают» свой метаболизм на утилизацию другого источника.
КИНЕТИКА РОСТА МИКРООРГАНИЗМОВ, ОБРАЗУЮЩИХ МИЦЕЛИЙ. Рост грибов, а также прокариот,образующих мицелий, таких как стрептомицеты,сопровождается увеличением размеров мицелия (образующих его гиф). Рост таких организмов описывается очень сложной кинетикой.
ОБРАЗОВАНИЕ ПРОДУКТОВ МЕТАБОЛИЗМА. Процессы образования продуктов метаболизма могут быть сопряжены или не сопряжены с клеточным ростом. Согласно исторической классификации, процесс ферментации, сопряженный с клеточным ростом, относят к типу I. Примером может служить образование этанола в ходе анаэробного роста дрожжей. При ферментации III типа конечный продукт синтезируется в клетках по окончании экспоненциальной фазы роста и является вторичным метаболитом. В качестве примера можно привести антибиотики и внеклеточные ферменты. Ферментацией II типа ранее называлось образование продукта по «ответвлениям» основных путей первичного метаболизма и, следовательно, без непосредственной связи с энергетическим обменом клетки, как, например, при синтезе лимонной кислоты или аминокислот. Согласно современным представлениям, процессы образования всех метаболитов в клетке взаимосвязаны, поэтому сейчас говорят только о ферментации I или III типа, т. е. о ферментации, сопряженной или не сопряженной с клеточным ростом.

Периодическая ферментация с добавлением субстрата и непрерывная ферментация
ВВЕДЕНИЕ. Периодическое добавление субстрата в биореактор позволяет увеличить продолжительность экспоненциальной фазы, во время которой синтезируются большинство белковых продуктов, поэтому в современной промышленности этот тип ферментации находит все большее применение. Непрерывная ферментация имеет важное значение для изучения закономерностей клеточного роста и метаболизма, однако в промышленных целях применяется очень редко.
НЕПРЕРЫВНАЯ ФЕРМЕНТАЦИЯ. При непрерывной ферментации в культуру постоянно подают свежие питательные вещества и одновременно из нее отводится такой же объем клеточной суспензии. Непрерывную ферментацию можно проводить в реакторе с постоянной скоростью подачи питательных веществ (хемостате), в реакторе, в котором поддерживается постоянное количество клеток (турбидостате) или в реакторе идеального вытеснения (plug-flow), в котором суспензия клеток направленно поступает в реактор, а на выходе удерживается и вновь подается на вход. Использование реакторов идеального вытеснения особенно важно при подборе оптимальных условий ферментации. В разных участках реактора наблюдаются различные условия: динамика изменений состава питательной среды, концентрации биомассы и продукта аналогична тому, что происходит при периодической ферментации в различные промежутки времени. В стационарном состоянии рост биомассы поддерживается на постоянном уровне благодаря удалению клеточной суспензии из реактора. Концентрация субстрата S и скорость образования продукта Qx остаются постоянными. В этих условиях, если скорость образования продукта не зависит от скорости роста клеток, можно считать, что скорость образования продукта Qx пропорциональна скорости прохождения клеток через реактор. Если целевой продукт является продуктом вторичного обмена, т. е. процессы роста биомассы и синтеза продукта являются сопряженными, математическая модель процесса непрерывной ферментации значительно усложняется. Непрерывная ферментация имеет очень важное значение для подбора и усовершенствования условий промышленной ферментации, а также для изучения влияния пониженного содержания определенного компонента среды на клеточный рост. В промышленности непрерывная ферментация не находит широкого применения, однако эти процессы используются при аэробной или анаэробной очистке сточных вод, а также в пивоварении и производстве человеческого инсулина с помощью рекомбинантных штаммов дрожжей. По сравнению с периодической ферментацией непрерывная ферментация имеет ряд недостатков: a) экономические преимущества непрерывного процесса проявляются лишь через 500–1000 часов ферментации, однако затраты на поддержание стерильности реа ктора в течение столь продолжительного времени могут оказаться весьма значительными; б) контроль и поддержание однородного состава питательной среды в течение длительного периода также требуют дополнительных мер; в) далеко не все рекомбинантные штаммы, используемые в промышленности, сохраняют свои генетически запрограммированные свойства в течение продолжительного времени.

Технология ферментации
ВВЕДЕНИЕ. Правильный расчет конструкции биореактора так же важен для осуществления экономически выгодного процесса ферментации, как и сведения о биологических характеристиках используемых микроорганизмов, полученные при биологических и биохимических исследованиях. Основные цели усовершенствования биореакторов заключаются в повышении безопасности проведения ферментации и минимизации промышленных затрат. При оптимизации конструкции биореактора рассматриваются следующие наиболее важные аспекты: 1) перемешивание среды роста микроорганизмов; 2) соблюдение температурного режима и 3) снабжение клеток кислородом в случае аэробной ферментации.
ПЕРЕМЕШИВАНИЕ в биореакторе осуществляется с помощью механического устройства или путем пропускания воздуха или другого газа. При перемешивании возникают турбулентные потоки, которые можно математически описать, используя число Рейнольдса (Re). Значение числа Рейнольдса обратно пропорционально вязкости среды – параметра, который в случае образующих мицелий организмов зависит от стадии роста микроорганизма и от концентрации продукта в среде. Наиболее наглядна зависимость скорости турбулентных потоков от количества продукта в среде в случае получения ксантановой смолы. Биореактор идеального перемешивания – это математическая модель, которую используют для изучения закономерностей роста микроорганизмов в биореакторе. В этом идеализированном случае считается, что концентрация любого компонента среды одинакова во всем объеме реактора, т. е. среда абсолютно гомогенна. На практике такая ситуация недостижима, так как любой биологический материал не идеальная жидкость: так, клетки мицелия весьма чувствительны к механическому воздействию, поэтому необходимо подбирать условия, обеспечивающие наиболее эффективное перемешивание и в то же время сохраняющие жизнеспособность биологического материала. На эффективность перемешивания влияет множество факторов: форма реактора, конструкция мешалок, их число и скорость вращения для реакторов с механическим перемешиванием или способ подачи газа (барботажная колонна или инжекторная подача) и конструкция насосов для аэроперемешивания. Число Ne – коэффициент мощности – отражает потребление энергии в процессе перемешивания содержимого реактора. В случае, когда через среду не пропускают газ, значение Ne связано с числом Рейнольдса. Для перемешивания в промышленных биореакторах разработано несколько конструкций, позволяющих эффективно проводить аэрацию и перемешивание. К таким устройствам относятся, например, крыльчатые диски и турбинные мешалки. Эффективность перемешивания описывается объемным коэффициентом массопередачи kLa.
ПОДДЕРЖАНИЕ ПОСТОЯННОЙ ТЕМПЕРАТУРЫ – необходимое условие для оптимального течения процесса ферментации. При росте микроорганизмов высвобождается большое количество энергии в виде тепла, перемешивающие устройства также выделяют тепло. Кроме того, определенный вклад вносят процессы общей теплопередачи и теплообмена на границах фаз. Обычно системы охлаждения с помощью змеевиков или охлаждающих рубашек достаточно для поддержания температуры ферментации на определенном уровне. Однако в некоторых случаях, например при использовании в качестве источников углерода алканов или метанола, требуются дополнительные устройства для охлаждения реактора.
АЭРАЦИЯ. Рост аэробных организмов замедляется, если концентрация кислорода в среде ниже некоторого критического значения. При подборе оптимальных условий аэрации учитывают биологические и технические особенности ферментации. Во-первых, оптимальная скорость переноса кислорода в реакторе зависит от максимальной скорости потребления кислорода микроорганизмами. Во-вторых, не следует забывать о том, что кислород в условиях ферментера находится в трехфазной системе (газ–питательная среда–клетка), и транспорт в такой сложной системе также должен быть оптимизирован. Общее сопротивление обмену кислорода складывается из отдельных сопротивлений в последовательных процессах переноса кислорода от газового пузырька до клетки: 1) диффузия газа к границе раздела фаз газ–жидкость; 2) перенос через границу раздела фаз газ–жидкость; 3) транспорт через жидкость к микроорганизму; 4) транспорт внутри клетки. В случае одноклеточных микроорганизмов на скорость переноса кисло рода значительно влияет скорость диффузии кислорода к скоплениям клеток или мицелию. На процесс транспорта кислорода в жидкости влияет множество факторов: 1) технологические (размер реактора, заполненность реактора, эффективность перемешивания, интенсивность аэрации); 2) физико-химические (плотность и вязкость среды, температура, поверхностные свойства (необходимо добавление пеногасителей!)); 3) биологические характеристики микроорганизма (форма клеток). Важный показатель массообмена кислорода kLa можно измерить экспериментально.

Промышленные процессы ферментации
ВВЕДЕНИЕ. Переход от процесса, разработанного в лаборатории, к промышленному производству не сводится к простому увеличению масштаба. В зависимости от технологического процесса используются различные конструкции биореакторов, среди которых наибольшее распространение получили реакторы с перемешиванием. Обычно процесс перехода к большим объемам производства осуществляется поэтапно (30 л → 300 л → 3000 л → промышленные масштабы).
МАСШТАБИРОВАНИЕ. Уже на уровне экспериментальных цехов биореакторы снабжены мешалками, турбинами, насосами и специальными устройствами для аэрации. Все эти инженерные приспособления необходимы для создания оптимальных условий культивирования клеток. При переходе к промышленным масштабам производства необходимо учитывать, что в больших реакторах время перемешивания должно быть значительно увеличено. Для того чтобы в реакторе объемом более 150 м 3 достичь обычной для небольших объемов скорости вращения мешалки, потребуются огромные энергозатраты. Из этих же соображений крайне редко в промышленности используют рекомбинантные организмы, содержащие плазмиды с промотором фага λ: при повышении температуры, что необходимо для индукции генов под λ-промотором, может нарушить стабильное течение процесса в большом реакторе. При расчете параметров аэрации учитывают повышенную чувствительность клеток стрептомицетов, Aspergillus и Penicillum к механическому воздействию. Аналогичные аспекты принимают во внимание, когда рассматривают прохождение газа через среду, а также отведение образовавшегося тепла с помощью теплообменников.
КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНАЯ АППАРАТУРА. Контроль условий культивирования необходим и в экспериментальных установках для подбора оптимальных параметров, и в ходе производственного процесса. Обычно измеряют следующие характеристики: вес клеточной массы, температуру культуральной жидкости, скорость вращения и потребляемую мощность перемешивающих устройств, содержание кислорода и рН среды. Часто в отработанных газах анализируют содержание СО2 (методом ИК-спектроскопии) и О2 (методом парамагнитного резонанса). По результатам всех анализов получают полную картину технологического процесса. Состав продукта и расход субстрата определяют путем периодического отбора проб без нарушения стерильности системы. Из-за больших затрат на проведение ферментации и высоких цен на сырье, ведется постоянный поиск возможностей для снижения затрат (технологический процесс получения продукта с рыночной ценой около 10 евро/кг в ферментере объемом 100 м 3 с выходом продукта 100 г/л обходится в 100 000 евро).
ПРОБЛЕМА ПЕНООБРАЗОВАНИЯ В ФЕРМЕНТЕРАХ. Интенсивная аэрация жидких сред, содержащих белки, часто сопровождается нежелательным пенообразованием. Для предотвращения этого обычно используют механические сбиватели пены, а приобразовании слишком большого количества пены всреду добавляют химические пеногасители (например, эруковую кислоту или силиконы). Однако следует помнить, что присутствие химических реагентовможет значительно усложнять процедуру очистки продукта, поэтому стараются использовать минимальные количества пеногасителей.

Для экономии в нашем разделе мы пропустили тему про культивирование животных клеток и биореакторы для этой цели, т.к. наш «профиль» в основном микробная биомасса. — ред.
Биореакторы с иммобилизованными ферментами и клетками
ВВЕДЕНИЕ. Из экономических соображений промышленное производство, как правило, основано на использовании иммобилизованных катализаторов. Выделенные ферменты включают в небольшие частицы или закрепляют на носителе. Если процедура очистки внутриклеточного фермента слишком трудоемкая, в реакторе иммобилизуют непосредственно клетки микроорганизма – продуцента фермента. Такие клетки обычно осуществляют несколько последовательных превращений.
Примечание от редактора:
Иммобилизация клеток
Иммобилизация – это процесс фиксации биообъекта с помощью физико-химических сил на носителе. Иммобилизация входит в дисциплину, носящую название «биотехнология». Клеточная иммобилизация – это процесс, при котором клетки прикрепляются к какой-либо твердой поверхности или образуют плотные агрегаты. Выделяют четыре метода клеточной иммобилизации: прикрепление, внедрение, включение и агрегацию. Метод прикрепления объединяет все формы иммобилизации, при которой клетки каким-либо способом прикрепляются к поверхности или твердому носителю.
В 70-х годах XX века появились первые публикации об иммобилизации клеток микроорганизмов, а первое промышленное применение иммобилизованных клеток было осуществлено в Японии в 1974 г. С их помощью получали аспарагиновую кислоту.
Иммобилизованные клетки имеют ряд преимуществ как перед иммобилизованными ферментами, так и перед свободными клетками:
Для иммобилизации могут быть использованы клетки в различном состоянии: живые и поврежденные в различной степени. Одностадийные реакции могут осуществлять и живые, и поврежденные клетки. Полиферментные реакции проводят с применением живых клеток, которые могут длительное время регенерировать АТФ и коферменты (НАДФ, НАД).
Проблема использования ферментативной активности иммобилизованных микроорганизмов имеет глубокие корни. Более 150 лет назад быстрый способ получения уксуса был основан на применении микроорганизмов, адсорбированных на древесной стружке. Методы иммобилизации клеток схожи с методами иммобилизации ферментов.
Иммобилизация клеток путем включения в различные гели, мембраны, волокна основана на химических и физических взаимодействиях. Химические взаимодействия используются реже по сравнению с другими методами и малопригодны для иммобилизации живых клеток. Гораздо большее распространение получило включение клеток в состав гелей, мембран и волокон. При таком способе иммобилизации клетки могут сохранять жизнеспособность и в присутствии питательной среды размножаться в приповерхностных слоях гелей. Захват клеток шариками альгината легко продемонстрировать на лабораторных занятиях; он является наиболее распространенным промышленным методом. Раствор, содержащий гомогенат клеток и альгинат натрия, по каплям вносят в раствор хлористого кальция. Как только капельки вступают в контакт с хлористым натрием, они немедленно начинают превращаться в гель; при этом образуются идеальные по форме шарики геля, содержащие внутри захваченные клетки. Для длительного использования гель можно стабилизировать полиакриламидом или приготовить его в виде пластин, если поместить его на тканевую основу.
Биокаталитическая активность целых иммобилизованных клеток в настоящее время может быть использована в различных отраслях науки и техники:
Дополнительно см.:
ИММОБИЛИЗАЦИЯ. Один из способов иммобилизации связан с применением ионообменных смол. В этом случае клетки или ферменты связываются с носителем за счет адсорбции. Для иммобилизации клеток за счет ковалентных взаимодействий применяют три способа: 1) связывание с глутаровым диальдегидом, приводящее к образованию оснований Шиффа, и стабилизация путем восстановления боргидридом натрия; 2) иммобилизация на диизоцианатах; 3) фиксация на полимерных эпоксидных смолах (оксиранах). В качестве носителя используются разнообразные органические или неорганические материалы. Для иммобилизации ферментов также применяют глутаровый альдегид или диизоцианаты. Клетки или ферменты включают в полимерные гели, полученных при радикальных или фотохимических реакциях. Так, ферменты могут включаться в полиакриламидный гель в присутствии N, N’-метиленбисакрил-амида после добавления персульфата калия. В качестве примера полимеризации в результате фотохимической реакции можно привести образование полиуретана. При микрокапсулировании ферменты или клетки включаются в микрокапсулы в реакциях полимеризации на границе раздела водной и органической фаз. Часто для иммобилизации используют ионотропные гели, например альгинаты, которые полимеризуются в средах, содержащих ионы кальция. В настоящее время ведутся активные исследования возможностей включения биокатализаторов в состав искусственных волокон, например из производных целлюлозы.
СВОЙСТВА ИММОБИЛИЗОВАННЫХ БИОКАТАЛИЗАТОРОВ. Иммобилизованные биокатализаторы отличаются по своим свойствам от свободных ферментов или клеток: интенсивность процесса в случае иммобилизованных биокатализаторов определяется не только свойствами самого катализатора, но также процессами транспорта субстрата и продукта в направлении катализатора и от него. С целью оптимизации свойств иммобилизованных биокатализаторов предложены методы математического моделирования с учетом, кроме свойств фермента, других факторов, например размер частиц, на которых иммобилизован биокатализатор, и скорость транспорта веществ. Одно из важных преимуществ использования иммобилизованных биокатализаторов – их стабильность. В промышленном процессе срок службы иммобилизованных клеток или ферментов обычно составляет несколько месяцев (например, клетки, синтезирующие аспарагиновую кислоту, ферменты глюкозоизомераза или пенициллинацилаза).
ТИПЫ БИОРЕАКТОРОВ И ТЕХНОЛОГИЯ ПРОЦЕССА.
Основные типы ферментативных и клеточных биореакторов – трубчатые реакторы (с неподвижным слоем катализатора, с псевдоожиженным слоем катализатора, с неподвижным слоем катализатора и соструйным течением жидкости) и реакторы с перемешиванием (непрерывного или периодического действия). Наряду с усовершенствованием биокатализаторов (повышение их стабильности) и оптимизацией биореактора или ферментативного реактора (с учетом различных скоростей диффузии низко- и высокомолекулярных веществ) ведутся работы по выбору условий проведения реакции для максимального выхода продукта. К этим условиям относятся: подготовка исходных веществ, предотвращение побочных реакций и обработка продукта в зависимости от его применения. На производстве предпочтение отдано относительно простым операциям, которые можно контролировать и в случае необходимости регулировать. Для получения больших объемов продуктов, например фруктозных сиропов или 6-аминопенициллановой кислоты, обычно используют непрерывный технологический процесс, в ходе которого параллельно протекают несколько ферментативных реакций. Производство организовано таким образом, что модули, оснащенные биокатализаторами, могут подключаться поочередно, так что, когда ферментативная активность в одном модуле истощается, без остановки процесса включается другой модуль. Для производства небольшого количества продукта достаточно одного реактора.
Очистка биотехнологических продуктов
ВВЕДЕНИЕ. Образовавшийся в процессе ферментации продукт может накапливаться внутри клетки (если продукт является внутриклеточным ферментом или белком в составе телец включения) или выходить в культуральную среду. В традиционно применяемых для ферментации штаммах концентрация продукта обычно небольшая и составляет менее 10%, а часто даже менее 1% клеточного содержимого. Методы генетической инженерии позволяют значительно повышать выход продукта: в некоторых случаях этот показатель достигает 50%. После завершения ферментации следуют стадии концентрирования и очистки полученного продукта. Выбор способа очистки зависит от целей использования продукта. Так, вещества, которые в дальнейшем будут применяться в фармакологии и при проведении клинических анализов, подвергаются очень тщательной очистке, в то время как препараты ферментов для технического использования часто содержат примеси. Стоимость очистки продукта может составлять более 50% всех затрат на его производство, поэтому разработка усовершенствованных методов, позволяющих снизить расходы на очистку без потерь качества продукта, имеет важное экономическое значение. Особое внимание уделяется переработке отходов, образовавшихся при выделении и очистке продукта (например, клеточной массы).
КЛЕТОЧНАЯ МАССА. При производстве пекарских дрожжей биотехнологическим продуктом является клеточная масса. Осажденные центрифугированием клетки промывают и пропускают через ротационный вакуумный фильтр барабанного типа или пластинчатый фильтр. Полученный продукт в полусухом виде высушивают распылением. В последнем случае срок хранения, например, дрожжей значительно увеличивается. Для сбора клеток также используют фильтрацию клеточной суспензии.
ВНУТРИКЛЕТОЧНЫЕ ПРОДУКТЫ. Для выделения внутриклеточных продуктов клетки должны быть разрушены. Разработано множество способов разрушения клеток, однако в промышленности наиболее распространены физические методы с использованием шаровых мельниц или гомогенизаторов высокого давления. Для разрушения клеточной стенки в мягких условиях используют ферменты. В лабораторных условиях клетки, как правило, разрушают ультразвуком или ферментативными методами (например, клетки E. coli обычно обрабатывают лизоцимом в присутствии неионных ПАВ). В зависимости от наличия сигнальной последовательности белки находятся в цитоплазме или в периплазматическом пространстве. Рекомбинантный белок может оказаться в составе телец включения за счет образования аномальных дисульфидных связей. После мягкого разрушения клеток тельца включения отделяют центрифугированием. В результате обработки телец включения тиолами и мочевиной белок переводится в растворимое состояние, причем современные методики позволяют сделать этот процесс обратимым. При удалении мочевины диализом возможна ренатурация белка с образованием правильной системы дисульфидных связей. Дальнейшие этапы очистки внутриклеточных ферментов и ренатурированных из телец включения белков аналогичны соответствующим этапам очистки внеклеточных продуктов.
ВНЕКЛЕТОЧНЫЕ ПРОДУКТЫ. После отделения клеточной массы из культуральной жидкости осаждают низкомолекулярные продукты, например аминокислоты или лимонную кис лоту. Процедура выделения и очистки антибиотиков включает несколько этапов экстракции органическими растворителями (например, н-бутилацетатом). Белки, в том числе и ферменты, часто выделяют фильтрованием через мембраны. Для осаждения белка после фильтрования в раствор добав ляют соли – сульфат аммония или натрия до высоких концентраций (высаливание). Для каждого белка характерна специфическая концентрация солей, достаточная для осаждения. Большинство белков осаждаются при содержании соли 10–50%. Другой способ выделения белка заключается в экстракции: для этого в раствор добавляют небольшое количество (2–10%) охлажденного органического растворителя, например 2-пропанола. Для технических целей ферменты используются в виде фильтрата в жидком или высушенном виде.
КОМБИНИРОВАННЫЕ МЕТОДЫ. Одновременное выделение нескольких продуктов в одном резервуаре позволило бы значительно сократить время процесса и общую площадь производства. Однако на практике такие возможности удается реализовать очень редко. Интересным примером является создание промышленной установки, в которой объединены процедуры отделения клеток и очистки продукта. В этой установке клеточный бульон пропускают через несколько неподвижных слоев ионообменной смолы. Экстракция в двухфазной системе, состоящей из несмешивающихся водных растворов солей или полимеров, – еще один перспективный метод выделения биотехнологических продуктов.
ФАКТЫ О РАЗМНОЖЕНИИ БАКТЕРИЙ

Чрезвычайно малые размеры бактерий и быстрота их размножения имеют огромное значение для понимания условий взаимодействия между микробами и окружающей средой. Объем воды в 0,001 мл способен вместить до 10 9 бактерий. При внесении такого количества бактерий в 1 мл воды в случае равномерного распределения их по всему объему на 1 л воды придется 10 6 бактерий или 1000 бактерий на 1 мл воды. Вот почему, например, ничтожное (!) количество зараженного болезнетворными бактериями вещества достаточно для распространения инфекционных заболеваний, передаваемых через воду.
Дополнительно по теме см.:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ