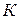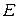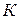что такое криоскопическая постоянная
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


6.2. Общие свойства растворов
Многие другие методы исследования растворов подтверждают существование в природе веществ, которые не распадаются на ионы в водном растворе и распадаются, т. е. диссоциируют. Их называют соответственно неэлектролитами и электролитами.
С диаграммой состояния воды вы знакомы. Теперь попытайтесь, не заглядывая далее по тексту, нарисовать диаграмму состояния чистой воды и на этом же рисунке диаграмму состояния водного раствора (разбавленного).
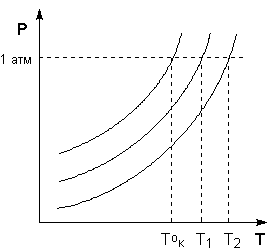
Очевидно, кривая давления пара воды над раствором 2‘ будет располагаться правее и ниже такой же кривой давления пара над чистой водой 2 (рис. 6.6). Кривая 2′ пересекает кривую 3, характеризующую давление пара надо льдом, при более низком давлении, поэтому кривая зависимости температуры замерзания раствора 1′ располагается левее кривой 1. При атмосферном давлении ратм (101 325 Па) температура замерзания раствора tзам оказывается ниже температуры плавления tпл льда, а температура кипения раствора tкип – выше температуры кипения tкип чистой воды.
Рис. 6.6.
Температуры замерзания и кипения чистой воды и раствора:
кривая 1 – температура замерзания чистой воды;
кривая 1′ – температура замерзания раствора;
кривая 2 – давление пара над чистой водой;
кривая 2′ – давление пара воды над раствором;
кривая 3 – давление пара надо льдом
Таким образом, понижение давления насыщенного пара воды (растворителя) над раствором приводит к повышению температуры кипения и понижению температуры плавления раствора по сравнению с температурами кипения и плавления чистого растворителя.
Разность температур кипения раствора tкип.р-ра и чистой воды tкип называется повышением температуры кипения раствора:

Разность температуры плавления льда tпл и температуры замерзания раствора tзам.р-ра называется понижением температуры замерзания раствора:

Примечание. За температуру замерзания раствора принимают температуру начала его кристаллизации, т. е. температуру выделения из раствора первого кристаллика. Для чистого вещества температуры плавления и замерзания совпадают.
Важное отличие процессов замерзания чистой воды и ее раствора состоит в следующем: чистая вода в соответствии с правилом фаз Гиббса замерзает при постоянной температуре (число степеней свободы системы равно нулю). Как плавление льда, так и обратный процесс кристаллизации воды происходят при одной и той же температуре (если не происходит переохлаждения жидкости). Выпадение из раствора первых кристалликов льда приводит к увеличению концентрации растворенного вещества, понижению давления насыщенного пара растворителя и соответственно к понижению температуры выделения следующих порций льда (кристаллов растворителя). Таким образом, отвердевание раствора происходит в некотором интервале температур (двухкомпонентная, двухфазная, система имеет одну степень свободы) в отличие от кристаллизации чистой воды, происходящей при постоянной температуре.
Раствор также кипит не при постоянной температуре, а в некотором интервале температур.
Повышение температуры кипения раствора тем больше, чем выше концентрация растворенного вещества m:

В этой формуле Е – коэффициент пропорциональности, называемый эбулиоскопической постоянной.
Понижение температуры замерзания раствора тем значительнее, чем выше концентрация растворенного вещества m:

В этой формуле К – коэффициент пропорциональности, называемый криоскопической постоянной.
В строгих научных исследованиях растворов пользуются моляльной концентрацией, которая равна числу молей растворенного вещества в 1000 г растворителя. Моляльная концентрация m в отличие от мольной (молярной) концентрации с (число молей растворенного вещества в 1 л раствора) не зависит от температуры. Для сильно разбавленных растворов моляльная концентрация совпадает с мольной концентрацией, и обе они пропорциональны мольной доле растворенного вещества.
Чтобы найти численные значения коэффициентов пропорциональности Е и К, достаточно для одного раствора известной концентрации определить повышение температуры кипения и понижение температуры замерзания. Так 0,1М раствор сахарозы С12Н22О11 в воде начинает кипеть при 100,052 °С. Следовательно, эбулиоскопическая постоянная Е воды равна:
Е = 
0,1М раствор сахарозы С12Н22О11 в воде замерзает при температуре –0,186 °С. Следовательно, криоскопическая постоянная К воды равна:
К = 
Обычно размерность при эбулиоскопической и криоскопической постоянных не указывают. Какова их размерность?
Эбулиоскопическая постоянная есть повышение температуры кипения одномольного водного раствора неэлектролита. Криоскопическая постоянная есть понижение температуры замерзания одномольного водного раствора неэлектролита. Этот вывод правилен только в том случае, если раствор идеальный. Однако раствор с концентрацией растворенного вещества 1 моль/л не является идеальным раствором, и эбулиоскопический и криоскопический методы исследования растворов применяют при концентрациях растворенного вещества не выше 0,01 моль/л (правильнее:
0,01 моль/1000 г растворителя).
Итак, одномольный (точнее, одномоляльный) раствор таких веществ, как сахароза С12Н22О11, глюкоза или фруктоза С6Н12О6, карбамид (мочевина) СО(NН2)2, глицерин СН2ОНСНОНСН2ОН, кипит при температуре 100,52 °С в предположении, что раствор идеальный. Считается, что эбулиоскопическая постоянная Е не зависит от природы растворенного вещества (неэлектролита).
В 1 л воды насыпали одну полную чайную ложку поваренной соли. Какова приблизительно температура кипения супа с таким содержанием соли?
Чтобы картофель быстрее сварился, вы рекомендуете солить воду в начале варки или в конце?
Точно так же одномольный (точнее, одномоляльный) раствор таких веществ, как сахароза С12Н22О11, глюкоза или фруктоза С6Н12О6, карбамид (мочевина) СО(NН2)2, глицерин СН2ОНСНОНСН2ОН, начинает замерзать при температуре –1,86 °С в предположении, что раствор идеальный. Считается, что криоскопическая постоянная К не зависит от природы растворенного вещества (неэлектролита).
Поскольку понижение температуры замерзания и повышение температуры кипения раствора изменяются пропорционально концентрации, а один моль вещества содержит одинаковое число частиц (молекул), то понижение температуры замерзания и повышение температуры кипения раствора зависит от числа частиц растворенного вещества. Это следствие закона Рауля: повышение температуры кипения и понижение температуры замерзания раствора пропорционально числу частиц растворенного вещества. Из этого следует, что методами криоскопии и эбулиоскопии можно определять мольные массы неэлектролитов, степень диссоциации электролитов и степень ассоциации (соединения, объединения) молекул растворенных веществ.
Температура начала кипения 0,1М раствора хлорида натрия равна 100,104 °С. Если пересчитать ее на 1М раствор, то она должна быть равна 101,04 °С. Повышение температуры кипения составляет 1,04 °С, а должно быть 0,52 °С, как у сахарозы, фруктозы и других растворяющихся в воде органических веществ. Следовательно, в растворе хлорида натрия концентрация частиц равна не 1 моль/л, а 2 моль/л, т. е. хлорид натрия в водном растворе находится в диссоциированном состоянии:
0,1М раствор хлорида натрия начинает затвердевать (появляются первые кристаллы льда) при температуре –0,372 °С. 1М раствор должен начинать замерзать при –3,72 °С. Понижение температуры затвердевания равно 3,72 °С, т. е. в два раза больше криоскопической постоянной. Это означает, что в растворе содержится в два раза больше частиц по сравнению с раствором сахарозы той же концентрации и хлорид натрия в водном растворе находится в состоянии почти полной диссоциации на ионы.
Внимательно изучите приведенные ниже в таблице данные по температурам кипения и затвердевания 1М растворов сахарозы С12Н22О11 и некоторых солей. (Температуры кипения и затвердевания были определены у 0,01М растворов и пересчитаны на 1М растворы.) Самостоятельно сформулируйте выводы о состоянии хлорида кальция, хлорида алюминия и сульфата алюминия в водном растворе. Напишите уравнения диссоциации.
| Растворенное вещество | tкип, °С |  tкип, °С tкип, °С |  tкип/E tкип/E | tзам, °С |  tзам, °С tзам, °С |  tзам /K tзам /K |
|---|---|---|---|---|---|---|
| 100 (вода) | 0 | – | 0 (вода) | – | – | |
| Cахароза | 100, 52 | 0,52 | 1 | –1,86 | 1,86 | 1 |
| NaCl | 101,04 | 1,04 | 2 | –3,72 | 3,72 | 2 |
| СаCl2 | 101,56 | 1,56 | 3 | –5,58 | 5,58 | 3 |
| AlCl3 | 102,08 | 2,08 | 4 | –7,44 | 7,44 | 4 |
| Al2(SО4)3 | 102,60 | 2,60 | 5 | –9,30 | 9,30 | 5 |
Эбулиоскопическая постоянная воды очень мала, поэтому чаще изучают растворы криоскопическим методом (определение температур затвердевания).
Криоскопический и эбулиоскопический методы изучения веществ в растворенном состоянии позволяют определять мольные массы растворенных веществ. Суть определения чрезвычайно проста: необходимо найти такую концентрацию растворенного вещества, выраженную в г/л раствора, при которой понижение температуры замерзания или повышение температуры кипения равнялись соответственно криоскопической или эбулиоскопической постоянным.
В этом случае в 1 л раствора будет содержаться 1 моль растворенного вещества, и число граммов этого вещества будет равно его мольной массе. Это относится к неэлектролитам. В случае раствора электролита криоскопический и эбулиоскопический методы позволяют определить степень его диссоциации.
Еще раз повторяем, что сказанное верно лишь для разбавленных растворов и при использовании моляльной концентрации (моль/1000 г растворителя).
Что такое криоскопическая постоянная
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.2 РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
3.2.1 Давление насыщенного пара разбавленных растворов
Представим, что в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Очевидно, что, чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля :
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
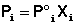
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
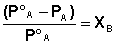
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
3.2.2 Давление пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе – пар относительно богаче компонентом, температура кипения которого ниже). Рассмотрим бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
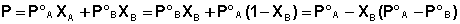
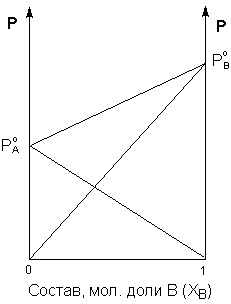
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях (рис.3.3). К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси изомерных углеводородов и др.
Рис. 3.3 Зависимость парциальных и общего давлений пара
идеального раствора от концентрации
Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля ( положительные отклонения ). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных ( отрицательные отклонения ). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0), растворы с отрицательными отклонениями образуются с выделением теплоты (ΔНраств понижения температуры замерзания ΔТзам, равной разности между температурой замерзания чистого растворителя T°зам и температурой начала кристаллизации раствора Tзам:
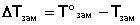
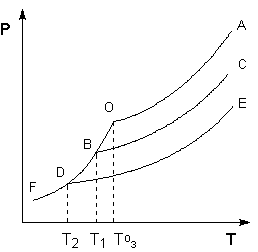
Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации (рис. 3.5), на которой кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Рис. 3.5 Понижение температуры замерзания разбавленных растворов
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
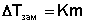
3.2.4 Температура кипения разбавленных растворов
Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении. Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации (рис.3.5). Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно температуры, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей (рис. 3.6).
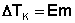
Рис. 3.6 Повышение температуры кипения разбавленных растворов
Т.о., второй закон Рауля можно в наиболее общем виде сформулировать следующим образом:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого; данный закон справедлив только для бесконечно разбавленных растворов. Коэффициенты пропорциональности в уравнениях (III.14 – III.15) – эбулиоскопическая и криоскопическая константы – имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, эбулиоскопическая и криоскопическая константы не могут быть непосредственно определены и относятся поэтому к числу т.н. экстраполяционных констант.
3.2.5 Осмотическое давление разбавленных растворов
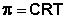
Уравнение (III.16) есть т.н. принцип Вант-Гоффа :
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
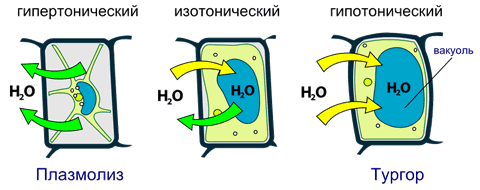
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
Рассмотрим роль осмоса в водном режиме растительной клетки. Осмотическое давление жидкости, контактирующей с клеткой, может быть больше, меньше либо равно осмотическому давлению внутриклеточной жидкости. Соответственно выделяют гипертонические, гипотонические и изотонические растворы.
Рис. 3.7 Влияние осмотического давления на растительную клетку
Изотонические растворы не оказывают влияния на водный режим клетки.
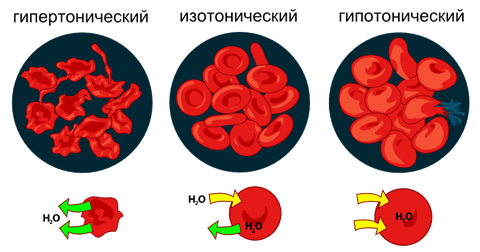
У животных клеток нет клеточной стенки, поэтому они более чувствительны к осмотическому давлению жидкости, в которой находятся.
Рис. 3.8 Влияние осмотического давления на эритроциты
3.2.6 Понятие активности растворенного вещества
Если концентрация растворенного вещества не превышает 0.1 моль/л, раствор неэлектролита обычно считают разбавленным. В таких растворах взаимодействие между молекулами растворителя существенно преобладает над взаимодействием между молекулами растворителя и растворенного вещества, поэтому последним обычно можно пренебречь. В случае более концентрированных растворов такое приближение неправомерно и для формального учета взаимодействия частиц растворителя и растворенного вещества, а также частиц растворенного вещества между собой, вводится эмпирическая величина, заменяющая концентрацию – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
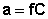
Как правило, коэффициент активности меньше единицы (при малых концентрациях считают f = 1 и а = С). Необходимо отметить, что активность компонента не прямо пропорциональна его концентрации – коэффициент активности уменьшается с увеличением концентрации.
Понижение температуры замерзания растворов



Повышение температуры кипения и
1. Явление повышения температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя называют эбуллиоскопией.
Основной закон эбуллиоскопии выражают уравнением:
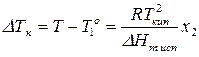
повышение температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя прямо пропорционально мольной доле растворенного вещества.
Очень часто вместо мольных долей используют, например, моляльность. Тогда (164) перепишется: 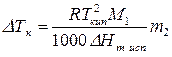
Введем обозначение: 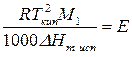
где 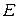
Тогда 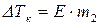
Физический смысл эбуллиоскопической константы: 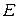
Если молекулы растворенного вещества подвергаются диссоциации, то число моль в растворе увеличивается, тогда:
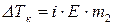
где 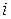
Физико-химические методы анализа, основанные на измерении повышения температуры кипения растворов, называют эбуллиоскопическими.
2. Явление понижения температуры плавления (замерзания) раствора нелетучего вещества по сравнению с температурой плавления (замерзания) чистого растворителя называют криоскопией.
(например, с этой целью посыпают снег солью)
Основной закон криоскопии выражается уравнением:
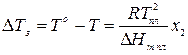
понижение температуры замерзания раствора нелетучего вещества по сравнению с температурой замерзания чистого растворителя прямопропорционально мольной доле растворенного вещества.
Аналогично случаю эбуллиоскопии, мольную долю можно выразить через моляльность. Тогда для разбавленных растворов
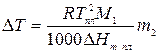
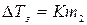
где 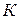
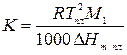
Физический смысл криоскопической постоянной: