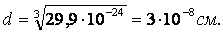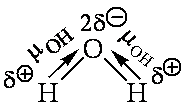что такое кратные связи в органической химии
Кратные связи
Смотреть что такое «Кратные связи» в других словарях:
КРАТНЫЕ СВЯЗИ — хим. связи двухцентрового типа, к рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих К. с., различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов К … Химическая энциклопедия
КРАТНЫЕ СВЯЗИ — двухцентровые хим. связи, к рые в отличие от простой связи образованы более чем одной электронной парой. По числу пар электронов, образующих К. с. различают двойные связи, реализующиеся, напр., в алке нах R2C=CR2 и кетонах R2C=O, и тройные, напр … Естествознание. Энциклопедический словарь
КРАТНЫЕ СВЯЗИ — хим. связи, в образовании к рых участвует более чем одна пара электронов (см. Двойная связь, Тройная связь). В молекуле соединения, содержащей 2 или большее число К. с., эти связи могут примыкать к одному и тому же атому, как, напр., в аллене H2C … Большой энциклопедический политехнический словарь
Кратные единицы — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Кратные приставки для образования производных единиц — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Теория изогнутой химической связи — предложена Лайнусом Полингом на симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (симпозиум состоялся в Лондоне в сентябре 1958 г.). В докладе Полинга дана теория двойной связи как комбинации двух одинаковых изогнутых… … Википедия
Сигма- и пи-связи — (σ и π связи) ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов… … Большая советская энциклопедия
СОПРЯЖЁННЫЕ СВЯЗИ — см. в ст. Кратные связи … Большой энциклопедический политехнический словарь
ТРОЙНЫЕ СВЯЗИ — см. Кратные связи … Естествознание. Энциклопедический словарь
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
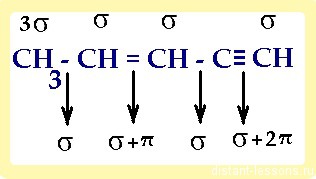
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
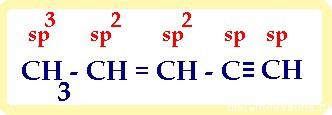
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
КРАТНЫЕ СВЯЗИ
Полезное
Смотреть что такое «КРАТНЫЕ СВЯЗИ» в других словарях:
КРАТНЫЕ СВЯЗИ — двухцентровые хим. связи, к рые в отличие от простой связи образованы более чем одной электронной парой. По числу пар электронов, образующих К. с. различают двойные связи, реализующиеся, напр., в алке нах R2C=CR2 и кетонах R2C=O, и тройные, напр … Естествознание. Энциклопедический словарь
КРАТНЫЕ СВЯЗИ — хим. связи, в образовании к рых участвует более чем одна пара электронов (см. Двойная связь, Тройная связь). В молекуле соединения, содержащей 2 или большее число К. с., эти связи могут примыкать к одному и тому же атому, как, напр., в аллене H2C … Большой энциклопедический политехнический словарь
Кратные связи — тип химической связи, осуществляемой двумя или тремя парами электронов, общими для двух непосредственно соединённых атомов, как, например, в этилене H2C = CH2, формальдегиде H2C = О, ацетилене HC ≡ CH, синильной кислоте Н С ≡ N (подробнее … Большая советская энциклопедия
Кратные единицы — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Кратные приставки для образования производных единиц — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Теория изогнутой химической связи — предложена Лайнусом Полингом на симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (симпозиум состоялся в Лондоне в сентябре 1958 г.). В докладе Полинга дана теория двойной связи как комбинации двух одинаковых изогнутых… … Википедия
Сигма- и пи-связи — (σ и π связи) ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов… … Большая советская энциклопедия
СОПРЯЖЁННЫЕ СВЯЗИ — см. в ст. Кратные связи … Большой энциклопедический политехнический словарь
ТРОЙНЫЕ СВЯЗИ — см. Кратные связи … Естествознание. Энциклопедический словарь
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
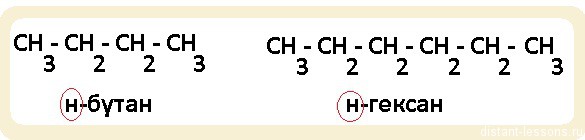
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
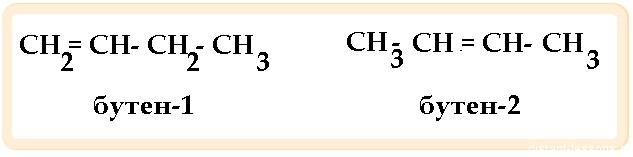
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации :
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии | |
| Алканы | СnH2n+2 | Sp 3 | ||
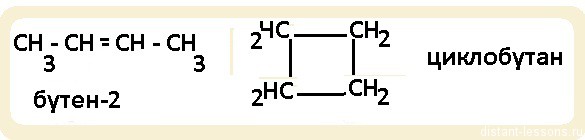
| Циклоалканы | СnH2n | Sp 3 | углеродного скелета, межклассовая (циклоалкалканы изомерны алкенам) | |
| Алкадиены | СnH2n-2 | Sp 2 и Sp 3 | ||
| Бензол и его гомологи | СnH2n-6 | Sp 2 и (Sp 3 — в боковой цепи) | углеродного скелета (в боковых цепях) | |
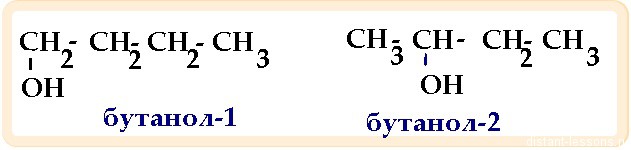
| Алифатические спирты | СnH2n+1OH | Sp 3 | углеродного скелета положения функциональной группы межклассовая — (спирты изомерны простым эфирам) | |
| Ароматические спирты | СnH2n-7OH | Sp 2 и (Sp 3 — в боковой цепи) | ||
| Простые эфиры | СnH2n+1O | Sp 3 | углеродного скелетамежклассовая (простыеэфиры изомерны спиртам) | |
| Альдегиды и кетоны | СnH2nO | Sp 2 (-С=O) и Sp 3 | углеродного скелета — альдегиды изомерны кетонам | |
| Кислоты | СnH2n+1COOH | Sp 2 (-С=O) и Sp 3 | 10 | 41,8 |
| F2 | 36 | 150,6 | ||
| Cl2 | 57 | 238,5 | ||
| Br2 | 46 | 192,5 | ||
| I2 | 36 | 150,6 |
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
В табл. 4.2 рассматривается взаимосвязь между энергией химической связи и свойствами веществ.
Взаимосвязь между энергией химической связи и свойствами веществ
Энергия связи, кДж/моль
Высокие твердость, прочность, температуры кипения и плавления
Высокая пластичность
Низкие твердость, прочность, температуры кипения и плавления
4.3. Длина связи
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро. Так, объем, приходящийся на одну молекулу воды: 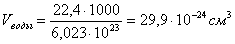
С помощью различных методов физико-химических исследований (например электронографии) определяют d более точно. Исследование длин связей показало, что для данной пары атомов в различных (сходных) соединениях длина связи остается величиной постоянной.
Из длин связей между атомами в молекуле можно вычислить ковалентные радиусы атомов. Если рассмотреть гомоядерные двухатомные молекулы с простой связью, такие как F 2 или С l 2, атомам F и С l можно приписать ковалентные радиусы простых связей, равные половине межъядерного расстояния в соответствующих молекулах. Для элементов, которые не могут образовать двухатомные молекулы с простыми связями, используют другие методы определения радиусов. Так, поскольку расстояние С—С в алмазе и множестве органических молекул найдено равным 1,54+0,01 Å, то ковалентный радиус атома углерода принимают равным 0,77. Чтобы получить ковалентный радиус атома азота, вычитают 0,77 из расстояния С—N в молекуле Н3С— NH 2, при этом получают 0,70. Этим способом можно составить таблицу ковалентных радиусов простых связей (табл. 4.3).
Некоторые ковалентные радиусы простых связей
Ковалентный радиус, Å
Ковалентный радиус, Å
Также можно получить и радиусы кратных связей. Например, для тройной связи радиусы атомов углерода и азота можно вычислить из длин связей в Н—С º С—Н и N º N ; они равны 0,60 и 0,55, причем для длины связи C º N они дают величину 1,15 по сравнению с 1,16, полученной экспериментально. Можно сделать вывод, что чем выше порядок связи между атомами, тем она короче (см. табл. 4.4).
4.4. Кратность связи
Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
4.5. Полярность связи
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl 2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, которая принята равной 4, приведены в табл. 4.5.
У элементов одной и той же подгруппы электроотрицательность с ростом заряда ядра проявляет тенденцию к уменьшению. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.
Относительная электроотрицательность элементов
Так, в молекуле хлористого водорода общая электронная пара смещена в сторону более электроотрицательного атома хлора, что приводит к появлению у атома хлора эффективного отрицательного заряда, равного 0,17 заряда электрона, а у атома водорода такого же по абсолютной величине эффективного положительного заряда. Следовательно, молекула НС1 является полярной молекулой. Ее можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга.
4.6. Типы ковалентных молекул
Электрический момент диполя молекулы представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы.
Многоатомные молекулы также могут быть неполярными при симметричном распределении зарядов, или полярными – при асимметричном распределении зарядов. В последнем случае дипольный момент молекулы будет отличаться от нуля. Каждой связи в многоатомной молекуле можно приписать определенный дипольный момент, характеризующий ее полярность; при этом следует принимать во внимание не только величину дипольного момента, но и его направление, т. е. рассматривать дипольный момент каждой связи как вектор. Тогда суммарный дипольный момент молекулы в целом можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
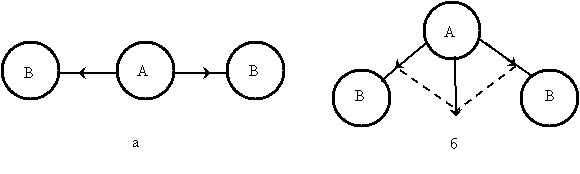
Рис. 4.1. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения: а – линейное строение, б – угловое строение
На рис. 4.1 изображены схемы возможного строения молекулы типа АВ2; векторы дипольных моментов отдельных связей А—В показаны стрелками, направленными от А к В. При линейном строении (рис. 4.1, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 4.1, б) векторная сумма дипольных моментов двух связей А—В отличается от нуля; такая молекула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВ2 позволяет сделать вывод о ее геометрическом строении.
Например, молекула СО2 имеет симметричное линейное строение:
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связей между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
Строение и ожидаемая полярность молекул
Пространственная конфигурация
Примеры
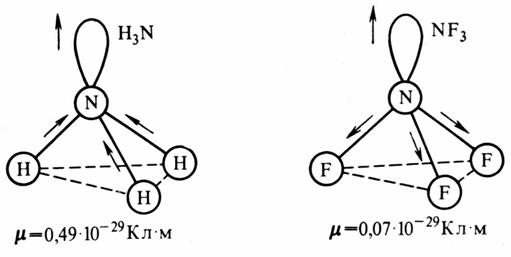
Рис. 4.2. Сложение электрических моментов диполя связывающей и несвязывающей электронных пар молекул H 3 N и NF 3
Это объясняется тем, что в Н3 N направление электрического момента диполя связывающей N—Н и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF 3 моменты связей N—F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 4.2). Значения электрических моментов диполя некоторых молекул приведены в табл. 4.7.
Электрический момент диполя
4.7. Вопросы и задания
4.7.14. Вычислите среднюю энергию связи Н— Se и Н—Те для соединений H 2 Se и Н2Те, если стандартные теплоты образования этих соединений соответственно равны 85,77 и 154,39 кДж/моль. Энергия диссоциации H 2 равна 435,9 кДж/моль.
4.7.17. К каким атомам смещены связывающие электронные облака в следующих молекулах: а) НС1; б) НВг; в) HI ; г) NaH ; д) КН; е) ВеО; ж) N0; з) BN ; и) C 1 F ; к) ClBr ; л) MgS ; м) BeCl 2; н) ВВ r 3; о) СО2; п) OF 2; р) MgF 2; с) А1С13?
4.7.18. Рассчитайте эффективные заряды на атомах следующих молекул: a ) BrCl ; б) BrF ; в) C 1 F ; г) НС1; д) НВ r ; е) HI ; ж) LiBr ; з) LiF ; и) NaCl ; к) Nal ; л) NO ; м) Н2О ( NH 3 ( HNH = 107°).
4.7.19. Как изменяется полярность в ряду молекул: а) HF ; НС1; НВ r ; HI ; б) NH 3; РН3; А sH 3?
4.7.27. Какая молекула, аммиак или арсин имеет больший дипольный момент? Почему?
4.7.28. Почему молекула CCl 4 неполярная, а CH 3 Cl – полярная?