что такое костный блок в позвоночнике
Остеофиты позвоночника
Специалисты ЦМРТ более 15 лет специализируются на диагностике и лечении заболеваний позвоночника. Читайте подробнее на странице Лечение позвоночника.
Остеофиты — патологическое разрастание костной ткани или перерождение ткани связок, образующее заостренные шипы или наросты по краям сегментов позвоночника. Развитию патологии способствуют возрастные дегенеративные изменения, постоянные нагрузки, излишняя масса тела и малоподвижный образ жизни. В качестве последствий больному человеку грозят неврологические осложнения, возникновение сильных болей, потеря подвижности и инвалидность. Для лечения используют консервативный и хирургический методы. Рассмотрим, что это такое остеофиты или краевые костные разрастания тел позвонков, возможно ли приостановить процесс и какое лечение эффективно.
Рассказывает специалист ЦМРТ
Дата публикации: 19 Мая 2021 года
Дата проверки: 26 Мая 2021 года
Содержание статьи
Причины образования остеофитов
Медиками выявлен ряд причин, влияющих на развития остеофитов:
На образования остеофитов влияют недостаток витаминов и недостаточное питание, стрессы, вредные привычки, гормональные сбои, малоподвижный образ жизни и плохая экология. Риск увеличивается с возрастом, поэтому с 40 лет необходимо проходить ежегодные обследования.
Симптомы
Патология дает общие и различающиеся в зависимости от локализации симптомы.
Остеофиты шейного отдела позвоночника — головокружение и головные боли, звон в ушах, иррадиация боли в плечи, руки.
Остеофиты грудного отдела позвоночника — усиление боли при чихании, глубоких вдохах или кашле.
Остеофиты поясничного отдела позвоночника — иррадиация боли в ягодицы, стопы, нарушение мочеиспускания.
К общей симптоматике относят:
При разрастании костной ткани происходит сдавливание спинного мозга и сосудов, нарушение нервной проводимости и питания поврежденных областей, возникают осложнения неврологического характера.
Классификация и виды
Остеофиты классифицируют по локализации, генезу, структуре и форме наростов. По области образования выделяют следующие виды: передние, задние, переднебоковые (клювовидные) и заднебоковые. Последние опасны при локализации в шейном отделе — при разрастании или дорсальном выпячивании диска воздействуют на спинной мозг и нервные окончания.
В зависимости от причины возникновения, различают следующие виды:
Как диагностировать
Диагностика заключена в проведении детального и неврологического осмотра для оценки чувствительности нервных корешков, выявления компрессии.
Аппаратная диагностика включает:
Комплексное обследование поможет составить полную клиническую картину и выработать адекватные меры лечения.
Вертебропластика тел позвонков
Вертебропластика – малоинвазивная хирургическая операция на позвоночнике, подразумевающая введение специального костного цемента в тело позвонка с целью его укрепления. Применяется при лечении остеопороза, опухолевых образований, гемангиом, болевых синдро
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Вертебропластика – малоинвазивная (с минимальным травмированием мягких тканей) хирургическая операция, направленная на укрепление или восстановление тел позвонков. Проводится путем введения в поврежденный позвонок специального костного цемента или полиметилметакрилата.
Процедура выполняется чрезкожно и назначается при компрессионных переломах тел позвонков в результате прогрессирования остеопороза, для предотвращения переломов при опухолевых образованиях или метастазах в позвоночнике, гемангиомах или при травматических повреждениях спины. Все манипуляции проводятся специальными иглами под постоянным контролем действий с помощью микроскопа и рентгенографического оборудования.
Суть методики
Первая вертебральная хирургическая операция была проведена в 1984 году 54-летней женщине, страдающей агрессивной гемангиомой тел позвонков. С тех пор методика нашла широкое применение в лечении патологий, связанных с компрессионными переломами или высоким риском их получения.
В большинстве случаев компрессионный перелом одного тела позвонка при остеопорозе практически не вызывает болевых синдромов (если не сдавливаются нервные корешки), а проявляется только ограничением подвижности патологического сегмента.
Характерные ноющие или острые боли после активных физических действий возникают при травмировании двух или более соседних сочленений. В этой ситуации вертебропластика уже просто необходима, прежде всего, для устранения болевых ощущений и для предотвращения развития дисфункций внутренних органов.
Суть методики состоит в том, что врач чрезкожно вводит в тело пациента металлическую иглу, проходя между остистыми отростками и связками позвоночника, достигает поврежденного позвонка и через щель заполняет его костной смесью. Доступ к разным отделам позвоночника не одинаков и может быть: передним, задним, боковым. Операция проводится под местной анестезией.
Кроме основного материала (полиметилметакрилата) вводимая смесь содержит контрастное вещество, которое светится на рентгеновских снимках и позволяет наблюдать за процессом заполнения полости позвонка и антибиотик. Антибиотик необходим для лучшей адаптации костных тканей к вводимому чужеродному веществу.
Скорость застывания костного цемента составляет 6-11 минут, за которые хирург должен успеть равномерно распределить смесь в патологической зоне. Застывая, вводимое вещество полимеризуется с нагреванием до 70оС, что обеспечивает лучшее сцепление с молекулами костных тканей и оказывает дополнительное дезинфицирующее воздействие на опухолевые клетки (если они присутствуют).
Помимо малой инвазивности, вертебропластика предусматривает активизацию больного уже через 2-3 часа после проведения операции и сокращение пребывания пациента в условиях стационара до 1-2 дней. В минимальные сроки укладывается и реабилитационный период, а по истечении 1 месяца уже возможен полный возврат к нормальной жизни и трудовой деятельности.
Показания к операции
Вертебропластику рекомендуется проводить:
Противопоказания
Несмотря на щадящий режим проведения, вертебропластика, как и все хирургические операции имеет свои противопоказания.
Процедура проведения
Операция вертебропластики не требует никакой специальной подготовки пациента кроме воздержания от приема пищи в день проведения манипуляций.
Больного укладывают на операционный стол, обрабатывают необходимую поверхность кожи антисептическим раствором. Введение иглы в зону пораженного позвонка выполняется под местной анестезией. С профилактическими целями для предотвращения возможного заражения мягких тканей проводится курс терапии антибиотиками.
Все дальнейшие действия проводятся под рентгенографическим контролем. При необходимости, если позвонок поражен опухолью, врач берет на исследование небольшой кусочек биоптата и только после получения результатов анализа операция продолжается.
В большинстве случаев (если существует такая возможность) заполнение цементом зоны поврежденного позвонка целесообразно осуществлять с двух сторон. После того как костный цемент начнет застывать весь инструмент извлекается, разрезанные кожные покровы и ткани ушиваются послойно, накладывается стерильная повязка.
В среднем для заполнения шейных и грудных тел позвонков достаточно 2-3 мл костного раствора, для поясничных (они более массивны) – 3-5 мл. После окончания операции пациенту прописывается полный покой и постельный режим от 1 до 2 часов в зависимости от состояния организма. Действие анестезирующих веществ прекращается примерно в это же время и в зоне проведения манипуляций может возникнуть боль, тянущие или сдавливающие ощущения, которые при необходимости купируются обычными обезболивающими препаратами.
Если проведение вертебропластики было обусловлено прогрессированием остеопороза, то обязательным условием успешного исхода хирургического вмешательства является дальнейшая терапия состояния костных тканей. В противном случае, как свидетельствует статистика, у пятой части всех пациентов, перенесших вертебропластику, образуются повторные компрессионные переломы в течение 1-2 лет после операции.
Возможные осложнения
Как отмечает статистика, чаще всего осложнения после вертебропластики возникают у пациентов, страдающих онкологическими новообразованиями (примерно 10%), гемангиомой позвоночника (2-5%) и остеопорозом костей скелета (1-3%).
Основным нежелательным последствием является неконтролируемый выход цементной смеси в мягкие ткани или позвоночный канал, что может вызвать сдавливание спинного мозга или развитие воспаления. Подобная ситуация требует повторного оперирования.
Достаточно редко при таких вмешательствах отмечаются инфекционные поражения тканей или крови так как проводиться дополнительная терапия антибиотиками и сам цементный материал застывая, нагревается, дезинфицирует окружающие костные ткани и как бы сваривается с ними.
Менее значимые побочные эффекты:
Что такое костный блок в позвоночнике
Статья носит концептуальный характер, и некоторые результаты приводятся без подробного описания и статистического анализа.
Введение
В клинической практике идея первичности неврологических явлений (спастического состояния мышц позвоночника и болей в позвоночнике) перед дегенеративными в костно-хрящевой системе до сих пор не нашла признание. Соответственно, практика предотвращения остеохондроза позвоночника в молодом возрасте, возможная с нашей точки зрения, не только не дошла до экспериментальной проверки, но даже не обсуждается в системе среднего и старшего образования. Наш 10-ти летний опыт позволяет нам предложить идею внедрения в преподаваемую в настоящее время физическую культуру комплексов упражнений, направленных на предотвращение развития остеохондроза позвоночника. Данная работа (серия статей о причинах и закономерностях развития ОП) является одним из этапов теоретического обоснования практики физических и психофизиологических техник, позволяющих, по нашему мнению, предотвращать развитие ОП и связанных с позвоночником неврологических синдромов спине, конечностях и во внутренних органах, а также некоторых хронических заболеваний, вертеброгенного происхождения. Большинство приведённых нами данных хорошо известны в клинической практике и носят иллюстративный характер, подтверждающий идею первичности неврологических процессов перед дегенеративными.
Цель работы
Целью нашей работы является уточнение характеристик мышечных блоков в позвоночнике как причины развития остеохондроза позвоночника.
Методы и обследуемый контингент
Мы применяли следующие методы для исследования состояния мышечного корсета позвоночника: мануальная диагностика, измерение подвижности сегментов позвоночника при функциональных пробах. В обследовании состояния мышечного корсета позвоночника принимало участие 70 человек в возрасте от 7 до 80 лет, прошедшие курсы китайской гимнастики и массажа. Статистические данные по исследованию ДДИП с помощью МРТ были получены по результатам обследований 500 амбулаторных больных КБ №1 УДП РФ.
Результаты
Некоторая часть приведённого ниже материала носит характер наблюдений или иллюстративный характер (единичные наблюдения при диагностике по всем приводимым параметрам), подчеркивающих определённые закономерности, но не удовлетворяющие статистическим критериям доказательной медицины. Приведённые ниже снимки являются иллюстрациями хорошо известных клинических данных, они не обладают новизной, но их присутствие в статье нам показалось необходимым для уточнения представления о возрастной динамике патологий позвоночника.
Исследование состояния структур позвоночника показало наличие в областях, характеризующихся болевыми синдромами с одновременной ограниченностью подвижности ДСП, воспалительных процессов в мышцах позвоночника, гипертрофии мышц позвоночника. В этих областях обнаруживаются дегенеративные изменения в телах позвонков и межпозвонковых дисках, дегенеративные изменения в тканях, формирующих нервный корешок в межпозвонковых отверстиях, дегенеративные изменения нерва, происходящего из нервного корешка, дегенеративные изменения в кровеносных сосудах, питающих позвонки. С помощью радиоизотопных методов обнаружено изменение уровня метаболизма в областях, соответствующих диагностированному патологическому состоянию мышц позвоночника, а также статистическим максимумам в локализации ДДИП.
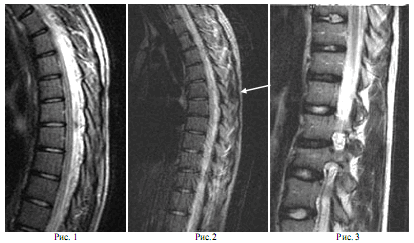
Рис. 1. Пациентка Л.К 17 лет. Мышечный блок Th3-Th9, начальные проявления остеохондроза.
Рис. 2. Пациент А. 23 года с мышечным блоком Th4-Th8. ОстеохондрозTh4-Th5 и Th7-Th8, воспалительный процесс в мышцах (миозит) на уровне Th5-Th8 (затемнённая область отмечена стрелкой)
Рис. 3. Пациентка А.Ю. 21 год. Грыжа Шморля Th10-Th11, остеохондроз Th11-Th12, сколеоз поясничного отдела позвоночника, компрессионный перелом L2
При применении функциональных проб на подвижность каждого из двигательных сегментов позвоночника (ДСП) обнаруживается полное совпадение зон, характеризующихся болевым синдромом, с областями пониженной подвижностью ДСП или с полной неподвижностью ДСП. Однако, обнаружена возрастная закономерность состоящая в том, что с возрастом подвижность позвоночника сильно снижается, а хронические болевые синдромы ослабевают. На МРТ томограммах в мышцах обнаруживаются жировые прослойки, что можно интерпретировать как признак отсутствия сократительной деятельности мышц и фиксацию ДСП фиброзными волокнами, которые не заметны на МРТ томограммах. Мануальная диагностика показывает потерю эластичности мышц позвоночника и в значительной степени утрату сократительной способности. Часто обнаруживаемые ДДИП грыжи, грыжи Шморля, совпадают с областями, характеризующимися болевыми синдромами.
Вместе с тем, лица, прошедшие курс специального массажа позвоночника и гимнастики, избавляются от хронических болей в областях, имеющих клинически значимые дегенеративные изменения, включая грыжи дисков и компрессионные переломы. Развитие остеохондроза имеет четко выраженный возрастной характер, тем не менее, редко, но обследования попадают лица старшего возраста, страдающие болями в позвоночнике, но при этом не имеющие признаков остеохондроза. Мышечные блоки характеризуются следующими особенностями:
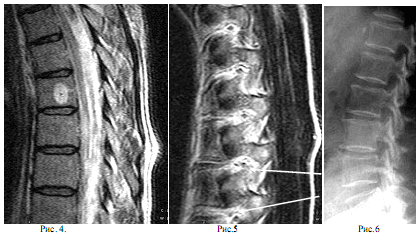
Рис. 5. Пациент А.Ч. 54 года. Уменьшение просвета канала нервного корешка за счёт жировой клетчатки на уровне Th7 и Th8 (отмечено стрелками)
Рис. 6. Пациентка Л. 78 лет с болями в поясничном отделе позвоночника. Рентгеновский снимок поясничного отдела позвоночника. Признаки остеохондроза позвоночника практически отсутствуют
Обсуждение
В клинической практике идея первичности неврологических явлений (спастического состояния мышц позвоночника и болей в позвоночнике) перед дегенеративными в костно-хрящевой системе до сих пор не нашла признание. Соответственно, практика предотвращения остеохондроза позвоночника в молодом возрасте, возможная с нашей точки зрения, не только не дошла до экспериментальной проверки, но даже не обсуждается в системе среднего и старшего образования. Наш 10-ти летний опыт позволяет нам предложить идею внедрения в преподаваемую в настоящее время физическую культуру комплексов упражнений, направленных на предотвращение развития остеохондроза позвоночника. Большинство приведённых нами данных хорошо известны в клинической практике и носят иллюстративный характер, подтверждающий идею первичности неврологических процессов перед дегенеративными. Данная работа является одним (серия статей о причинах и закономерностях развития ОП) из этапов теоретического обоснования практики физических и психо-физиологических техник, позволяющих, по нашему мнению, предотвращать развитие ОП и связанных с позвоночником неврологических синдромов спине, конечностях и во внутренних органах, а также некоторых хронических заболеваний, вертеброгенного происхождения, которые могут быть полностью исцелены методами мануальной терапии, общедоступного массажа и специальной гимнастики.
Выводы
Что такое костный блок в позвоночнике
Формирование индуцированного костного блока является необходимым элементом хирургического лечения повреждений и заболеваний позвоночника, связанных с нарушением стабильности позвоночных двигательных сегментов. Применение костного аутотрансплантата на протяжении последних 40–50 лет является золотым стандартом для формирования костного блока [1]. Однако применение аутотрансплантата имеет свои недостатки и ограничения, связанные с нанесением дополнительной операционной травмы, косметическим дефектом в зоне забора трансплантата, возможными воспалительными осложнениями [2]. За последнее десятилетие разработано достаточное число материалов, являющихся альтернативой аутотрансплантату и постоянно ведется работа ученых в данном направлении. Все последние открытия в медицине, биологии, химии, металловедении ложатся в основу создания новых трансплантатов, становящихся альтернативой аутокости.
Целью данной работы является обзор современных методик формирования индуцированного костного блока применимо к хирургии позвоночника.
Результаты исследования и их обсуждение
Аутотрансплантат губчатой кости содержит гидроксиапатит и коллаген, которые определяют его остеокондуктивные свойства, в то время как стромальные клетки имеют остеогенный потенциал. Губчатая кость и окружающая гематома содержат костные морфогенетические белки (BMP) и преобразующий b-фактор роста (TGF-β), которые участвуют в процессах регенерации. Компактная кость обладает слабо выраженным остеокондуктивным эффектом, но способна выдерживать механическую нагрузку. Аутотрансплантат имеет три характеристики трансплантата для идеального формирования индуцированного костного блока, а именно: способность стимулировать остеогенез, способность стимулировать дифференциацию мезенхимальных клеток-предшественников и остеобластов (остеоиндуктивность) и способность материала играть роль пассивного матрикса для роста новой кости (остеокондуктивность) [2, 13]. Аутотрансплантат имеет ряд преимуществ по отношению к другим способам замещения костной ткани: относительно редко встречаются случаи миграции и проблемы с биосовместимостью, отсутствие риска передачи болезней [5]. По этим причинам использование аутотрансплантата остается золотым стандартом при проведении спондилодеза.
Аллотрансплантат кости обычно используется как альтернатива аутотрансплантату. Основное преимущество аллотрансплантатов – отсутствие осложнений, связанных с забором костной ткани, и снижение времени оперативного вмешательства [10]. Недостатками является риск передачи от донора к реципиенту различных заболеваний бактериальной или вирусной этиологии [7], а также необходимость проведения серологического скрининга и стерилизации трансплантатов перед использованием. Костные аллотрансплантаты отличаются медленной остеоинтеграцией, возможностью развития реакции гистосовместимости, частым развитием хронического гранулематозного воспаления, высокой стоимостью. С целью минимизации рисков аллотрансплантаты подвергают интенсивной обработке, что значительно уменьшает остеоиндуктивные свойства и механическую прочность почти на 50 %, хотя риск инфицирования реципиента всё же полностью не устраняется. Свойства аллотрансплантатов могут варьировать в широких пределах, и связано это в первую очередь с методами забора и подготовки трансплантата. Различные виды обработки аллотрансплантата могут вариативно влиять на его структурные и биологические характеристики. Включение аллотрансплантата происходит путем процесса, аналогичного тому, который наблюдается с аутотрансплантатом, но более медленно и менее полно. Остеокондуктивные матрицы не содержат остеогенных клеток или остеоиндуктивных факторов, поэтому часто используются совместно с ВМР. Так как материалы являются хрупкими, то необходима их защита от чрезмерных биомеханических сил до окончательного формирования костного блока. Также, в отличие от синтетических протезов, аллотрансплантаты трудно стандартизировать в виду неоднородности доноров, а содержание костных банков является дорогостоящей процедурой. Гомоаллотрансплантат выпускается в двух видах: минерализованный и деминерализованный. Минерализованный аллотрансплантат считается не остеогенным, слабо остеоиндуктивным, высоко остеокондуктивным и доступен в свежем, замороженном или лиофилизированном виде. Деминерализованный аллотрансплантат – единственный аллотрансплантат с выраженным остеоиндуктивным эффектом, выраженность эффекта зависит от способа забора и обработки. Главной проблемой применения трансплантата являются неразработанные критерии качества продукта и недостаточная информация о продукте. В одном из немногих доступных исследований приводится сравнение замороженного минерализованного аллотрансплантата и деминерализованного аллотрансплантата с аутотрансплантатом, при этом полученные результаты были сопоставимы в группах, но не достигли статистической значимости [1, 7].
Керамика на основе фосфатов. Керамика представляет собой кристаллическую структуру, состоящую из неорганических неметаллических минеральных солей, полученную при высоких температурах. Изменения методики в процессе обработки керамики изменяют окончательную структуру и химический состав, а следовательно, и ее физиологические свойства. Керамика является привлекательной в качестве заменителя трансплантата, так как при её использовании исключаются осложнения со стороны донорского участка, проявляется биосовместимость, отсутствует риск передачи инфекции, и её запасы практически безграничны. C 1890 г. кальций-фосфатные материалы используются в медицине. Albee в 1920 г. впервые доказал, что трикальций-фосфат стимулирует образование кости. Кальций-фосфатные материалы, являясь химическими аналогами компонентов костной ткани, стимулируют биологические реакции, схожие с процессом ремоделирования костей. Резорбция данных материалов не повышает уровня кальция или фосфатов в моче и сыворотке [15]. Трикальцийфосфат (ТКФ) и гидроксиапатиты (ГА) являются наиболее изученными материалами для использования. Ввиду их химико-физических сходств с фазой минерализации кости [11] они обеспечивают отличный остеокондуктивный каркас для регенерации кости. ТКФ с молярным соотношением Ca:P 1,5 резорбирует слишком быстро, ГА с соотношением Ca:P 1,67 резорбирует слишком медленно, поэтому для защиты новой кости от механических воздействий оно требует модификации [6]. Двухфазные фосфаты кальция (ДФК), в которых соединяется 40 % ТКФ с 60 % ГА, могут обеспечить больший физиологический баланс между механической поддержкой и резорбцией. Yamada и др. провели гистологическое исследование β-ТКФ, ГА для того, чтобы определить, какой из них более подвержен остеокластной активности и больше подходит для ремоделирования кости. Через 2 дня культивирования клеток была замечена резорбция чистого β-ТКФ и ДФК с коэффициентом ГА/β-ТКФ 25/75, но отсутствовала резорбция ДКФ 75/25 или чистого ГА. Примечательно, что ДФК 25/75 резорбировался интенсивней, чем чистый β-ТКФ, возможно, из-за ингибирования кальцием остеокластов, и формировались полости резорбции, схожие с полостями нормальной кости. Данный факт даёт основание предположить, что ДФК является более естественным имплантатом, чем отдельно взятые β-ТКФ или ГА. Биомеханическим требований отвечает ДКФ 60/40, он и используется клинически [16].
Коралловый гидроксиапатит. В процессе гидротермальной трансформации кораллового скелета (карбонат кальция) с участием фосфатного составляющего вырабатывается гидроксиапатит кальция (известный как коралловый ГА), и полностью удаляется иммуногенный протеин. Получение кораллового ГА являлось непрогнозируемым научным достижением, основывавшемся на сходстве строения некоторых видов кораллов со строением кости. Два вида кораллов с подходящей пористостью были выбраны для производства, они имеются в продаже под названием ProOsteon 200 (50 % пористость) или 500 (65 % пористость), в соответствии с размером их пор в микронах. Эти два продукта имеют сходство с трубчатой или губчатой костью соответственно [14]. Wittenberg и др. обнаружили, что ProOsteon 200 такой же прочный, как и компактно-губчатый аутотрансплантат из гребня подвздошной кости [17].
Полиэфир-эфиркетон (ПЭЭК). Является рентгеннегативным полукристаллическим термопластиком, сочетает в себе прочность жесткость, твердость и биосовместимость, также износостойкость и возможность повторного использования после стерилизации. Является безопасным, биосовместимым и стабильным полимером, имеющимся в различных формах, которые предлагает практически неограниченные дизайнерские решения. Одной из основных проблем ортопедической хирургии является несоответствие между жесткостью кости и металлическими или керамическими имплантатами, в то время как жесткость ПЭЭК может быть адаптирована. Его прочность может быть дополнительно увеличена путем добавления частиц или волокон углерода. Вариация жесткости при использовании коротких углеродных волокон в пределах 4–18 ГПа, прочность зависит от полимерной основы и варьирует в пределах 100–230 МПа. Свойства полимера не меняются при высоких температурах, выдерживают длительную экспозицию при +230 и короткую экспозицию при + 300. Полимер также показывает высокую химическую стойкость, материал не ухудшал свои свойства после воздействия смоделированных биологических сред в течение 30 дней [8, 12].
Полиметилметакрилат (ПММА). В ходе двух проспективных рандомизированных исследований было выявлено, что ПММА не имеет определённых клинических преимуществ перед аутотрансплантатом. Рентгенологически Barlocher и др. обнаружили, что ПММА не индуцировал сращения у всех 24 пациентов за 12 месяцев [2]. Van den Bent и др. обнаружили, что ПММА способствовал меньшему количеству костных блоков, чем дискотомия с использованием аутокости, также возникали случаи смещения трансплантата в смежный позвонок, и с ПММА было связано возникновение фиброзного уплотнения окружающей кости [7].
Танталовые имплантаты. Имплантат пористой структуры, полученный из чистого тантала, с 1997 года активно применяется в травматологии и ортопедии, нейрохирургии в качестве имплантата, обладающего остеокондуктивными свойствами. Отличительные особенности данного имплантата ‒повышенная пористость и более свободное сообщение между ячейками. Конструкции из тантала обладают достаточной жесткостью и трением, что позволяет применять имплантаты без дополнительной фиксации. Гистологически доказано быстрое врастание костной ткани в пористый тантал [9], а также стимуляция им остеобластов [3].
На современном этапе развития костнозамещающих технологий существует несколько перспективных вариантов материалов, способных заменить аутотрансплантат в будущем, однако на данный момент нет возможности полного отказа от использования аутотрансплантатов. Перспективными материалами, требующими дальнейших исследований и оценки клинического применения, являются керамики на основе фосфатов, полиэфир-эфиркетон и имплантаты на основе пористого тантала.
Рецензенты:
Щеколова Н.Б., д.м.н., профессор кафедры травматологии, ортопедии и ВПХ, ГБОУ ВПО ПГМА им. Е.А. Вагнера Минздрава РФ, г. Пермь;
Борзунов И.В., д.м.н., ученый секретарь Ученого совета, ГБОУ ВПО «Уральская государственная медицинская академия Минздрава РФ», г. Екатеринбург.