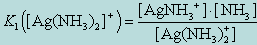что такое константа устойчивости комплексного соединения
Устойчивость комплексных соединений в растворе
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация):
[MLn] ↔ M + nL
Заряды для упрощения опущены, а ионы представлены в негидрированном виде.
Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Константа устойчивости и константа нестойкости комплекса
При смешивании двух растворов, содержащих ионы металла и лиганд, произойдет ступенчатое комплексообразование, т.е. последовательное присоединение лиганда к металлу:
| M + L↔[ML] | K1 = [ML]/([M]·[L]) |
| ML + L↔[ML2] | K2 = [ML2]/([ML]·[L]) |
| ……………… | ……………….. |
| MLn-1 + L↔[MLn] | Kn = [MLn]/([MLn-1]·[L]) |
Присоединение лиганда к металлу будет происходить до тех пор, пока количество лигандов не станет равным координационному числу комплексообразователя. Устанавливается динамическое равновесие, при котором происходит как образование комплекса, так и его распад.
Каждой ступени также соответствует свое состояние равновесия, которое характеризуется соответствующей константой равновесия. Константы K1, K2…Kn называют ступенчатыми константами устойчивости (образования) комплексов.
Процесс комплексообразования можно выразить и через так называемые суммарные (кумулятивные) константы устойчивости – βi(обр):
| M + L↔[ML] | β1 = K1 = [ML]/([M]·[L]) |
| M + 2L↔[ML2] | β2 = K1· K2 = [ML2]/([M]·[L] 2 ) |
| ……………… | ……………….. |
| M + nL↔[MLn] | βn = K1· K2·…· Kn = [MLn]/([M]·[L] n ) |
Константа βn – общая константа образования комплекса.
Константы устойчивости характеризуют прочность комплекса в растворе, которая увеличивается с ростом их значения.
Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов:
| [MLn] ↔ MLn-1 + L | Kн1 = 1/Kn = ([MLn-1]·[L])/[MLn] |
| [MLn-1] ↔ MLn-2 + L | Kн2 = 1/Kn-1 = ([MLn-2 ]·[L])/[MLn-1] |
| ……………… | ……………….. |
| [ML] ↔ M + L | Kнn = 1/K1 = ([M]·[L])/[ML] |
Константы Kн1, Kн2… Kнn называют ступенчатыми константами нестойкости (неустойчивости) комплексов. Понятно, что ступенчатые константы нестойкости это обратные величины соответствующих ступенчатых констант устойчивости.
Процесс диссоциации комплекса, также как и процесс комплексообразования, можно охарактеризовать с помощью суммарных равновесий. В этом случае они называются суммарными (кумулятивными) константами нестойкости:
| [MLn] ↔ MLn-1 + L | βн1 = Kн1= ([MLn-1]·[L])/[MLn] |
| [MLn] ↔ MLn-2 + 2L | βнn2 = Kн1· Kн2 = ([MLn-2]·[L] 2 )/[MLn] |
| ……………… | ……………….. |
| [MLn] ↔ M + nL | βнn = Kн1· Kн2·…· Kнn = ([M]·[L] n )/[MLn] |
Суммарная константа βнn для комплекса MLn называется общей константой нестойкости (неустойчивости) комплекса. Общая константа нестойкости является обратной величиной общей константы устойчивости:
Как и константа устойчивости, константа нестойкости является количественным показателем устойчивости комплексного соединения в растворе. Прочность комплекса тем больше, чем меньше значение константы нестойкости.
Факторы, влияющие на устойчивость комплекса:
Mn(II) – Fe(II) – Co(II) – Ni(II) – Cu(II).
Природа лиганда и координационное число здесь никакого влияния не оказывают. Данный ряд называют “естественный порядок устойчивости”.
Стерический эффект — пространственное окружение донорных атомов лиганда, также влияет на устойчивость комплекса.
Что такое константа устойчивости комплексного соединения
В растворах комплексных соединений могут происходить разнообразные сложные превращения, определяемые природой как самого комплексного соединения, так и растворителя.
Это, во-первых, диссоциация на комплексные и внешнесферные ионы, затем – диссоциация комплексного иона или нейтрального комплекса, сопровождаемая замещением лиганда во внутренней сфере на молекулы растворителя.
Кроме того, комплексы могут участвовать в разнообразных окислительно-восстановительных процессах, если в состав комплексного иона или растворителя входят ионы или молекулы с ярко выраженными окислительными или восстановительными свойствами.
Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам относят прежде всего внутрикомплексные соединения (или хелаты), затем – карбонилы металлов и p -комплексы и некоторые другие.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы. Они ведут себя в разбавленных растворах как сильные электролиты: диссоциация протекает моментально и практически нацело. Примеры такого рода:
Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет нацело, рН > > 7). Пример соединения этого типа – гидроксид тетраамминцинка(II):
Комплексные соединения с внешнесферными катионами водорода (типа гексафторосиликата водорода или тетрафторобората водорода) в водном растворе нацело подвергаются протолизу. Они являются сильными кислотами:
Однако на отщеплении внешнесферных ионов процесс электролитической диссоциации не заканчивается. Комплексные ионы, в свою очередь, подвергаются обратимой электролитической диссоциации, уже как слабые электролиты, по схеме :
[ML n ] 
Для упрощения записи в качестве примера взят незаряженный комплекс, а продукт диссоциации представлен в негидратированном виде.
M + L 
[ML] + L 
[ML 2 ] + L 
Процесс комплексообразования завершается, когда число присоединившихся монодентатных лигандов L станет равным координационному числу комплексообразователя M. При этом устанавливается динамическое равновесие, поскольку наряду с образованием комплексов идет и их диссоциация.
Состояние равновесия реакций комплексообразования можно охарактеризовать ступенчатой константой образования K i (обр) комплекса, а именно:
M + L 
[ML] + L 
Для n-ой ступени комплексообразования ступенчатая константа образования K n равна:
Существует и другой способ описания равновесия при комплексообразовании – с помощью полных (или суммарных) констант образования данного комплекса b i (обр):
M + L 
M + 2 L 
M + 3 L 
M + n L 
Полная константа образования комплекса b n (обр) характеризует устойчивость комплексного соединения: чем больше значение b n (обр), тем более устойчив комплекс данного состава. Например, сравнивая константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона:
Индекс n у константы образования комплекса равен координационному числу центрального атома в том комплексном соединении, которое оценивается.
Нетрудно заметить, что величина b n (обр) связана со ступенчатыми константами образования Ki (обр) соотношением:
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
[ML] 
[ML 2 ] 
и общих (суммарных) констант нестойкости комплексов:
[ML] 
[ML 2 ] 
[ML 3 ] 
[ML n ] 
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
Чем больше концентрация хлоридных ионов, тем с большим координационным числом образуется комплексное соединение. Как только будет достигнуто максимально возможное для данного комплексообразователя координационное число, образование новых комплексных соединений приостанавливается, и при дальнейшем увеличении концентрации лиганда наблюдается постепенное исчезновение в растворе комплексных частиц с меньшими координационными числами.
Таким образом, полная константа образования дает возможность судить об отсутствии склонности комплекса к полной диссоциации, а ступенчатая константа образования свидетельствует об устойчивости отдельных форм комплексных ионов или нейтральных комплексов.
Cd 2+ + NH 3 
[Cd(NH 3 )] 2+ + NH 3 
[Cd(NH 3 ) 2 ] 2+ + NH 3 
[Cd(NH 3 ) 3 ] 2+ + NH 3 
[Cd(NH 3 ) 4 ] 2+ + NH 3 
[Cd(NH 3 ) 5 ] 2+ + NH 3 
Однако бывают и исключения, например, уже указанные выше хлоридные комплексы
Среди причин закономерного уменьшения значений ступенчатых констант образования с увеличением числа лигандов прежде всего выделяют возрастание пространственных затруднений в размещении вокруг комплексообразователя все большего числа лигандов и электростатическое отталкивание одноименно заряженных лигандов.
Устойчивость комплексных соединений зависит от прочности химической связи между комплексообразователем и лигандами, поэтому в зависимости от природы последних значение константы образования меняется в широких пределах.
Константы образования некоторых комплексов (25 ° С)
Реакции комплексообразования
Co 2+ + 6 NH 3 
Ag + + 2 NH 3 
Cu 2+ + 4 NH 3 
Co 3+ + 6 NH 3 
Результаты многочисленных исследований показали, что устойчивость комплексных соединений в ряду комплексообразователей марганец(II) – железо(II) – кобальт(II) – никель(II) – медь(II) увеличивается, независимо от природы лиганда и координационного числа. Это так называемый “естественный порядок устойчивости”.
Только в немногих случаях обнаружены отклонения от этого ряда. Расположить подобным образом другие комплексообразователи оказалось невозможным.
Точно так же при растворении в воде двойной соли – алюмоцезиевых квасцов состава происходит полная диссоциация:
И в растворе, и в кристаллическом состоянии (в узлах кристаллической решетки) у этого соединения обнаруживаются аквакомплексы и Поэтому координационную формулу этого соединения следует записывать как а называть его сульфатом гексаакваалюминия-гексааквацезия. Что же касается карналлита, его точное название хлорид гексааквамагния-калия, а формула –
Таким образом, различие между комплексными соединениями и двойными солями состоит в том, что последние не координируют или очень слабо координируют анионные лиганды, и носит чисто количественный характер – они отличаются по значениям полных констант образования.
Устойчивость комплексных соединений
Ионы, находящиеся во внешней сфере комплексных соединений, связаны с комплексным ионом в основном силами электростатического взаимодействия. Комплексное соединение при электролитической диссоциации образуют комплексные ионы и ионы внешней сферы как сильные электролиты, например:
Na2[Ni(CN)4] ® 2Na+ + [Ni(CN)4]2–
[Ni(NH3)6]SO4 ® [Ni(NH3)6]2+ + SO42–
Комплексные соединения могут быть неэлектролитами. Например, [PtCl2(NH3)2] – неэлектролит, так как содержит только внутреннюю сферу.
Комплексные ионы подвергаются диссоциации как слабые электролиты. Упрощенно диссоциацию внутренней сферы можно представить таким образом:
[Ni(NH3)6]2+ « Ni2+ + 6NH3
Применяя закон действующих масс к обратимым процессам диссоциации комплексных ионов, получим выражения константы нестойкости комплексов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного иона. Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплекс [Ni(CN)4]2– прочнее, чем [Ni(NH3)6]2+, так как
1,8•10–14 Читайте также: Химическая кинетика: скорость реакций и методы ее регулирования
Молекулярное уравнение получения [Zn(NH3)4]SO4:
ZnSO4 + 4NH4OH = [Zn(NH3)4]SO4 + 4H2O
Zn2+ + 4NH4OH = [Zn(NH3)4]2+ + 4H2O
Молекулярное уравнение получения Na2[Zn(CN)4]:
ZnSO4 + 4NaCN = Na2[Zn(CN)4] + Na2SO4
Пример. Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях:
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число равно числу лигандов, координированных вокруг комплексообразователя. Степень окисления комплексообразователя определяется из того, что алгебраическая сумма степеней окисления всех атомов и молекул в соединении равна нулю. Заряды нейтральных молекул равны нулю.
Устойчивость комплексных соединений. Константа нестойкости
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
Вторая стадия:1. Ag(NH3)2] + 
2. AgNH3+ 
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере

Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости :

Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
Значения констант нестойкости и устойчивости приводятся в справочниках по химии
Напишите формулы комплексных частиц (с указанием их заряда), которые могут быть образованы ионами-комплексообразователями и лигандами.
К/ч К/ч
Al3+ 4,6 Ag+ 2
Zn2+ 4 Hg+ 2
Fe2+ 4,6 Hg2+ 4
Fe3+ 4,6
Один из способов получения к/с основан на введении в хим систему избытка лигандов для создания соотношения соответствующего координационному числу. На этом принципе основаны реакции растворения некоторых осадков, в т.ч. амфотерных гидроксидов в растворах щелочей.
Zn(OH)2(осадок)+2KOH=K2[Zn(OH)4]
Zn(OH)2+2OH-=[Zn(OH)4]2-
AlCl3+3KOH=↓Al(OH)3+3KCl
Al(OH)3+KOH=K[Al(OH)4]
Al(OH)3+3KOH=K3[Al(OH)6]
HgJ2(оадок)+2KJ=K2[HgJ4]-2 – тетраиодогидроаргат(II)калия
HgJ2+2J-=[HgJ4]2-
Комплексным соединениям присущи многие свойства обычных соединений (н-р: реакции обмена с участием двух солей 3FeCl2+2K3[Fe(CN)6]=Fe3[Fe(CN)6]+6KCL
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6] )
Для к/с характерны специфические реакции связанные с замещением одного лиганда другим.
[Cu(H2O)4]SO4+4NH3=[Cu(NH3)4]SO4+4H2O
[Cu(H2O)4]2++4NH3=[Cu(NH3)4]+4H2O
CN->NO2->NH3>CNS->H2O>OH->Cl->Br->J- *
Способность к замещению одного лиганда другим связано с прочностью комл ионов. К/п компл иона возрастает с увеличением силы лиганда (см ряд выше *). Лиганды расположенные в левой части назыв сильными, в правой – слабыми (относительно середины).
При растворении в воде к/с распадаются по типу сильных электролитов на компл ионы и противоположно заряженные ионы внешней среды.
K2Zn(CN)4]→2K++[Zn(CN)4]2-
[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
В водных растворах этот процесс протекает практически полностью (распад электролита на ион).
[Zn(CN)4]2-←→Zn2++4CN- *
Для характеристики прочности компл иона введено понятие: константы нестойкости Кн, которая представляет собой Кн реакции диссоциации ком иона *
Kн=(CZn2+C4CN-)/C[Zn(CN)4] где С – концентрация, Кн-приводится в справочниках. Чем меньше величина Кн, тем прочнее данный компел ион.
Задача 12.
На основании стандартных энтальпий образования ΔН˚298 и абсолютных энтропии S˚298 веществ определите: 1) ΔН˚298 реакции, ΔS˚298 реакции и ΔG˚298 реакции. Сделайте вывод о термодинамической вероятности протекания реакции при стандартных условиях; 2) температуру, при которой константа равновесия реакции равна единице (ΔG реакции равна нулю). Влиянием температуры на ΔН и ΔS реакции пренебречь; 3) область температур, в которой протекание данной реакции термодинамически вероятно. Расчеты провести по уравнениям реакций, приведенным в таблице.
| Вариант | Уравнение реакции |
| СО(г) + Н2О(ж) = СО2(г) + Н2(г) | |
| Fe3O4 + СО = 3FeO + СО2 | |
| 2С2Н2 + 5О2 = 4СО2 + 2Н2О | |
| Н2 + СО2 = СО + Н2О | |
| СО + 3Н2 = СН4 + Н2О | |
| С2Н4 + 3О2 = 2СО2 + 2Н2О | |
| 4NH3 + 5О2 = 4NO + 6Н2О | |
| NH3 + HC1 = NH4C1 | |
| 2Н2О2 = 2Н2О + О2 | |
| 2SO2 + О2 = 2SO3 | |
| SO2 + NO2 = SO3 + NO | |
| CH4 + 4C12 = CC14 + 4HC1 | |
| SO2 + 2H2S = 3S + 2H2O | |
| 2H2S + 3O2 = 2H2O + 2SO2 | |
| CaO + 3C = CaC2 + CO | |
| 4NH3 + 3O2 = 6H2O + 2N2 | |
| CS2 + 3O2 = CO2 + 2SO2 | |
| Fe2O3 + 3CO = 2Fe + 3CO2 | |
| 2H2S + SO2 = 3S + 2H2О | |
| 2CH3OH + 3O2 = 2CO2 + 4H2O | |
| PbS + PbSO4 = 2Pb + 2SO2 | |
| 2C2H6 + 7O2 = 4CO2 + 6H2O | |
| CH4 + 2O2 = CO2 + 2H2O | |
| 4HC1 + О2 = 2H2О + 2C12 | |
| 2PH3 + 4O2 = P2O5 + 3H2O |
Скорость химических реакций
A.A. Беляев, В.В. Загорский, E.A. Менделеева, Д.И. Менделеев, В.В. Миняйлов,
Н.И. Морозова, A.E. Муралев
Варианты 1-8. Вычислите, во сколько раз увеличивается скорость химической реакции при повышении температуры на 

| Вариант |  |  | Вариант |  |  |
Варианты 9-16. В таблице приведен температурный коэффициент химической реакции 
| Вариант |  | x | Вариант |  | x |
| 2,5 | |||||
| 2,5 | 12,5 |
Скоростью химической реакциипо компоненту А называется производная
n – число молей, V-объем системы, t –время
Если объем системы не зависит от времени, его можно внести под знак производной и записать выражение
Варианты 17-25. На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в n раз при данном значении 
| Вариант | n |  | Вариант | n |  |
| 2,5 | |||||
| 2,5 |
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:
где 




Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 o C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы:
Другими словами, скорость гомогенной реакции равна изменению молярной концентрации какого-либо из реагирующих веществ за единицу времени. Скорость реакции – величина положительная, поэтому в случае выражения ее через изменение концентрации продукта реакции ставят знак «+», а при изменении концентрации реагента знак «–».
Напишите выражение константы равновесия обратимой реакции, приведенной в таблице. Определите, в какую сторону сместится равновесие обратимой реакции: а) при повышении температуры (р = const); б) при увеличении давления (Т = const).
| Вариант | Уравнение реакции | ΔН˚р,кДж |
| СОС12 ⇄ СО + С12 | 112,5 | |
| СО2 + 2Н2 ⇄ СН3ОН(г) | 193,3 | |
| 2N2O ⇄ 2N2 + О2 | -163,1 | |
| 2NO + Cl2 ⇄ 2NOC1 | -73,6 | |
| 3О2 ⇄ 2О3 | 184,6 | |
| СО + Н2О(г) ⇄ СО2 + Н2 | -41,2 | |
| Н2 + I2(г) ⇄ 2HI | 51,9 | |
| N2 + О2 ⇄ 2NO | 180,7 | |
| 2Н2 + О2 ⇄ 2Н2О(г) | 483,7 | |
| 2СО + О2 ⇄ 2СО2 | -566 | |
| N2O4 ⇄ 2NO2 | ||
| 2NO + О2 ⇄ 2NO2 | -113 | |
| 2SO3 ⇄ 2SO2 + О2 | 196,6 | |
| N2 + 3Н2 ⇄ 2NH3 | -92,5 | |
| 2НВr ⇄ Н2 + Вr2(г) | 72,5 | |
| 4НС1 + О2 ⇄ 2Н2О(г) + 2С12 | -114,5 | |
| N2 + 2О2 ⇄ 2NO2 | 67,5 | |
| С + Н2О(г) ⇄ СО + Н2 | ||
| 2NH3 ⇄ N2 + 3Н2 | 92,5 | |
| 2SO2 + О2 ⇄ 2SO3 | -196,6 | |
| 2NOC1 ⇄ 2NO + С12 | 73,6 | |
| Н2 + СО2 ⇄ СО + Н2O(г) | 41,2 | |
| СО + С12 ⇄ СОС12 | -112,5 | |
| 2NO2 ⇄ N2O4 | -58 | |
| 2H2S + 3О2 ⇄ 2Н2О + 2SO2 | -561,1 |
Влияние Т на смещение химического равновесия: при повышении Т Кр уменьшается для экзотермических реакций и увеличивается для эндотермических.
Влияние р на смещение химического равновесия: если соотношение неравновесных парциальных давлений (в соответствии с з.д.м.) меньше Кр, то равновесие сдвигается в сторону образования продуктов, если больше Кр, то равновесие сдвигается в сторону образования реагентов.
Вычислите: константу равновесия обратимой реакции, исходные и равновесные концентрации компонентов в системах (величины, которые нужно вычислить, обозначены в таблице через х).