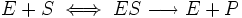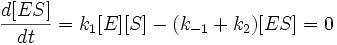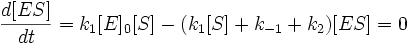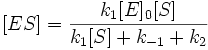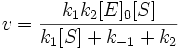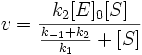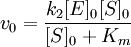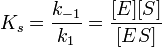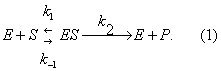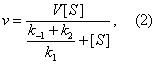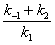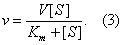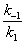что такое константа михаэлиса
Константа Михаэлиса
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
Уравнение имеет вид:
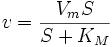
Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скорости ферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющем большинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент и продукт много больше, чем константа скорости образования ферменто-субстратного комплекса из фермента и субстрата. Иными словами:
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакции находится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Таким образом:
Преобразуем это к виду:
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
Выразим отсюда концентрацию фермент-субстратного комплекса:
Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собой скорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
Разделим числитель и знаменатель на k1. В результате:
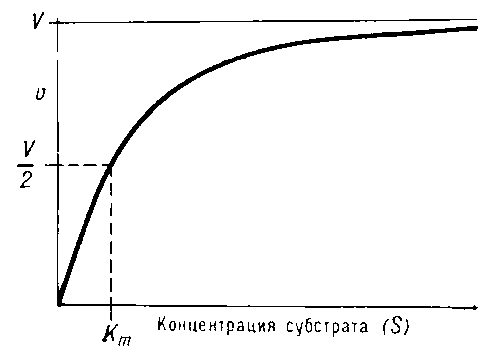
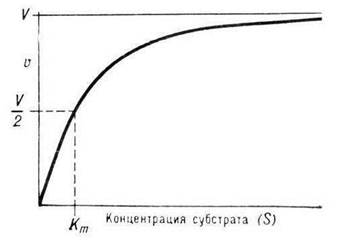
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическая константа (с размерностью концентрации), которая равняется такой концентрации субстрата, при которой скорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогда выражение для начальной скорости реакции будет выглядеть так:
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливается равновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативной реакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях:
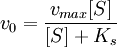
По значению KS можно судить о химическом сродстве субстрата к ферменту.
Полезное
Смотреть что такое «Константа Михаэлиса» в других словарях:
константа Михаэлиса — Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
константа Михаэлиса — Michaelis constant, Km константа Михаэлиса. Kинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату.… … Молекулярная биология и генетика. Толковый словарь.
Константа Михаэлиса — КОНСТÁНТА МИХАЭ́ЛИСА, Km, один из кинетических параметров ферментативной реакции. Численно равна концентрации субстрата, при к рой скорость реакции составляет половину от максимальной. Является функцией неск. констант скорости; в нек рых случаях… … Биологический энциклопедический словарь
Михаэлиса константа — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Михаэлиса константа — один из важнейших параметров кинетики ферментативных реакций, введённый немецкими учёными Л. Михаэлисом (L. Michaelis) и М. Ментен в 1913; характеризует зависимость скорости ферментативного процесса от концентрации субстрата. Согласно… … Большая советская энциклопедия
Уравнение Михаэлиса — Ментен — Диаграмvа скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Уравнение Михаэлиса-Ментен — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Уравнение Михаэлиса — Диаграмма скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Ферментативный инигибитор — ≠ Рис. 1: Общая схема ингибирования фермента Ферментативный ингибитор вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы. Обратимые делятся на … Википедия
Михаэлиса константа
Полезное
Смотреть что такое «Михаэлиса константа» в других словарях:
Михаэлиса константа — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
константа Михаэлиса — Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
Константа Михаэлиса — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
константа Михаэлиса — Michaelis constant, Km константа Михаэлиса. Kинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату.… … Молекулярная биология и генетика. Толковый словарь.
Константа Михаэлиса — КОНСТÁНТА МИХАЭ́ЛИСА, Km, один из кинетических параметров ферментативной реакции. Численно равна концентрации субстрата, при к рой скорость реакции составляет половину от максимальной. Является функцией неск. констант скорости; в нек рых случаях… … Биологический энциклопедический словарь
Уравнение Михаэлиса — Ментен — Диаграмvа скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Уравнение Михаэлиса-Ментен — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Уравнение Михаэлиса — Диаграмма скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Субстраты — 1) в биологии основа (предметы или вещества), к которой прикреплены «сидячие» животные или растительные организмы, в том числе микроорганизмы. 2) В биохимии вещества, на которые действуют Ферменты. Термин «С.» употребляют для… … Большая советская энциклопедия
СОДЕРЖАНИЕ
Модель
При определенных допущениях, например, когда концентрация фермента намного меньше концентрации субстрата, скорость образования продукта определяется выражением
Приложения
Значения параметров сильно различаются между ферментами:
| Фермент | K M <\ Displaystyle К _ <\ mathrm  (М) (М) | k Кот <\ displaystyle k _ <\ text  (с −1 ) (с −1 ) | k Кот / K M <\ Displaystyle к _ <\ текст <кошка>> / К _ <\ mathrm  (M −1 с −1 ) (M −1 с −1 ) |
|---|---|---|---|
| Химотрипсин | 1,5 × 10 −2 | 0,14 | 9,3 |
| Пепсин | 3,0 × 10 −4 | 0,50 | 1,7 × 10 3 |
| Т-РНК синтетаза | 9,0 × 10 −4 | 7,6 | 8,4 × 10 3 |
| Рибонуклеаза | 7,9 × 10 −3 | 7,9 × 10 2 | 1,0 × 10 5 |
| Карбоангидраза | 2,6 × 10 −2 | 4,0 × 10 5 | 1,5 × 10 7 |
| Фумараза | 5,0 × 10 −6 | 8,0 × 10 2 | 1,6 × 10 8 |
Вывод
Равновесное приближение
В своем первоначальном анализе Михаэлис и Ментен предположили, что субстрат находится в мгновенном химическом равновесии с комплексом, что подразумевает
Из закона сохранения фермента получаем
Объединение двух приведенных выше выражений дает нам
После упрощения получаем
[ ES ] знак равно [ E ] 0 [ S ] K d + [ S ] <\ displaystyle [<\ ce >]> >>
Квазистационарное приближение
K M знак равно k р + k c а т k ж <\ displaystyle K _ <\ mathrm
известна как константа Михаэлиса.
Допущения и ограничения
Напротив, квазистационарный анализ Бриггса – Холдейна действителен, если
Таким образом, это справедливо, если концентрация фермента намного меньше, чем концентрация субстрата, или и то, и другое. K M <\ Displaystyle К _ <\ mathrm
Важно отметить, что в то время как необратимость является необходимым упрощением для получения поддающегося аналитическому решению, в общем случае образование продукта не является необратимым. Ферментативную реакцию правильнее описать как
В общем, предположение о необратимости является правильным в ситуациях, когда верно одно из следующих:
1. Концентрация субстрата (ов) намного больше, чем концентрация продуктов: [ S ] ≫ [ п ] ⋅ <\ Displaystyle <\ ce <[S] \ gg [P].>>>
В ситуациях, когда ни одно из этих двух условий не выполняется (то есть реакция имеет низкую энергию и существует значительный пул продукта (ов)), уравнение Михаэлиса-Ментен нарушается, и более сложные подходы к моделированию явно принимают прямую и обратную реакции необходимо принять во внимание, чтобы понять биологию ферментов.
Определение констант
[ S ] K M знак равно W ( F ( т ) ) <\ displaystyle <\ frac <[<\ ce >]>
Вышеупомянутое уравнение использовалось для оценки и на основе данных динамики. V Максимум <\ displaystyle V _ <\ max>> 
Роль отслаивания субстрата
Уравнение Михаэлиса-Ментен использовалось для прогнозирования скорости образования продукта в ферментативных реакциях более века. В частности, в нем говорится, что скорость ферментативной реакции будет увеличиваться с увеличением концентрации субстрата, и что повышенное несвязывание комплексов фермент-субстрат будет снижать скорость реакции. В то время как первое предсказание хорошо известно, второе более неуловимо. Математический анализ влияния связывания фермента с субстратом на ферментативные реакции на уровне одной молекулы показал, что связывание фермента с субстратом может снизить скорость образования продукта при некоторых условиях, но также может иметь противоположный эффект. По мере увеличения концентрации субстрата может быть достигнут переломный момент, когда увеличение скорости разделения приводит к увеличению, а не уменьшению скорости реакции. Результаты показывают, что ферментативные реакции могут вести себя таким образом, который нарушает классическое уравнение Михаэлиса-Ментен, и что роль разрыва связывания в ферментативном катализе еще предстоит определить экспериментально.
Константа Михаэлиса



Михаэлиса константа, один из важнейших параметров кинетики ферментативных реакций, введённый немецкими учёными Л. Михаэлисом (L. Michaelis) и М. Ментен в 1913; характеризует зависимость скорости ферментативного процесса от концентрации субстрата. Согласно теории Михаэлиса — Ментен, первым этапом любого ферментативного процесса является обратимая реакция между ферментом (Е) и субстратом (S), приводящая к образованию промежуточного фермент-субстратного комплекса (ES), который затем подвергается практически необратимому расщеплению на продукт реакции (Р) и исходный фермент:
Реакции образования и распада комплекса ES характеризуются константами скорости k(1), k(-1), k(2). Если концентрация субстрата значительно превышает концентрацию фермента ([S] >> [E]) и, следовательно, концентрация ES становится постоянной, скорость ферментативной реакции (u) выражается уравнением:
где V — максимальная скорость реакции, достигаемая при полном насыщении фермента субстратом. Соотношение констант скорости
также является константой (Кm), получившей название М. к. Подставляя в уравнение (2) М. к., получаем уравнение Михаэлиса — Ментен:
Из уравнения (3) следует, что М. к. численно равна концентрации субстрата, при которой скорость реакции составляет половину максимально возможной (см. рис.).
В ряде случаев, когда величина k(1) мала и ею можно пренебречь, М. к. становится равной
и может служить мерой сродства субстрата к ферменту. М. к. имеет размерность концентрации. Практически величину М. к. находят различными графическими методами, исследуя зависимость скорости ферментативной реакции от концентрации субстрата.
Михаэлиса константа
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
Уравнение имеет вид:
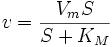
Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скорости ферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющем большинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент и продукт много больше, чем константа скорости образования ферменто-субстратного комплекса из фермента и субстрата. Иными словами:
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакции находится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Таким образом:
Преобразуем это к виду:
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
Выразим отсюда концентрацию фермент-субстратного комплекса:
Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собой скорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
Разделим числитель и знаменатель на k1. В результате:
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическая константа (с размерностью концентрации), которая равняется такой концентрации субстрата, при которой скорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогда выражение для начальной скорости реакции будет выглядеть так:
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливается равновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативной реакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях:
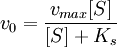
По значению KS можно судить о химическом сродстве субстрата к ферменту.
Полезное
Смотреть что такое «Михаэлиса константа» в других словарях:
Михаэлиса константа — один из важнейших параметров кинетики ферментативных реакций, введённый немецкими учёными Л. Михаэлисом (L. Michaelis) и М. Ментен в 1913; характеризует зависимость скорости ферментативного процесса от концентрации субстрата. Согласно… … Большая советская энциклопедия
константа Михаэлиса — Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
Константа Михаэлиса — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
константа Михаэлиса — Michaelis constant, Km константа Михаэлиса. Kинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату.… … Молекулярная биология и генетика. Толковый словарь.
Константа Михаэлиса — КОНСТÁНТА МИХАЭ́ЛИСА, Km, один из кинетических параметров ферментативной реакции. Численно равна концентрации субстрата, при к рой скорость реакции составляет половину от максимальной. Является функцией неск. констант скорости; в нек рых случаях… … Биологический энциклопедический словарь
Уравнение Михаэлиса — Ментен — Диаграмvа скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Уравнение Михаэлиса-Ментен — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Уравнение Михаэлиса — Диаграмма скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Субстраты — 1) в биологии основа (предметы или вещества), к которой прикреплены «сидячие» животные или растительные организмы, в том числе микроорганизмы. 2) В биохимии вещества, на которые действуют Ферменты. Термин «С.» употребляют для… … Большая советская энциклопедия