что такое комплексные соединения
Урок №15. Комплексные соединения
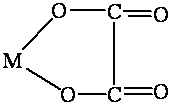
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
Соединения с комплексными катионами
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
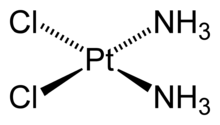
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
Комплексные соединения
Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6] 3− ), комплексный катион ([Ag(NH3)2] + ), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Содержание
Основные термины
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.
Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Классификация
Существует несколько классификаций комплексных соединений в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
По числу мест, занимаемых лигандами в координационной сфере
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl − — хлоро, CN − — циано, SCN − — тиоцианато, NO3 − — нитрато, SO3 2− — сульфито, OH − — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
История
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866—1919). Координационная теория Вернера 1893 года была первой попыткой объяснить структуру комплексных соединений. Эта теория была предложена до открытия электрона Томсоном в 1896 году, и до разработки электронной теории валентности. Вернер не имел в своём распоряжении никаких инструментальных методов исследований, а все его исследования были сделаны интерпретацией простых химических реакций.
Представления о возможности существования «дополнительных валентностей», зародившиеся при изучении четвертичных аминов, Вернер применяет и к «комплексным соединениям». В статье «К теории сродства и валентности», опубликованной в 1891 г., Вернер определяет сродство как «силу, исходящую из центра атома и равномерно распространяющуюся во всех направлениях, геометрическое выражение которой, таким образом, представляет собой не определённое число основных направлений, а сферическую поверхность». Два года спустя в статье «О строении неорганических соединений» Вернер выдвинул координационную теорию, согласно которой в неорганических молекулярных соединениях центральное ядро составляют комплексообразующие атомы. Вокруг этих центральных атомов расположено в форме простого геометрического полиэдра определённое число других атомов или молекул. Число атомов, сгруппированных вокруг центрального ядра, Вернер назвал координационным числом. Он считал, что при координационной связи существует общая пара электронов, которую одна молекула или атом отдает другой. Поскольку Вернер предположил существование соединений, которые никто никогда не наблюдал и не синтезировал, его теория вызвала недоверие со стороны многих известных химиков, считавших, что она без всякой необходимости усложняет представление о химической структуре и связях. Поэтому в течение следующих двух десятилетий Вернер и его сотрудники создавали новые координационные соединения, существование которых предсказывалось его теорией. В числе созданных ими соединений были молекулы, обнаруживающие оптическую активность, то есть способность отклонять поляризованный свет, но не содержащие атомов углерода, которые, как полагали, были необходимы для оптической активности молекул.
В 1911 г. осуществление Вернером синтеза более чем 40 оптически активных молекул, не содержащих атомов углерода, убедило химическое сообщество в справедливости его теории.
В 1913 г. Вернеру была присуждена Нобелевская премия по химии «в знак признания его работ о природе связей атомов в молекулах, которые позволяли по-новому взглянуть на результаты ранее проведённых исследований и открывали новые возможности для научно-исследовательской работы, особенно в области неорганической химии». По словам Теодора Нордстрема, который представлял его от имени Шведской королевской академии наук, работа Вернера «дала импульс развитию неорганической химии», стимулировав возрождение интереса к этой области после того, как она какое-то время пребывала в забвении.
Структура и стереохимия
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счёт неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Стереохимический подход — удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
Изомерия координационных соединений
В статистическом аспекте стереохимии центральным оказывается явление изомерии координационных соединений. Свойство изомерии химических соединений было известно ещё при разработке классической теории химического строения. Изомерия молекул открыта в 1823 г. Ю.Либихом, обнаружившим, что серебряная соль гремучей кислоты и изоцианат серебра имеют один и тот же элементный состав, но разные физические и химические свойства.
Под изомерией понимают способность к разному взаимному расположению атомов и атомных фрагментов в соединениях одинакового общего состава, диктующую отличия в химических и физических свойствах соответствующих соединений — изомеров. В случае координационных соединений указанные различия могут быть связаны как со спецификой расположения лигандов во внутренней координационной сфере, так и с распределением лигандов между внутренней и внешними сферами.
Изомерия прямо связана с наличием или отсутствием в соединении тех или иных элементов симметрии: поворотных осей, зеркально-поворотных осей, центра и плоскостей симметрии.
Стереохимическая конфигурация характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения. Смысл этого термина зависит от конкретного пространственного расположения атомов в структуре комплекса. Его используют для описания фигуры или многогранника вместе с дополнительным определением, характеризующим специфику пространственного расположения атомов. Так, можно говорить о цис- или транс-конфигурации; D (d), L(l), DL (dl) — соответственно право-, левовращающая конфигурация, рацемат.
Существуют изомеры двух типов:
1) соединения, в которых состав внутренней сферы и строение координированных лигандов идентичны (геометрические, оптические, конформационные, координационного положения);
2) соединения, для которых возможны различия в составе внутренней сферы и строении лигандов (ионизационные, гидратные, координационные, лигандные).
Пространственная (геометрическая) изомерия
Этот вид изомерии вызван неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров.
Структура, классификация, номенклатура комплексных соединений
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
По электрическому заряду: катионные, анионные и нейтральные комплексы
По количеству комплексообразователей
По типу лиганда
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
По химическим свойствам: кислоты, основания, соли, неэлектролиты:
По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
4. Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
5. Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
6. Названия комплексных анионов оканчиваются суффиксом – ат
После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем комплексные соединения:
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия
Что такое комплексные соединения
Наиболее удачно свойства и строение комплексных соединений объясняет координационная теория, предложенная А. Вернером. Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами) и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих центральный ион, называется координационным числом.
Степень окисления центрального атома является основным фактором, влияющим на координационное число. Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона:
Заряд центрального атома
Координационное число
Жирным шрифтом выделены чаще встречающиеся координационные числа.
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда.
Лиганды, занимающие во внутренней координационной сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются би- и полидентатными. Примерами бидентатных лигандов могут служить оксалатный ион C 2 O 4 2- и молекула этилендамина ( NH 2 CH 2 CH 2 NH 2). Четырехдентатным лигандом является двухзарядный анион этилендиаминтетрауксусной кислоты:
Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов. Например:
Входящие в состав комплекса электронейтральные молекулы, например N Н3, Н2О, С2Н4, не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать.
Основные типы комплексных соединений. К основным типам комплексных соединений относятся следующие.
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами.
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
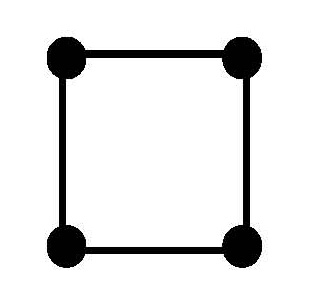
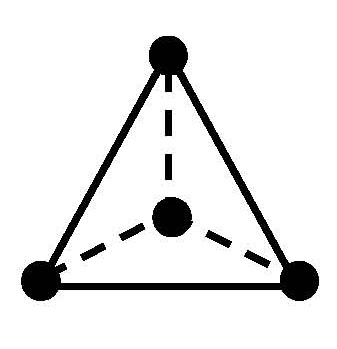
Пространственное строение и изомерия комплексных соединений
Координационное число
Геометрическая конфигурация

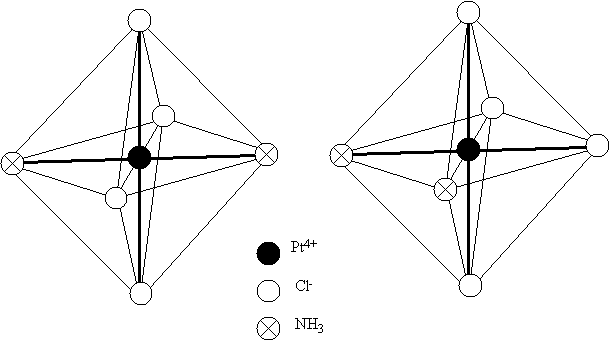
Комплексы платины ( II ), например [ Pt ( NH 3)2 Cl 2], встречаются в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. В одном из изомеров этого комплекса атомы хлора разделены центральным атомом (транс-изомер), а в другом (цис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 7.1).
Рис. 7.1. Пространственное строение изомера [ Pt ( NH 3)2 Cl 2]: а – транс-изомер, б – цис-изомер
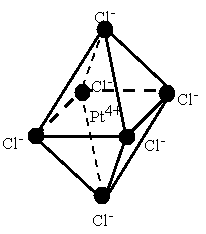
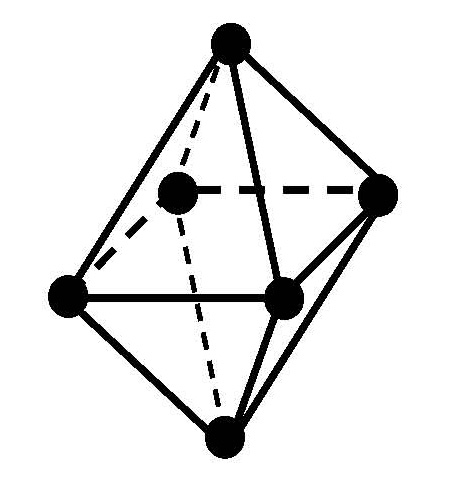
В случае комплексных соединений с координационным числом 6 лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 7.2).
Рис. 7.2. Пространственное строение комплексного иона [ PtCl 6] 2-
Рис. 7.3. Пространственное строение изомеров [ Pt ( NH 3)2 Cl 4]:
а – транс-изомер, б – цис-изомер
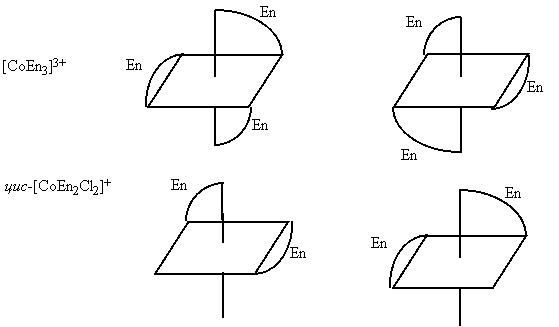
К геометрической изомерии относится и зеркальная (оптическая) изомерия. Например, комплексы [СоЕ n 3]С13 и цис-[ Co Е n 2С12]С1 существуют в виде двух зеркальных антиподов:
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидратная изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [С r (Н2О)6]С13, [С r (Н2О)5С1]С12·Н2О, [С r (Н2О)4С12]С12·2Н2О. При этом цвет комплекса меняется от сине-фиолетового до светло-зеленого.
Ионизационная изомерия определяется различным распределением ионов между внутренней и внешней сферами, например: [ Co ( NH 3)5 Br ] SO 4, [ Co ( NH 3)5 SO 4] Br ; [ Pt ( NH 3)4 Cl 2] Br 2 и [ Pt ( NH 3)4 Br 2] Cl 2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [ Co ( NH 3)6][ Cr ( CN )6] и [ Cr ( NH 3)6][ Co ( CN )6].
7.2. Природа химической связи в комплексных соединениях
Развитие представлений о химической связи в комплексных соединениях переходных металлов прошло четыре стадии. Оно началось с простейшей электростатической теории, которую сменила теория валентных связей, или локализованных молекулярных орбиталей; в дальнейшем появились теория кристаллического поля и, наконец, теория поля лигандов, или делокализованных молекулярных орбиталей. Каждая из этих теорий стала развитием предыдущей. Их последовательное рассмотрение является хорошим способом проследить за развитием представлений о химической связи и дает возможность показать, что одни и те же физические факты можно объяснить в рамках различных, и на первый взгляд, противоположных предположений.
Наши рассуждения будут относиться главным образом к комплексам с октаэдрической структурой, потому что они встречаются наиболее часто и легче поддаются интерпретации. Любая из обсуждаемых теорий должна дать ответы на следующие вопросы:
¨ Как объяснить различие в окраске (поглощении энергии) комплекса при изменении типа лиганда?
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом металла и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными лигандами. В результате образуется наиболее устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексов, но многие другие их свойства остались необъясненными. Так, электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание их свойств и строения может быть получено только на основе квантовомеханических представлений.
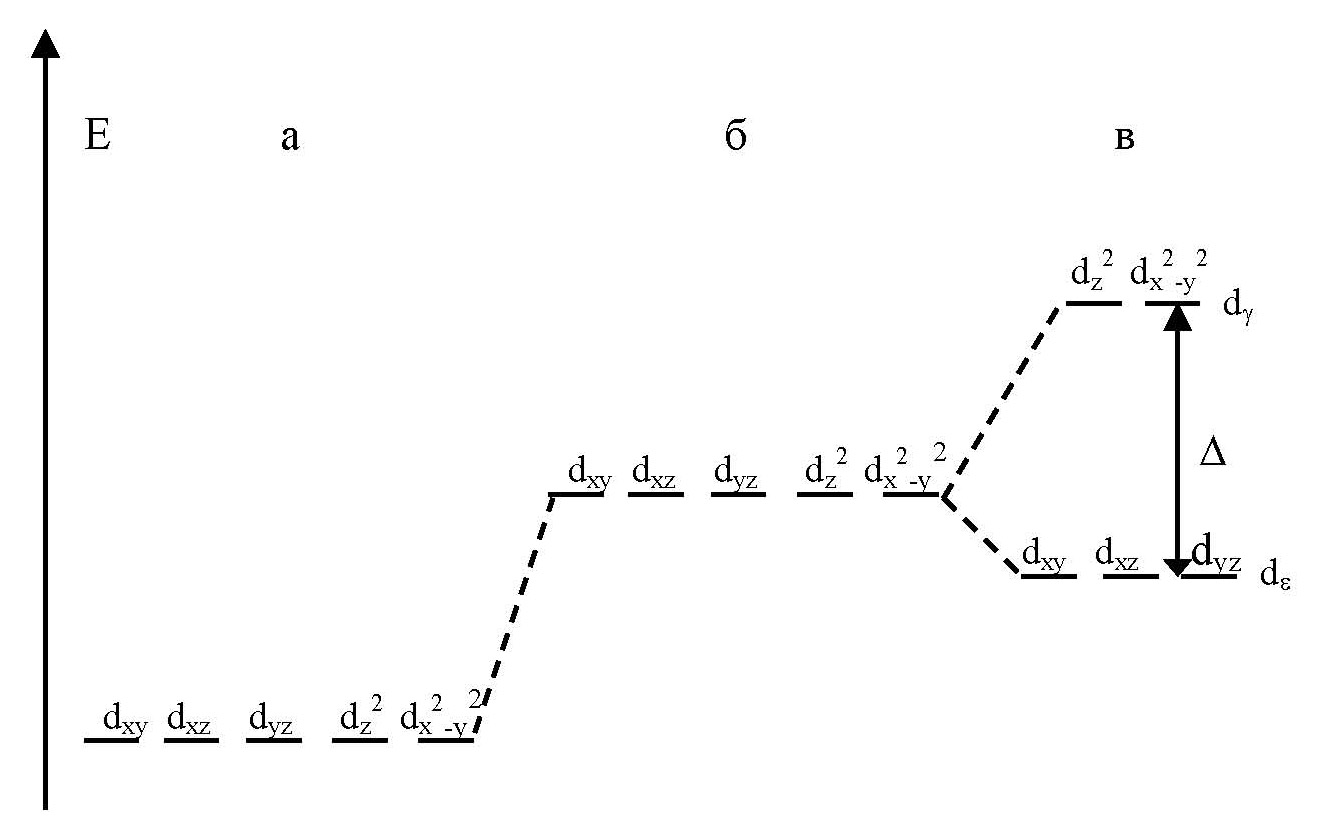
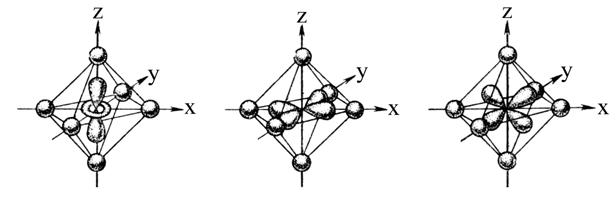
Рис. 7.5. Орбитали dz 2 (а), dx 2 — y 2 (б) и dx (в) в октаэдрическом поле лигандов
Величина энергии расщепления определяет свойства комплексных соединений, поэтому важно знать факторы, от которых она зависит:
¨ Тип координации центрального атома. На параметр ∆ влияет как число лигандов, окружающих центральный атом, так и их взаимное расположение. Энергия расщепления октаэдрическим полем лигандов (∆о) при прочих равных условиях всегда выше, чем тетраэдрическим (∆ t ): ∆ t = 4/9 ∆о. Это объясняется разной величиной электростатического взаимодействия электронов центрального атома с лигандами.
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце – слабое.
Теория кристаллического поля не может объяснить такое расположение лигандов, связанное с их электронной структурой, которую данная теория не принимает во внимание.