что такое клинические исследования вакцины
Вакцинация как медицинский эксперимент. Правовые гарантии неучастия
Авторы: Дмитрий Казаков, Виталина Степанова, Кристина Табакина
В связи с проведением массовой вакцинации от COVID-19 актуальным представляется вопрос об условиях клинических испытаний лекарственных препаратов и их особенностях для отдельных категорий, участвующих в испытаниях граждан.
Вакцина, безусловно, является лекарственным препаратом в соответствии с определением, закрепленным в пункте 1 статьи 4 Федеральный закон № 61-ФЗ « Об обращении лекарственных средств», поскольку является веществом, вступающим в контакт с организмом человека или животного, проникает в органы, ткани организма и применяется для профилактики заболевания.
На данный момент ни одна из отечественных вакцин не прошла все фазы клинических испытаний ( см.: Реестр разрешений на проведение клинических исследований Государственного реестра лекарственных средств).
Под клиническим испытанием лекарственного препарата понимается изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и ( или) пищевыми продуктами. [1]
Главное отличие клинического испытания от доклинического исследования заключается в том, что испытуемыми являются не животные, а люди.
Согласно статье 39 Федерального закона « Об обращении лекарственных препаратов» для проведения клинических испытаний необходимо получить разрешение уполномоченного органа. Во-первых, необходимо предоставить документы, содержащие всю имеющуюся информацию о препарате по итогам его лабораторного и доклинического исследования, а также план проведения испытания. Во-вторых, на основании документально подтвержденных сведений Советом по этике при проводится этическая экспертиза и выдается заключение об этической обоснованности возможности или невозможности проведения клинического исследования лекарственного препарата. [2] И только на основании такого заключения Министерство здравоохранения РФ выдает разрешение на проведения клинических испытаний.
В соответствии со статьей 43 ФЗ «Об обращении лекарственных препаратов» участие пациентов является добровольным и информированным.
Для этих целей на подпись гражданину представляется информационный листок, где должны быть указаны следующие сведения:
Кратко в данном разделе должна быть представлена информация, относящаяся к безопасности, фармакодинамике, эффективности и дозозависимости эффектов исследуемого продукта. Должны быть освещены значимые различия в характере/частоте нежелательных реакций, как для различных показаний, так и для различных популяций. Должны быть описаны возможные риски и нежелательные реакции, которые можно ожидать, основываясь на накопленном опыте применения, как исследуемого продукта, так и сходных с ним продуктов. Должны быть также описаны меры предосторожности или специальные методы наблюдения, которые необходимо применять при использовании продукта с исследовательскими целями; [3]
об условиях участия граждан в клиническом исследовании лекарственного препарата для медицинского применения;
Подробный перечень информации, предъявляемый потенциальному исследуемому для обозрения, обозначен в разделе 7 «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика», он именуется брошюрой исследователя и содержит сводное изложение результатов клинического и доклинического изучения исследуемого продукта, значимых для его исследования на человеке.
На наш взгляд, кроме перечисленных выше сведений потенциальному участнику клинических испытаний должен быть представлен под роспись перечень противопоказаний для применения данного лекарственного средства с детальной расшифровкой каждого из них.
Следует отметить, что перед началом испытаний в обязательном порядке должно проводиться предварительное обследование состояния здоровья, в том числе должен быть детально и всесторонне оценен иммунный статус участника эксперимента. В противном случае невозможно будет назвать эту процедуру исследованием, поскольку не представится возможным оценить динамику показателей здоровья, в частности невозможно будет установить иммунный ответ испытуемого.
Необходимым условием является право на односторонний отказ от участия в испытании на любой его стадии без каких-либо ограничений со стороны пациента. Данная норма отражает положения Хельсинской декларации, а также конституционное право граждан, закрепленное в статье 21 — никто не может быть без добровольного согласия подвергнут медицинским, научным или иным опытам.
Субъектов испытаний в зависимости от наличия ограничений можно разделить на 3 группы.
Первую группу составляют категории граждан, которым на законодательном уровне установлен императивный запрет на участии в клинических испытаниях. В эту группу входят:
1.1. Дети сироты и дети без попечения;
1.2. Военнослужащие по призыву;
1.3. Сотрудники правоохранительных органов;
1.4. Лица, отбывающие наказания в местах лишения свободы и лица, находящиеся под стражей в следственных изоляторах.
В данный перечень, по нашему мнению, необходимо также включить пациентов, находящихся на стационарном лечении, состояние здоровья которых исходя из медицинских показателей не позволяет пациентам с онкологическими, инфекционными, аллергологическими, пульмонологическими и другими заболеваниями быть участниками клинический испытаний лекарственных препаратов.
Вторую группу составляют лица, которые могут стать субъектами клинических испытаний только при соблюдении определенных условий:
2.1. Несовершеннолетние могут участвовать в испытании только при условии, что: родители или законные представители дали на это информированное письменное согласие, проведение испытания необходимо для укрепления здоровья детей или профилактики инфекционных заболеваний в детском возрасте либо если целью такого исследования является получение данных о наилучшей дозировке лекарственного препарата для лечения детей. Такому исследованию должно предшествовать клиническое исследование лекарственного препарата для медицинского применения на совершеннолетних гражданах ( за исключением случаев, если исследуемый лекарственный препарат предназначен исключительно для использования несовершеннолетними).
2.2. Женщины в период беременности и грудного вскармливания при условии, что препарат предназначен для применения женщинами в указанный период, либо если исключается риск вреда женщине, плоду и ребенку.
2.3. Военнослужащие, при условии, что лекарственный препарат специально разработан для применения в условиях военных действий, чрезвычайных ситуаций, профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов
2.4. Лица с психическими заболеваниями могут стать субъектами клинических испытаний при наличии письменного согласия их законных представителей и при условии, что препарат предназначен для лечения психических заболеваний.
В третью группу входят граждане, не перечисленные в первых двух группах. Между тем, можно выделить отдельную подгруппу наиболее « уязвимых» граждан, такое понятие вводится пунктом 3.44 «ГОСТ Р ИСО 14 155−2014. Национальный стандарт Российской Федерации. Клинические исследования. Надлежащая клиническая практика». Прямых запретов на их участие в испытаниях нет, однако, исходя из морально-этических соображений и международного опыта, не рекомендуется привлекать в качестве испытуемых:
В частности предполагается, что на готовность указанных лиц участвовать в клиническом исследовании может излишне влиять ожидание, обоснованное или нет, или выгода, связанная с участием или негативной реакцией администрации в случае отказа от участия.
[1] п. 42 ст. 4 Федерального закона № 61-ФЗ « Об обращении лекарственных средств»
[2] Приказ Минздрава России № 986н «Об утверждении Положения о Совете по этике»
[3] «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика».
Клинические исследования вакцин
Разработка вакцин сегодня становится особенно важной на фоне пандемии COVID-19. Фармацевтические компании по всему миру активизировались в общей борьбе с коронавирусом. В данной статье мы опишем особенности проведения клинических исследований вакцин.
Широкое применение вакцин диктует необходимость слежения за качеством проведенной иммунизации и ее эффективностью, что является неотъемлемой частью эпидемиологического надзора за инфекционными заболеваниями. Эффективность проводимой иммунизации зависит от целого ряда причин, обусловленных сложностью технологии их производства, многообразием механизмов действия на организм человека, а также необходимостью особого надзора за качеством препаратов и правилами их применения. С этой целью особое внимание должно уделяться проведению клинических исследований вакцинных препаратов с последующей экспертизой всех этапов согласно нормативным документам.
Согласно 78 решению ЕАЭС для регистрации вакцины необходимо провести следующие исследования:
5.3.4. Отчеты о фармакодинамических исследованиях у человека
5.3.5. Отчеты об исследовании эффективности и безопасности
5.3.6. Отчеты о пострегистрационном опыте применения
Исследования I фазы проводятся на небольшой (от 20 до 100 человек) группе здоровых добровольцев. В ходе проведения I фазы клинических исследований определяются показатели безопасности и реактогенности, а также, если возможно, предварительные данные по иммуногенности вакцины. На основании этих параметров осуществляется подбор дозы и способа введения вакцины. Исследования I фазы направлены на изучение переносимости и безопасности препарата на ограниченном контингенте здоровых добровольцев.
После получения результатов, подтверждающих предварительную безопасность препарата на I фазе испытаний, проводятся расширенные испытания вакцинного препарата с участием большего количества добровольцев (100–500 человек) для подтверждения показателей его безопасности и эффективности, т.е. II фаза клинических испытаний.
Клинические испытания II фазы обязательно должны проводиться при наличии основной группы (получающие исследуемый препарат) и контрольной, в которой добровольцам вводится либо плацебо, либо препарат сравнения. Добровольцы, включенные в состав основной и контрольной групп, должны быть рандомизированы по полу, возрасту и т. п. При этом показатели эффективности (иммуногенность, лечебная или профилактическая эффективность) и переносимости вновь разработанного препарата (представленного на регистрацию) сравниваются либо с плацебо, либо с препаратом сравнения (однонаправленным препаратом, зарегистрированным в стране с уже охарактеризованными показателями безопасности и эффективности).
Следует отметить, что в документе EMEA/CHMP/VWP/164653/2005 указано, что важно оценить иммунологический ответ для разных возрастных подгрупп и тщательно собирать информацию по безопасности после каждой введенной дозы вакцины.
В случае, если новая вакцина содержит антиген, который еще не был использован ни в одной зарегистрированной вакцине, потребуется деэскалация дозы. Предлагается постепенное включение популяций разных возрастов, начиная со старшего: старше 18 лет, 13-18 лет, 6-12 лет, 2-5 лет, 1-2 года, далее дети в возрасте до 1 года. Дети участвуют в исследованиях только при письменном согласии родителей. Если же новый антиген уже используется в зарегистрированной вакцине, то возможно рассмотрение варианта учета всех данных по безопасности для возрастных подгрупп, полученных при исследовании уже зарегистрированной вакцины. Кроме того, если предполагается использование различных лекарственных форм одной и той же вакцины для детей разных возрастов, также необходимо проведение исследований с деэскалацией возраста. Таким образом, дальнейшая тактика будет зависеть от того, содержит ли разрабатываемая вакцина новый антиген или данный антиген уже используется в зарегистрированных вакцинах.
Клинические исследования III фазы включают в себя оценку профилактической и/или лечебной эффективности. Рандомизированные контролируемые исследования проводятся с участием большого количества добровольцев (от 300 до нескольких тысяч человек). Это широкомасштабные клинические исследования, направленные на получение данных по эффективности и безопасности вакцины. При организации и проведении этой фазы исследования, необходимо предусмотреть участие в них специалистов-эпидемиологов и врачей-инфекционистов. В связи с этим в исследовательские центры, ответственные за проведение подобного рода клинических испытаний, должны быть включены как клинические учреждения Минздрава РФ, так и учреждения Роспотребнадзора РФ.
Далее следует работа по сбору информации о возможных нежелательных явлениях, связанных с вакцинацией, а также оценка влияния иммунизации на снижение заболеваемости – то есть, эффективность вакцин. Эта работа проводится постоянно и позволяет получить полную информацию по оценке нового препарата.
После успешного проведения трех фаз клинических исследований, изучаемая вакцина проходит процедуру регистрации, по завершению которой проводится мониторинг ее эффективности и безопасности в условиях практического применения, т.е. IV фазы исследований. В задачи пострегистрационных испытаний входит: выявление редких побочных эффектов от применения препаратов; расширения показаний к применению препаратов; разработка эпидемиологически обоснованной тактики применения вакцин; оценка экономической эффективности применения препарата, уточнение схем введения. Протокол пострегистрационного испытания вакцин должен разрабатываться с учетом особенностей эпидемиологии заболевания, его распространения на различных территориях, особенностях возрастной структуры и т. п. Также, одной из целей пострегистрационных исследований, является определение редко встречающихся или непредвиденных явлений, которые могли быть не установлены в результате исследований II или III фазы. Данные о безопасности вакцин получают путем активного и пассивного сбора информации.
Так, на основании наблюдений за использованием вакцин, собирается огромное количество статистической информации, по которой можно судить о их качестве и сравнивать эффективность с аналогами, выпускаемыми другими производителями.
Процесс клинических исследований вакцин очень трудоёмкий. В процессе исследований необходимо не только получить положительный результат действия вакцины, но и выявить все нежелательные реакции. Результаты проведенных клинических исследований должны гарантировать, что вакцина является безопасной и фактически способна предотвратить развитие заболевания или значительно уменьшить неблагоприятные последствия болезни.
Российские вакцины не прошли все фазы клинического исследования?
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н «Об утверждении правил надлежащей клинической практики» (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
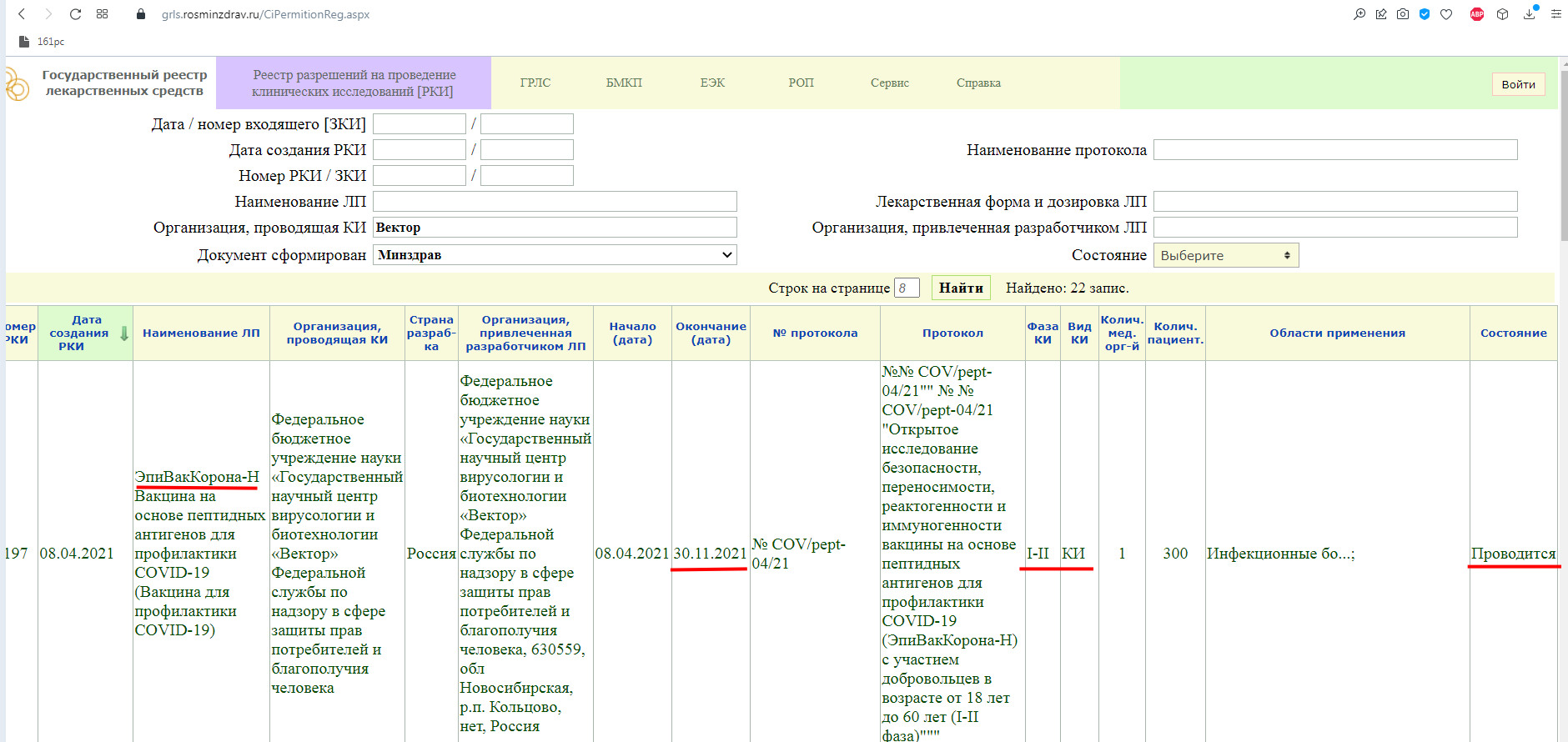
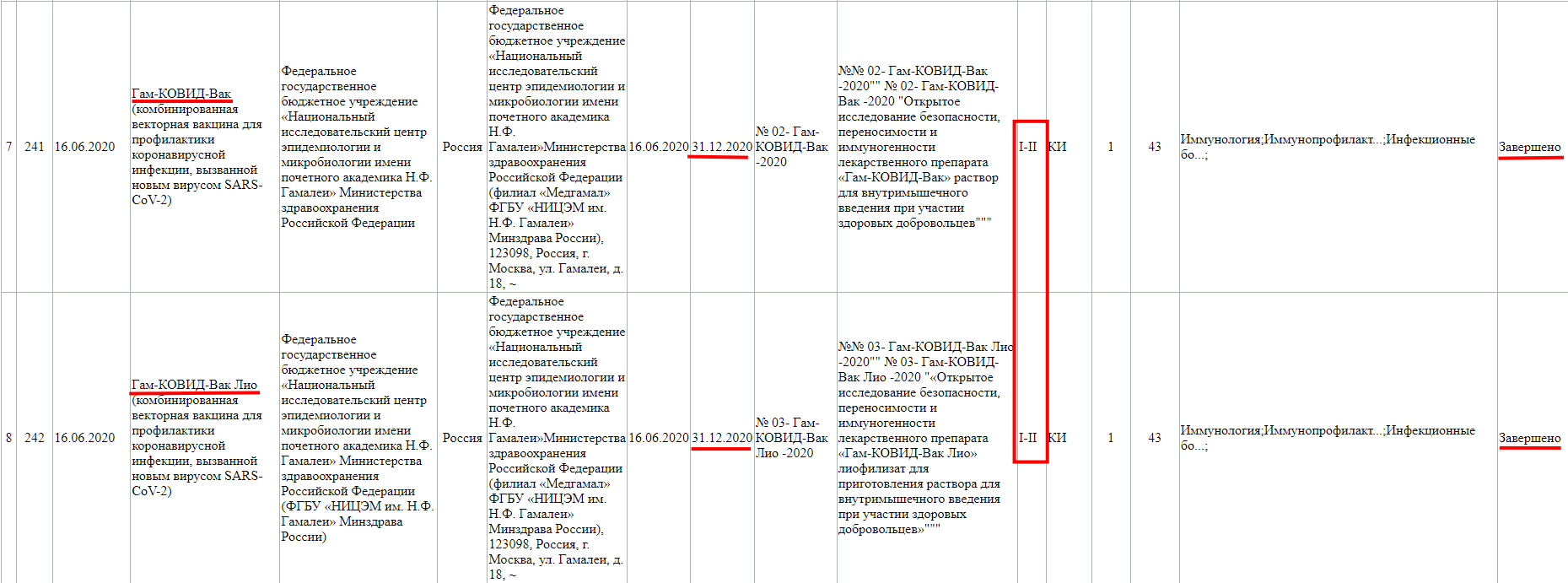
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.
Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.
Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года.
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
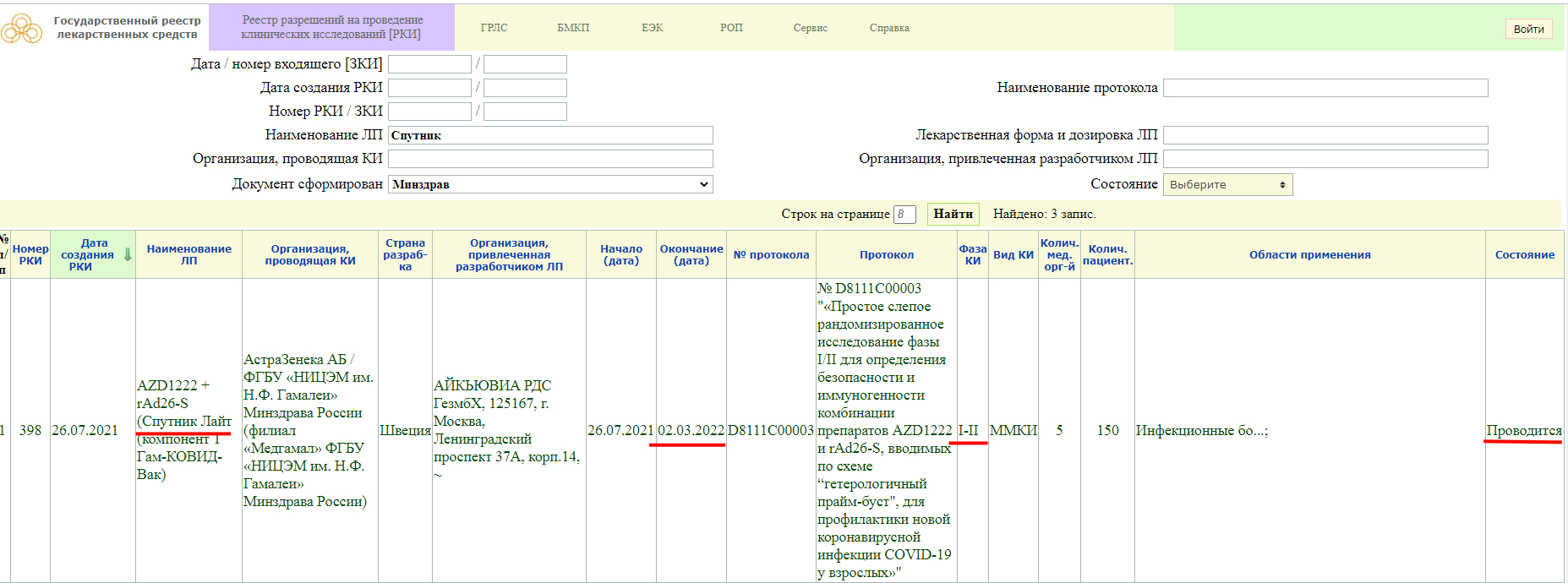
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.
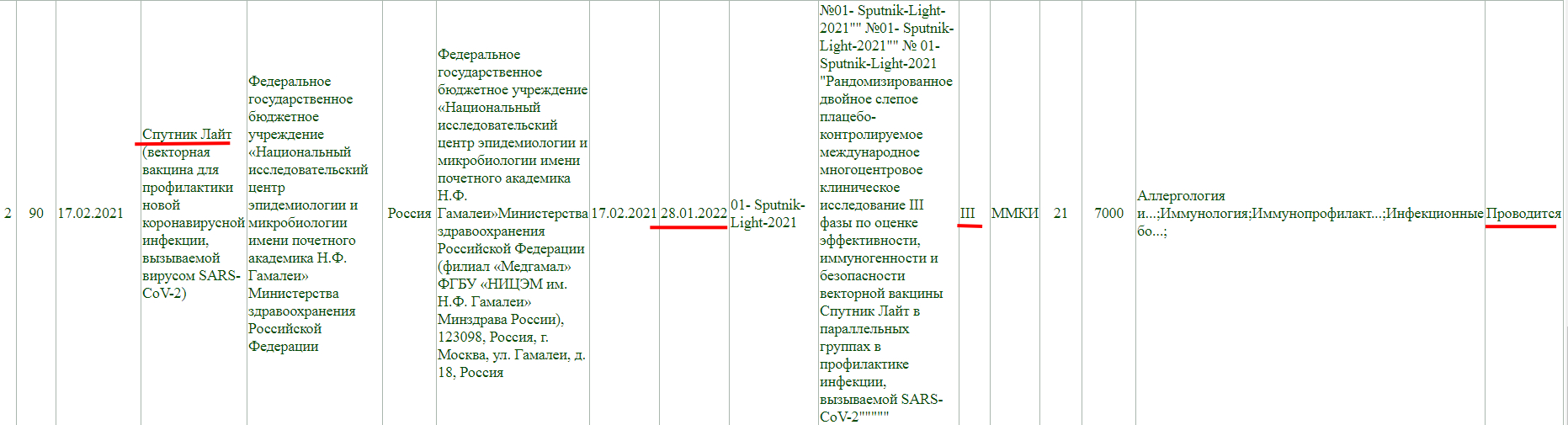
Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
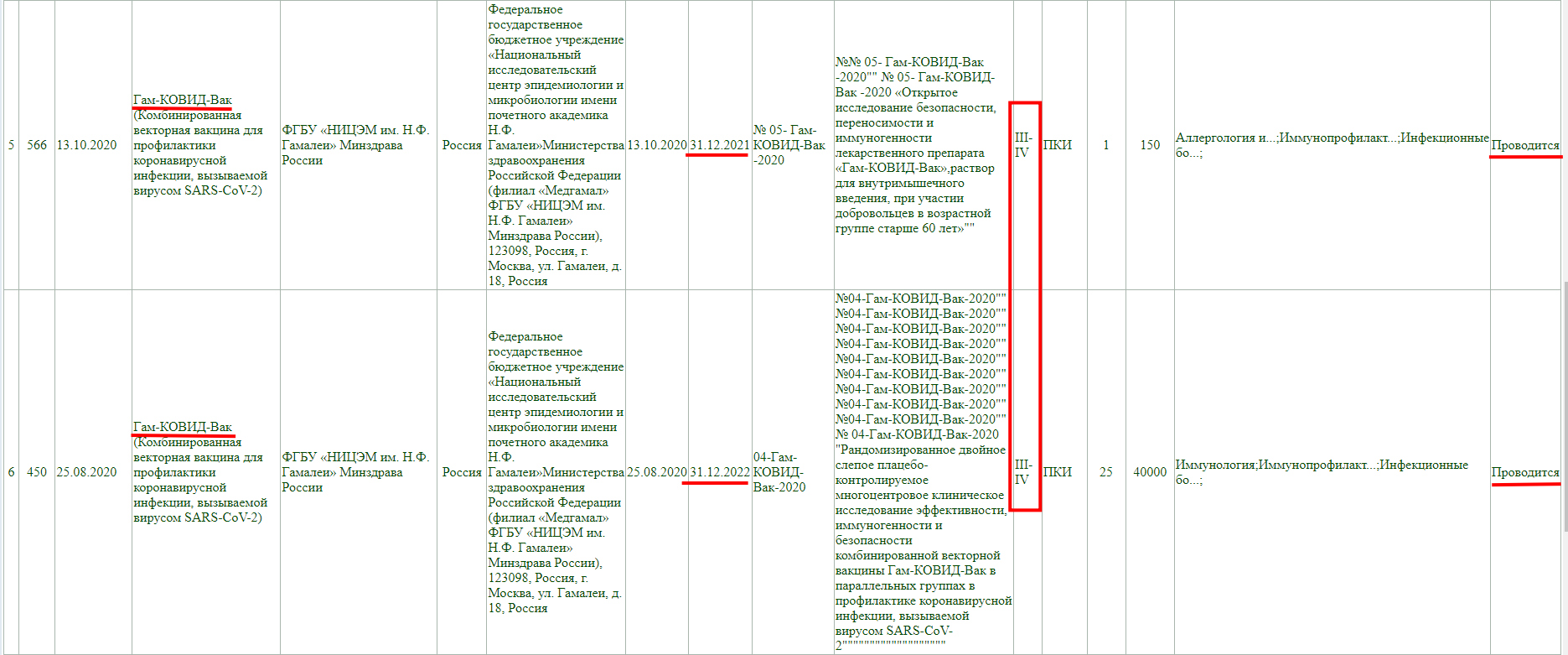
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Голикова выразила надежду на достижение коллективного иммунитета к COVID-19 в России к лету
Появилось видео, где предположительно запечатлено уничтожение двух танков ЛНР американским Javelin на вооружении Украины
Гинцбург назвал три причины ввести QR-коды в общественных местах
ВОЗ рассчитывает провести встречу по вакцине «Спутник V» на следующей неделе
Иммунолог Владислав Жемчугов назвал причину высокой летальности от COVID-19
На орбиту Земли запускают спутник TRUTHS, который будет отслеживать энергобаланс планеты
Лавров: непризнание Францией вакцинации «Спутником V» затрудняет работу российских дипломатов в стране
Минздрав обеспокоен высоким уровнем смертности среди пенсионеров
В крупных магазинах Хабаровского края начали проверять QR-коды
Сайт Avia.pro: украинские войска были отброшены от Докучаевска под огнем сил ДНР
Путин наградил директора Центра им. Гамалеи Гинцбурга орденом Александра Невского
Голикова заявила, что сертификат о вакцинации должен стать для россиян таким же важным документом, как паспорт
Политтехнолог Газенко: к производству вакцин присосались люди, которые эксплуатируют это в собственных интересах
QR-код потребуется россиянам и для приобретения билетов, и для посадки в поезд или самолет
Станьте членом КЛАНА и каждый вторник вы будете получать свежий номер «Аргументы Недели», со скидкой более чем 70%, вместе с эксклюзивными материалами, не вошедшими в полосы газеты. Получите премиум доступ к библиотеке интереснейших и популярных книг, а также архиву более чем 700 вышедших номеров БЕСПЛАТНО. В дополнение у вас появится возможность целый год пользоваться бесплатными юридическими консультациями наших экспертов.
В Москве началась третья фаза клинического испытания вакцины от COVID-19 для подростков
11 ноября 2021 года о начале заключительной фазы клинического испытания подростковой вакцины сообщила заместитель мэра Москвы по вопросам социального развития Анастасия Ракова.
В этом исследовании изучается безопасность и эффективность вакцины «Спутник М» у людей в возрасте 12—17 лет. Новый препарат очень похож на вакцину «Спутник V», но в нем в пять раз меньше действующего вещества, чем в вакцине для взрослых.
Будьте внимательны к источникам информации о здоровье — и сходите к врачу
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
Нужно ли прививать детей и подростков от COVID-19
Да, нужно. По данным из Великобритании, США, Италии, Австралии, Китая и Южной Кореи, на детей и подростков приходится до 16% всех подтвержденных случаев коронавирусной болезни.
При этом подростки 12—17 лет заражаются примерно вдвое чаще, чем дети в возрасте 5—11 лет. По некоторым данным, болеют они тоже тяжелее. Среди всех людей моложе 21 года, которые умерли от ковида в США с февраля по июль 2020 года, 70% пришлось на тех, кто был в возрасте 10—20 лет.
Оценив эти данные, специалисты из американского Центра по контролю и предотвращению заболеваний, или CDC, и представители Европейской технической консультативной группы экспертов по иммунизации, или ETAGE, пришли к выводу, что польза от вакцинации людей 12—15 лет превышает любые известные и потенциальные риски от этой процедуры.
Курс о больших делах
Что мы знаем об эффективности подростковых вакцин от коронавирусной болезни
На сегодняшний день для детей 5—11 лет и подростков 12—17 лет одобрен только один препарат — Comirnaty от Pfizer-BioNTech. Это вакцина на основе матричной РНК, или мРНК. Таких лекарств в нашей стране нет.
В клинических испытаниях эффективность двух доз Comirnaty у подростков составила 100%. В реальных условиях оценить ее эффективность пока сложно, но считается, что прививка помогает избежать госпитализации в 93% случаев.
Серьезные побочные эффекты от вакцинации возникают крайне редко. Хотя поступали сообщения о миокардите, то есть воспалении сердечной мышцы, и перикардите, то есть воспалении оболочки сердца, риск составляет примерно 54 случая на миллион введенных доз вакцины.
Тяжелые аллергические реакции на компоненты вакцины у подростков случаются очень редко, как и у взрослых людей.
Подростков старше 12 лет за рубежом прививают таким же препаратом, как и взрослых. Дети в возрасте 5—11 лет получают вакцину Comirnaty, в которой содержится треть действующего вещества.
Из всех вакцин, которые применяют в нашей стране, самые лучшие доказательства безопасности и эффективности есть у двух препаратов: «Спутник V» и «Спутник Лайт». Эти лекарства относятся к группе аденовирусных вакцин. Данными о безопасности и эффективности таких вакцин у подростков пока не располагает ни одно государство в мире.
Насколько опасно участвовать в третьем этапе клинических испытаний
Самым рискованным считается первый этап клинических испытаний, на котором проверяют безопасность дозировки и стремятся выявить как можно больше побочных эффектов препарата. Участников обычно немного: от 20 до 80 человек.
Иногда первый этап сразу совмещают со вторым, то есть проверяют не только безопасность, но и эффективность лекарства. Судя по доступным данным, «Спутник М» проверяли именно по такой схеме. Испытания подростковой вакцины проходили на базе Морозовской детской больницы и детской больницы им. З. А. Башляевой.
Там же было сказано, что дети перенесли прививку легче, чем взрослые участники первой и второй фазы клинического испытания «Спутника V».
Во время первого и второго этапа клинических испытаний взрослой версии лекарства участники чаще всего жаловались на боль в месте инъекции — 58%, повышение температуры — 50%, головную боль — 42%, слабость — 21%, и боль в мышцах и суставах — 24%. Серьезных побочных эффектов выявлено не было.
Если лекарственный препарат успешно проходит первую и вторую фазу клинических испытаний, начинается третья фаза. В ней участвуют больше всего добровольцев — от 1000 до 3000 участников. Планируется, что в третьей фазе испытаний «Спутника М» примут участие 3000 человек: 2400 получат вакцину, а 600 — плацебо.
Как принять участие в клиническом испытании
Участвовать в исследовании смогут только здоровые подростки, не болевшие COVID-19, у которых нет медицинских противопоказаний и аллергии на полиэтиленгликоль. В состав вакцины входит похожее на него вещество — полисорбат 80, на который тоже может случиться аллергия.
В клиническом испытании нельзя участвовать тем, что простужался за две недели до даты вакцинации или делал прививку от другой болезни в последние 30 дней.
Чтобы принять участие в исследовании, необходимо отправить заявку на почту vacdeti@zdrav.mos.ru.
несовершеннолетних в России — Ассоциация организаций по клиническим исследованиям
При этом без согласия родителей поучаствовать в клиническом исследовании не получится. Если добровольцу еще не исполнилось 14 лет, форму информированного согласия на участие в исследовании должны подписать его родители. А если уже исполнилось, то форму подписывают и родители, и сам подросток.
Как будет проходить клиническое испытание
Перед началом исследования добровольцы должны будут посетить врача, который осмотрит их и направит на ПЦР-тест — это нужно, чтобы убедиться, что потенциальный участник не болеет коронавирусной болезнью прямо сейчас, и на анализ крови на антитела к COVID-19 — это позволит понять, что доброволец не болел в прошлом.
Заодно у потенциальных участников исследования проверят общее состояние здоровья: возьмут кровь на биохимический и общий клинический анализ крови, ВИЧ, гепатит, общий анализ мочи, а также сделают электрокардиограмму.
Если исследования покажут, что доброволец может участвовать в исследовании, его пригласят повторно посетить исследовательский центр для первой прививки. Второй укол сделают через 21 день. И после первой, и после второй прививки нужно будет вести онлайн-дневник о своем самочувствии.
На 28-й день после первой прививки всем участникам снова сделают электрокардиограмму — это поможет убедиться, что прививка не повредила сердцу. Затем возьмут кровь на коагулограмму — это позволяет выяснить, насколько хорошо свертывается кровь, и снова сделают такие же анализы, как и в первый раз. А еще расскажут, в какую группу попали участники. Если это была группа плацебо, добровольцам сделают прививку настоящей вакциной.
В голове у многих родителей, к сожалению, творится тот же звездец. Ребенка детсадовского возраста запросто сажают на никем не исследованную веганскую диету, лишая нормального развития. Мажут нос звездочкой и оксолиновой мазью «от вирусов», пичкают кагоцелом и «сахарными шариками» из гомеопатической поликлиники, пугливо игнорируя прописанные врачом антибиотики. Доводя банальную детскую ангину до менингита и сепсиса. С таким подходом неудивительно, что любая вакцинация превращается в одну непрекращающуюся истерику в родительских чатах.