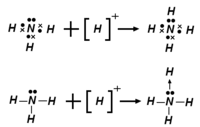что такое кислоты льюиса
Кислота Льюиса
В рамках электронной теории химических соединений Льюиса химическая связь образуется обобществленной электронной парой, достраивающей электронные оболочки атомов, образующих связь, до завершенной электронной конфигурации инертного газа (правило октетов).
В качестве кислот Льюиса могут выступать как нейтральные молекулы, так и катионы: так, катионы водорода выступают в роли кислоты Льюиса при взаимодействии с водой либо аммиаком, с образованием ионов гидроксония либо аммония.
Кислотами Льюиса являются также координационно ненасыщенные соединения — как металлов, так и неметаллов, например, BF3, AlCl3, образующие аддукты с различными основаниями Льюиса:

См. также
Примечания
Полезное
Смотреть что такое «Кислота Льюиса» в других словарях:
кислота Льюиса — rūgštis statusas T sritis chemija apibrėžtis Elektronų akceptorius. atitikmenys: angl. acid; Lewis acid rus. кислота; кислота Льюиса; льюисовская кислота ryšiai: sinonimas – Luiso rūgštis … Chemijos terminų aiškinamasis žodynas
кислота — rūgštis statusas T sritis chemija apibrėžtis Elektronų akceptorius. atitikmenys: angl. acid; Lewis acid rus. кислота; кислота Льюиса; льюисовская кислота ryšiai: sinonimas – Luiso rūgštis … Chemijos terminų aiškinamasis žodynas
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
Апротонная кислота — Апротонная кислота это химическое соединение, способное принять электронную пару на незаполненную орбиталь (то есть кислота Льюиса) и не содержащее ядер атома водорода. Другими словами, апротонная кислота это химическое соединение, в… … Википедия
льюисовская кислота — rūgštis statusas T sritis chemija apibrėžtis Elektronų akceptorius. atitikmenys: angl. acid; Lewis acid rus. кислота; кислота Льюиса; льюисовская кислота ryšiai: sinonimas – Luiso rūgštis … Chemijos terminų aiškinamasis žodynas
Теории кислот и оснований — совокупность фундаментальных физико химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований двух классов веществ, реагирующих между собой. Задача теории предсказание продуктов… … Википедия
Химические свойства спиртов — Химические свойства спиртов это химические реакции спиртов во взаимодействии с другими веществами. Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием: Чем больше… … Википедия
Неорганические кислоты — Основная статья: Кислота Неорганические (минеральные) кислоты неорганические вещества, обладающие комплексом физико химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за… … Википедия
ХИМИЧЕСКИЕ РЕАКЦИИ — Равновесие. Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще… … Энциклопедия Кольера
Ионная жидкость — Формула 1 бутил 3 метилимидазолий гексафторфосфата [bmim]PF6, одной из самых распространённых ионных жидкостей Ионная жидкость жидкость, содержащая только ионы. В широком смысле этого понятия ионные жидкости это любые … Википедия
Кислоты и основания Льюиса
Вы будете перенаправлены на Автор24
Критерии определения кислот и оснований Льюиса
В качестве основы своих определений кислот и оснований Льюис выбрал четыре экспериментальных критерия:
Нейтрализация. Как быстро и в какой степени кислоты и основания могут соединяться друг с другом.
Титрование с индикаторами. Способность кислот и оснований титровать друг друга при помощи индикаторов.
Вытеснение. Способность кислот и оснований вытеснять из соединений более слабую кислоту или основание.
Катализ. Способность кислот и оснований выступать в качестве катализатора.
Для того чтобы определить, к какому классу, кислот или оснований, относится вещество, необходимо, чтобы оно характеризовалось всеми четырьмя критериями. При этом нейтрализации и титрованию с индикаторами Льюис придавал особое значение. Согласно этому, он дал следующие определения.
Вещества, способные реагировать в обоих направлениях, Льюис отнес к амфотерным веществам.
Теория Льюиса
Готовые работы на аналогичную тему
В реакции взаимодействия аммиака с трифторидом бора аммиак отдает электронную пару (выступает в роли основания), а трифторид бора принимает (выступает в роли кислоты)
$NH_3 + BF_3 > NH_3BF_3$
Кислоты Льюиса ($L$-кислоты) и основания могут не содержать протонов, и тогда их называют апротонными.
Теория Льюиса не позволяет количественно определить силу кислот.
К основаниям по Льюису относятся следующие соединения:
вещества, содержащие аминный азот (алифатические и ароматические амины, аммиак, пиридин и др.);
Кислотами по Льюису являются:
галогениды алюминия, бора, кремния, мышьяка, олова, сурьмы, фосфора и др.;
Классификация кислот и оснований Льюиса
Жесткие кислоты характеризуются малым радиусом и высоким положительным зарядом. Они имеют высокую электроотрицательность, низкую поляризуемость, хорошие акцепторы электронных пар.
Мягкие кислоты имеют меньший заряд по сравнению с жесткими кислотами, обладают большей поляризуемостью и невысокой электроотрицательностью.
Промежуточные кислоты проявляют средние значения зарядов ядер, электроотрицательности и поляризуемости между жесткими и мягкими кислотами.
Жесткие основания имеют высокую электроотрицательность, плохо поляризуются и окисляются.
Мягкие основания имеют малую электроотрицательность, легко поляризуются, проявляют свойства сильных восстановителей.
Понятие кислотно- основного катализа
Например: по механизму специфического кислотного катализа протекают гидратация ненасыщенных альдегидов, гидролиз эфиров, ацеталей; специфический основный катализ характерен для гидратации альдегидов, альдольной конденсации и др.
Например: каталитическое превращение углеводородов нефти (каталитический крекинг, алкилирование, изомеризация) протекает по механизму общего кислотного катализа.
Электрофильный ( или нуклеофильный) катализ. Происходит под действием кислот или оснований Льюиса.
Электронная теория Льюиса рассматривает кислоты и основания более углубленно и широко, чем другие теории кислот и оснований.
Кислота Льюиса
Из Википедии — свободной энциклопедии
В рамках электронной теории химических соединений Льюиса химическая связь образуется обобществлённой электронной парой, достраивающей электронные оболочки атомов, образующих связь, до завершенной электронной конфигурации инертного газа (правило октетов).
В качестве кислот Льюиса могут выступать как нейтральные молекулы, так и катионы: так, катионы водорода выступают в роли кислоты Льюиса при взаимодействии с водой либо аммиаком, с образованием ионов гидроксония либо аммония.
Кислотами Льюиса являются также координационно ненасыщенные соединения — как металлов, так и неметаллов, например, BF3, AlCl3, образующие аддукты с различными основаниями Льюиса:
A l C l 3 + C l − → [ A l C l 4 ] − <\displaystyle <\mathsf 
Энциклопедичный YouTube
Субтитры
Сегодня поговорим о кислотах и основаниях с точки зрения органической химии, то есть согласно теории Брёнстеда и Лоури. Согласно ей кислота — донор протонов, а основание — акцептор протонов. Протон — это ядро наиболее распространённого изотопа водорода, лишённое электрона. У атома водорода всего 1 электрон. Это выглядит так. Из-за этого атом водорода в целом нейтрален. Разноимённые заряды нейтрализуют друг друга. Но если каким-то образом убрать электрон, останется только протон. Лишив атом отрицательного заряда, мы оставляем только положительно заряженное ядро атома, состоящее из единственного протона. Так выглядит протон с точки зрения органической химии. Вещества обмениваются протонами, и мы рассмотрим эти механизмы на примере химической реакции. Начнём с электронно-точечной формулы молекулы воды, имеющей 2 неподелённые электронные пары. Допустим, вода реагирует с хлороводородом, имеющим следующую электронно-точечную формулу. Связь между водородом и хлором образована электронами, один из которых отдаёт атом водорода, а другой — атом хлора. Согласно теории Брёнстеда-Лоури хлороводород является кислотой, потому что эта молекула отдаёт протон. А вода забирает протоны, становясь основанием согласно концепции Брёнстеда-Лоури. Неподелённая электронная пара кислорода, в свою очередь, присоединяет вот этот протон. А вот электрон этой связи переходит к атому хлора. Для наглядности выделю его голубым цветом. Вы видите их на электронно- точечной формуле. Давайте запишем продукты этой реакции вот здесь. Кислород присоединяет протон с помощью неподелённой электронной пары, приобретая положительный заряд. И у него остаётся ещё одна неподелённая пара. Считается, что в результате кислород получает формальный заряд +1. Вот так. Вторым продуктом будет хлорид-анион. Атом хлора получил дополнительный электрон. Снова покажу его голубым цветом. Этот электрон принадлежал атому водорода, а теперь принадлежит хлорид-аниону. Получив дополнительный электрон, атом хлора приобрёл отрицательный заряд. Его также можно считать формальным зарядом −1. Состоялся перенос протона от хлороводорода воде с образованием гидроксония и хлорид-аниона. Теоретически реакция равновесная, но хлороводород является сильной кислотой, и равновесие сильно смещается вправо. Вероятность обратной реакции мала, и я показал это стрелками разного размера. Хлороводород практически полностью диссоциирует в воде. В обратной реакции гидроксоний отдаёт протон, а хлорид-анион его присоединяет. Гидроксоний выступает в роли кислоты, а хлорид-анион — основания, присоединяя протон. Образуются вода и хлороводород. Так происходит в действительности. Кислотно-основные реакции находятся в равновесии, в них участвуют кислотно-основные пары. Слева хлороводород является брёнстедовской кислотой и отдаёт протон, превращаясь в сопряжённое основание — хлорид-анион. Хлороводород и хлорид — кислотно-основная пара. Друг от друга они отличаются только протоном. Есть и вторая кислотно-основная пара. Вода слева является брёнстедовским основанием, а гидроксоний справа — сопряжённой кислотой. Это также кислотно-основная пара. Они также отличаются только протоном. Чем сильнее кислота, тем слабее сопряжённое основание. Хлороводород на самом деле — сильная кислота, следовательно, хлорид-анион является крайне слабым основанием и очень слабо отнимает протон. Это общий принцип. Хлороводород — очень сильная кислота, хлорид — слабое основание. В органической химии есть и другая концепция кислот и оснований — теория Льюиса. Кислота Льюиса — акцептор электронной пары, основание — донор электронной пары. Это проще запомнить по первым буквам английских слов: acid и acceptor. Начальные буквы в обоих случаях — a. Я думаю, это понятно. Во втором случае начальные буквы b и d, тоже не сложно. Маленькая мнемограмма для лучшего запоминания. Рассмотрим на примере химической реакции с использованием концепции Льюиса для кислот и оснований. У кислорода 2 неподелённые электронные пары. А вот формула борана. BH3. Вот его формула. У атома бора нет октета электронов, их всего 6. Бор не имеет октетов электронов. Но согласно периодической таблице октет возможен, поэтому боран очень активен. Атом бора находится в состоянии sp2-гибридизации, что означает наличие свободной p-орбитали. Эта орбиталь пустая. В этом причина высокой реакционной способности молекулы борана. Вернёмся к нашим реагентам. Вот они. Пустая орбиталь атома бора способна принять пару электронов вот этого самого атома кислорода. Давайте рассмотрим это чуть более подробно. Орбиталь будет заполнена, образуется связь. Изобразим это. Итак, в результате реакции у кислорода остаётся 1 неподелённая пара электронов. Вторая образует связь с атомом бора, который по-прежнему связан с водородом. Что насчёт формальных зарядов молекул? Давайте подумаем об этом. +1 на кислороде и −1 на боре. Это кислотно-основная реакция, потому что оксолан отдаёт пару электронов, являясь основанием Льюиса как донор. Оксолан отдаёт пару электронов, являясь основанием Льюиса как донор. Боран принимает пару электронов, являясь, таким образом, кислотой. Концепция кислот и оснований Льюиса лежит в основе органической химии, важно знать её. Теория Брёнстеда-Лоури используется довольно часто, её нужно знать очень хорошо.
Что такое кислоты льюиса
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
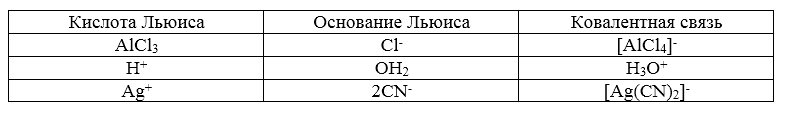
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.