что такое кетоацидоз при голодании
Положительный ацетон и кетоацидоз

Кетоацидоз – это угрожающее жизни патологическое состояние, характеризующееся высоким уровнем кетоновых тел, обычно на фоне повышенного содержания глюкозы и низкого уровня инсулина в крови. Характерен для сахарного диабета. Также при кетоацидозе наблюдается снижение рН, «закисление» организма.
Причины кетоацидоза
Среди факторов, вызывающих кетоацидоз у диабетиков, выделяют:
Во время болезни или в период обострения хронического заболевания люди, страдающие диабетом, должны измерять ацетон в крови 2-3 раза в день, чтобы вовремя заметить начало развития кетоацидоза. Тяжелый кетоацидоз и кома развиваются при декомпенсированном сахарном диабете. Большое количество кетоновых тел в крови и моче способствуют вымыванию минералов из костей, сбоям в работе дыхательной, сердечно-сосудистой систем, приводят к коме.
Симптомы диабетического кетоацидоза
Заподозрить развитие этого патологического состояния можно по нескольким признакам:
Анализ мочи показывает наличие кетонов. В этом случае необходима врачебная помощь. До приезда врача больному дают пить щелочную воду, при сопровождающей кетоацидоз гипогликемии – виноградный сок.
Диагностика и лечение кетоацидоза
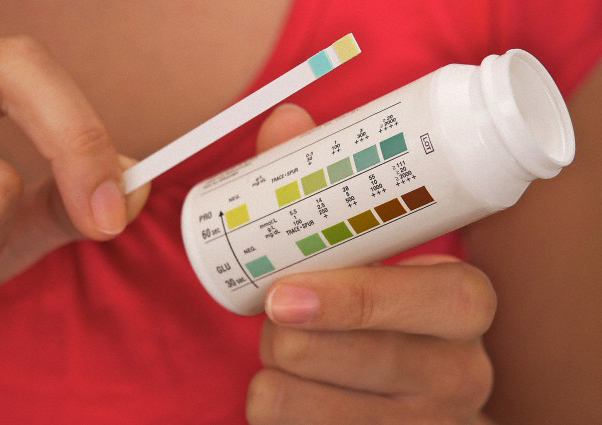
Домашняя диагностика заключается в использовании тест-полосок для мочи и измерении сахара крови глюкометром. Тест-полоски на ацетон дают только визуальную оценку уровня кетоновых тел. При средних или высоких показателях (согласно окрашиванию полоски) больного госпитализируют и проводят лабораторный анализ крови и мочи. Определяют сахар, ацетон и рН.
Лечение направлено на восполнение минералов, снижение уровня глюкозы. Для этого больному вводят инсулин короткого действия, солевые растворы или физиологический раствор внутривенно капельно. После нормализации состояния переходят на подкожное введение инсулина и обильное питье. При введении солевых растворов мониторят венозное давление. Большое количество жидкости может привести к отеку легких или мозга.
При критически низком рН крови допустим дополнительный прием соды внутрь или в виде клизм. Использование соды спорно, не одобряется частью врачебного сообщества.
Больные диабетом обязательно должны контролировать уровень кетонов в крови самостоятельно в домашних условиях. Особенно при повышении глюкозы до 14 ммоль/л. Если с легкой степенью кетоацидоза справиться не удается, необходима срочная госпитализация!
Голодный кетоацидоз: все что нужно знать
Голодный кетоацидоз: что нужно знать
Голодный кетоацидоз возникает, когда человек претерпел длительный период голодания. Во время голодного кетоацидоза жирные кислоты заменяют глюкозу в качестве основного источника топлива для организма.
Голодный кетоацидоз встречается редко, но у некоторых риск его развития выше, чем у других. В группу повышенного риска входят больные расстройствами пищевого поведения.
Голодный кетоацидоз может быть серьезным заболеванием, если не обращаться за лечением, и даже может привести к смерти.
В этой статье более подробно обсуждается голодный кетоацидоз, включая его симптомы, а также способы его лечения и профилактики.
Что такое голодный кетоацидоз?
Кетоацидоз — это метаболическое состояние, связанное с высоким уровнем кетонов в крови. Кетоны накапливаются, когда организм расщепляет жирные кислоты, чтобы использовать их для получения энергии вместо углеводов.
Голодный кетоацидоз возникает, когда организм не получает достаточно глюкозы в качестве основного источника энергии в течение длительного периода.
Есть разные причины, по которым человек может голодать долгое время, в том числе:
Легкий кетоз — означает, что организм использует жир в качестве источника энергии — может возникнуть после 12–14 часов голодания.
Кетоацидоз возникает, когда из-за накопления кетонов кровь становится кислой. При голодном кетоацидозе, когда в организме заканчивается жир, он начинает разрушать мышцы, в результате чего аминокислоты и лактат попадают в кровь. Затем печень расщепляет их на сахар, который используется в качестве топлива.
Переход от кетоза к кетоацидозу может произойти после 2–3 дней голода. Еще через пару дней может начаться разрушение мышц.
Голодный кетоацидоз: другие виды
Согласно статье 2020 года, существует три типа кетоацидоза:
Диабетический кетоацидоз
Диабетический кетоацидоз возникает, когда в организме заканчивается инсулин, что может быть опасно для жизни.
Диабетический кетоацидоз может возникнуть у больных диабетом 1 или 2 типа, но с большей вероятностью он повлияет на больных диабетом 1 типа.
Алкогольный кетоацидоз
Согласно обзору 2020 года, алкогольный кетоацидоз чаще всего поражает тех, кто употребляет чрезмерное количество алкоголя и обнаруживает, что возникающие в результате симптомы, такие как тошнота, беспокойство и боль в животе, не позволяют им есть твердую пищу в течение 1-3 дней.
Алкогольный кетоацидоз возникает, когда организм не может использовать глюкозу из своего рациона.
Алкоголь в их крови снижает уровень сахара в крови и препятствует выработке глюкозы печенью.
Симптомы и предупреждающие знаки
Признаки и симптомы голодного кетоацидоза могут включать:
В отчете о случаях за 2020 год представлена информация о больных психическими расстройствами и голодным кетоацидозом. Авторы приходят к выводу, что постановка точного диагноза может быть более сложной задачей для больных психическими расстройствами, поскольку они могут быть не в состоянии предоставить точную историю своего здоровья или пищевых привычек. В результате может быть задержка лечения.
Причины
Возможные причины голодного кетоацидоза включают:
Факторы риска
При легком доступе к пище риск развития голодного кетоацидоза снижается.
Однако периодическое голодание, особенно в сочетании с экстремальной диетой, такой как кетогенная диета, может подвергнуть более высокому риску развития кетоацидоза. Если вы заинтересованы в соблюдении специализированных диет, таких как кето-диета, вам следует поговорить со своим врачом перед тем, как начать диету.
А в статье 2020 года перечислены следующие факторы риска развития кетоацидоза при голодании:
Диагностика
Голодный кетоацидоз нечасто встречается у здоровых людей, так как это происходит из-за недостатка глюкозы в рационе после длительных периодов голодания.
Поэтому, когда возникает голодный кетоацидоз, врач может искать другие причины потери веса, которые могут задержать диагностику и лечение.
Если наблюдается необъяснимая потеря веса, обязательно следует сообщить своему врачу о:
Согласно статье 2020 года, врачу сначала необходимо стабилизировать состояние пациента перед проведением необходимых анализов, включая анализы крови, чтобы проверить наличие электролитных аномалий и дефицита витаминов. Если пациенту поставят диагноз голодного кетоацидоза, врач назначит ему соответствующее лечение.
Лечение
Голодный кетоацидоз возникает, когда организм лишается необходимой пищи и энергии в течение длительного периода. Хотя еда может показаться очевидным лечением, она может быть опасна для тех, кто долгое время недоедает.
Когда врач лечит пациента от голодного кетоацидоза, ему необходимо тщательно мониторить электролиты. В процессе введения пищи врачи должны будут проверить и восстановить у больного калий, фосфат и магний.
В одном тематическом исследовании участвовал больной, страдающий анорексией, у которого развился голодный кетоацидоз. Врачи лечили его раствором декстрозы в течение 15 часов, за это время состояние кетоацидоза уменьшилось.
При правильном лечении, включая лечение основных заболеваний, таких как анорексия, пациент должен полностью выздороветь.
Осложнения
Когда возникает голодный кетоацидоз, организм часто начинает быстро истощаться. Другими словами, больные станут выглядеть более тонкими или вытянутыми, а их кости станут более выраженными.
Другое осложнение состоит в том, что больной может испытывать вялость и серьезную потерю силы из-за того, что тело начало разрушать мышцы.
Без лечения кетоацидоз может быть смертельным.
Вывод
Голодный кетоацидоз — необычная форма кетоацидоза. Он происходит, если регулярно не потреблять достаточное количество пищи, или организм не может правильно усваивать питательные вещества.
Врач может проверить наличие голодного кетоацидоза с помощью анализов крови и должен будет наблюдать за пациентом, когда он снова начнет есть.
Большинство здоровых людей не подвергаются риску. Однако те, кто страдает расстройствами пищевого поведения, и те, кто прошел определенные медицинские процедуры, могут иметь более высокий риск развития голодного кетоацидоза.
Полное выздоровление обычно возможно после лечения.
Этот блог не предназначен для обеспечения диагностики, лечения или медицинских советов. Информация на этом блоге предоставлена только в информационных целях. Пожалуйста, проконсультируйтесь с врачом о любых медицинских и связанных со здоровьем диагнозах и методах лечения. Информация на этом блоге не должна рассматриваться в качестве замены консультации с врачом. Заявления, сделанные о конкретных товарах в статьях этого блога не подтверждены для лечения, диагностики или предотвращения болезней.
Кетоацидоз при сахарном диабете
Кетоацидоз при диабете — состояние, возникающее при декомпенсации данного заболевания из-за повышения концентрации глюкозы и кетоновых тел в крови. Для него характерно развитие жажды, повышение объема суточного диуреза, сухость кожи, наличие ацетонового запаха в выдыхаемом воздухе и боли в животе. Со стороны центральной нервной системы пациенты, как правило, отмечают головные боли, повышенную раздражительность или же заторможенность, снижение работоспособности, вялость. Диагностировать кетоацидоз можно на основании лабораторных биохимических анализов.
Механизм развития декомпенсации
Развитие кетоацидоза при диабете связано с недостаточным содержанием инсулина в организме. Без влияния этого гормона поджелудочной железы утилизация глюкозы невозможна, поэтому развивается ситуация, которую можно назвать «голод среди изобилия». При этом патологическом состоянии сахара в организме достаточно, но его использование в качестве источника энергии невозможно.
Параллельно повышается выброс адреналина, кортизола, соматотропного и адренокортикотропного гормона, глюкагона. Это приводит к стремительному повышению уровня глюкозы в организме. После превышения почечного порога она начинает выводиться через почки вместе с большим объемом жидкости и ионов.
Вследствие сгущения крови развивается гипоксия тканей, из-за которой происходит окисление молекул глюкозы посредством анаэробного пути. Это способствует повышению концентрации лактата и последующему развитию лактатацидоза. Вместе с этим в качестве альтернативного источника энергии организм пытается использовать жирные кислоты, которые служат основой для образования кетоновых тел, что и приводит к развитию ацидоза.
Причины возникновения кетоацидоза
Спровоцировать развитие данного состояния может целый ряд факторов, среди основных:
У каждого 4-го пациента невозможно выявить истинную причину, которая послужила пусковым механизмом для развития кетоацидоза, поскольку данное состояние невозможно связать ни с одним из факторов, которые были перечислены. Повышенная потребность в инсулине также возникает из-за усиленного роста организма, гормональной перестройки или нервного перенапряжения.
Симптомы кетоацидоза
С клинической картиной декомпенсации сахарного диабета должен быть знаком каждый пациент, имеющий в анамнезе данное заболевание. Среди основных симптомов особое внимание стоит обратить на:
При прогрессировании кетоацидоза возможна потеря сознания.
Усугубление состояния пациента, снижение фотореакции зрачков может сигнализировать о развитии кетоацидотической коме.
Что делать при кетоацидозе и кетоацидозной коме?
Важно понимать, что при развитии этого критического состояния пациент нуждается в оказании неотложной медицинской помощи, которая может проводиться только в условиях стационара. В клинике для стабилизации состояния человека используются следующие направления:
Инсулинотерапия направлена на ликвидацию биохимических изменений в организме, которые привели к развитию кетоацидоза. Для увеличения концентрации он вводится короткими дозами по 4-6 единиц каждый час. Это способствует замедлению липолиза, образованию кетоновых тел и торможению выброса глюкозы печенью, что благоприятно сказывается на синтезе гликогена.
Для регидратации организма используется введение 0,9% физиологического раствора с хлористым натрием. При повышенном уровне натрия в крови восполнение жидкости осуществляется за счет 0,45% раствора. По мере устранения дефицита восстанавливается функционирование почек, происходит снижение уровня глюкозы за счет ее активного выведения с мочой.
Важным моментом также остается коррекция кислотности. При адекватной концентрации сахара и достаточном запасе жидкости стабилизация кислотно-щелочного баланса происходит самостоятельно. pH сдвигается в сторону щелочного показателя, синтез кетоновых тел прекращается, а восстановленная выделительная система справляется с их выведением.
Профилактика кетоацидоза
При своевременном и правильном плане лечения кетоацидоз удается купировать в условиях стационара. Однако при отсутствии возможности проведения терапевтических мероприятий патологическое состояние быстро перетекает в кому. Летальность при ее развитии составляет 5%, а у пациентов пожилого возраста (старше 60 лет) — до 20%.
Профилактика развития кетоацидоза базируется на обучении людей, страдающих сахарным диабетом. Пациенты должны знать начальные симптомы данного патологического состояния, правила инъекционного использования инсулина и основы контроля концентрации глюкозы. Получения максимального количества информации о заболевании поможет человеку соблюдать здоровый образ жизни, придерживаться ы, составленной диетологом. Важно помнить, что при появлении первых признаков декомпенсации нужно обращаться за медицинской помощью для предотвращения развития осложнений.
Что такое голодные кетоны и нужно ли их бояться
Большинство диабетиков боятся кетонов. Вспоминая прошлый опыт воображение сразу рисует в голове капельницы, больничную койку, слабое немощное состояние, дикую жажду и противный запах сладко-прелых фруктов. Брррр!
Но не стоит путать состояние кетоза, когда в крови повышен уровень кетонов, но сахар при этом в пределах нормы, с кетоАЦИДОЗОМ, когда кетоны и уровень глюкозы крови повышены, а организм обезвожен.
В этом материале хочется подробнее остановится на ГОЛОДНЫХ КЕТОНАХ. Многие диабетики обнаруживают их у себя по утрам. Откуда они берутся, почему и надо ли их бояться?
Наш организм способен получать энергию из двух источников: внешних (еда) и внутренних (запасы гликогена и жира). Если вы соблюдаете строгую диету; едите мало пищи, богатой углеводами; регулярно занимаетесь активной физической нагрузкой, испытываете сильный стресс или есть проблемы с пищеварением и усвоением пищи, то чтобы обеспечить себя энергией, организм начинает использовать припасы из жирового депо.
Откуда берутся голодные кетоны у диабетиков
Симптомы повышенного уровня кетоновых тел
Все индивидуально. Стандартные симптомы следующие: чувство разбитости, усталости, легкая тошнота, озноб. Особо чувствительные могут испытывать при этом состояние, схожее с лихорадкой во время гриппа или простуды. А кто-то и вовсе не ощущает никаких симптомов.
Опасны ли голодные кетоны
Зависит от состояния здоровья в целом, вашего самочувствия, и того, насколько сильно кетоны повышены. В целом же, ученые пришли к выводу, что незначительное повышение уровня кетоновых тел (при условии, что у вас при этом нормальное самочувствие, все в порядке с почками и компенсацией диабета) не опасно для здоровья. Если же наличие кетонов тревожит вас и приводит к плохому самочувствию, настоятельно рекомендуем обратиться к врачу.
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 1
Кетоновые тела (ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами обмена углеводов, жиров, белков. Кетокислоты — это продукт метаболизма ацетил-коэнзима А (ацетил-КоА), который при дефиците пищи образуется либо из собственных белков, либо из жира. К кетоновым телам относятся β-оксимасляная кислота (β-оксибутират), ацетоуксусная кислота (ацетоацетат) и ацетон.
Физиология энергетического обмена
Кетоновые тела синтезируются в основном в митохондриях печеночных клеток из ацетил-КоА, который объединяет несколько ключевых метаболических процессов клетки. Главная функция ацетил-КоА — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот (ЦТК, цикл Кребса), чтобы те были окислены с выделением энергии. Содержание ацетил-КоА определяет направление клеточного метаболизма в данный момент: будет ли происходить синтез и накопление гликогена, жира и синтез белков или, наоборот, будут расходоваться ранее накопленные энергозапасы в организме.
Образование кетоновых тел является физиологическим процессом и необходимой частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, белков, жиров и других энергосубстратов с образованием энергии, которая либо превращается в тепло, либо аккумулируется в виде аденозинтрифосфата (АТФ).
В условиях дефицита энергии в организме воссоздание энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез).
Кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в этих условиях. Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона — мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза [1].
Глюконеогенез — это метаболический путь биосинтеза глюкозы из не углеводных предшественников, активный в печени, почках, тонком кишечнике. Когда запасы гликогена в организме исчерпываются, печень переходит на синтез его путем глюконеогенеза. Субстратами глюконеогенеза являются: пировиноградная кислота (пируват), молочная кислота (лактат), глицерол, глюкогенные аминокислоты, жирные кислоты.
Трансформация пировиноградной кислоты возможна двумя путями — аэробным или анаэробным. Гликолиз, или путь Эмбдема–Мейергофа, — основной путь утилизации глюкозы в клетках. Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединенных в пируватдегидрогиназный комплекс (ПДК).
При аэробных условиях пируват проникает в митохондрии. Образованный ацетил-КоА в цикле Кребса окисляется до СО2 и Н2О. Основная часть глюкозы расходуется на синтез АТФ в процессе окислительного фосфорилирования.
Если содержание кислорода недостаточно, как это может быть в скелетных мышцах при интенсивной физической нагрузке или в тканях, где нет или очень мало митохондрий (эритроциты, белые мышцы, клетки сетчатки глаза, мозгового слоя коры надпочечников), гликолиз является конечным энергетическим процессом, в результате которого пируват преобразуется в лактат, а последний в продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Избыток лактата поступает в печень, где из него вновь синтезируется глюкоза (глюконеогенез). Таким образом, лактат используется в глюконеогенезе постоянно.
При мышечной работе глюкоза в миоците используется не только на энергетические нужды, но и на обеспечение постоянного притока оксалоацетата в ЦТК. При этом с увеличением продолжительности нагрузки «энергетическая» роль глюкозы снижается [2].
Ацетил-КоА является ключевым метаболитом липидного обмена. Он образуется при β-окислении жирных кислот в митохондриях печени. В матриксе митохондрий печеночных клеток происходит окисление жирных кислот в цикле Кноппа–Линена. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии через внутреннюю мембрану последних. Этот процесс является инсулинозависимым. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы.
Аминокислоты (лейцин, тирозин, фенилаланин), образующиеся в результате распада мышечных белков, включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. В процессе катаболизма они превращаются в ацетоацетат и могут использоваться в синтезе кетоновых тел.
Включение лактата, глицерола и аминокислот в глюконеогенез зависит от физиологического состояния организма. При окислении одной молекулы β-оксибутирата образуется СО2 и Н2О и обеспечивается синтез 27 молекул АТФ.
Биологическая роль кетоновых тел
Кетоновые тела играют важную роль в поддержании энергетического баланса. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для «экспорта» ацетоацетата из гепатоцитов в кровь.
У здоровых при усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела [3].
Кетоновые тела это часть метаболического регулярного механизма для предотвращения излишней мобилизации жирных кислот и сдерживания протеолиза, что сберегает структурные белки организма. В норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга [4]. В норме процессы синтеза и использования кетоновых тел уравновешены. Концентрация кетоновых тел в крови и в тканях обычно очень низка, поэтому содержание кетоновых кислот в плазме крови в норме присутствует в крайне низких количествах и составляет 0,1–0,3 ммоль (0,03–0,2 ммоль/л по ацетону).
Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния в организме. Кетоновые тела удаляются с мочой в различных количествах: ацетон — 3–4%, ацетоуксусная кислота — 30–40%, β-гидроксимасляная — 60–70%.
Лабораторные тесты, выявляющие кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, так как они не реагируют с β-оксибутиратом. Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде, Герхарда. Количество ацетоацетата в анализе мочи измеряют в плюсах (от одного + до четырех ++++). Присутствие +++ соответствует повышению уровня кетоновых тел в 400 раз, ++++ — в 600 раз. Физиологический кетоз может выявляться при голодании, тяжелой мышечной работе, у новорожденных [5].
Причины избыточного кетоза
Возникающая в патологических условиях гиперкетонемия связана с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах, то есть либо скорость синтеза кетоновых тел в печени превышает скорость их утилизации периферическими тканями организма, либо нарушена утилизации их как источника энергии в других органах.
Повышение содержания кетоновых тел в организме прежде всего вызывается дефицитом углеводов для обеспечения организма энергией, перегрузкой белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощением организма, ожирением, нарушением эндокринной регуляции (сахарный диабет, тиреотоксикоз и др.), отравлением, травмами черепа и т. д. [4].
Интенсивное образование кетоновых тел происходит также при наличии дефицита оксалоацетата, так как последний является основным регулятором ЦТК. Обычно в клетке имеется баланс между образованием ацетил-КоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты. При недостаточном количестве оксалоацетата в плазме крови, наблюдаемом при патологических состояниях, концентрация кетоновых тел может значительно повышаться. Не успевая окисляться и представляя собой достаточно сильные органические кислоты, они вызывают развитие метаболического кетоацидоза.
Стимуляция кетогенеза при дефиците пищи, стрессе, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
Гиперкетонемия со сдвигом рН в кислую сторону может наблюдаться при угнетении цикла Кребса, в котором происходит «сгорание» кетоновых тел.
Скорость образования кетоновых тел зависит и от скорости окисления жирных кислот в печени, а процесс окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров [5].
При умеренном кетозе в крови циркулируют главным образом ацетоацетат и β-оксибутират. Ацетон образуется только при высоких концентрациях кетоновых тел и преимущественно удаляется через легкие.
Однако в экстремальных условиях из кетоновых тел с помощью глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
Ацетоновые тела, накапливаясь в крови и тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в адипоцитах. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови.
При дефиците энергии в результате изменения гормонального статуса и действия внутриклеточных механизмов регуляции нарастает скорость мобилизации жиров и усиливается глюконеогенез из аминокислот и глицерина. Липолиз активируется глюкагоном, адреналином. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел крови возникает угрожающий жизни декомпенсированный кетоацидоз.
Такая картина характерна при тяжелом течении сахарного диабета 1-го типа, гипогликемии, длительном голодании, стрессах различной этиологии, заболеваниях печени, тяжелой и длительной мышечной работе [6].
Кетоновые тела являются водорастворимыми кислотами, поэтому, в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3–5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается.
Сахарный диабет
Сахарный диабет 1-го типа является самой частой причиной кетоза и кетоацидоза. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно, гипергликемии и тяжелому энергетическому голоду в них. Инсулин влияет на все виды обмена. Дефицит инсулина при сахарном диабете является причиной резкого повышения в крови уровня всех контринсулярных гормонов (глюкагона, кортизола, катехоламинов, тироксина и др.). Они стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками. Снижается активность липопротеинлипазы (ЛП-липазы) адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань. Начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную триацилглицерол-липазу (ТАГ-липазу) в адипоцитах.
При сахарном диабете в избыточном количестве начинает образовываться продукт β-окисления жирных кислот — ацетил-КоА. Однако способность цикла Кребса утилизировать данный продукт существенно снижена, так как β-окисление свободных жирных кислот в митохондриях зависит от их транспорта через мембрану митохондрий. А этот процесс является инсулинозависимым.
Если он затруднен, то жирные кислоты быстро превращаются в ацил-КоА, из которого образуется ацетил-КоА. Цикл Кребса и ресинтез жирных кислот не в состоянии полностью использовать избыточно образующийся ацетил-КоА, тем более что цитратный цикл тормозится этим избытком. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы. Активность последней при декомпенсации диабета снижена, в частности, из-за ингибирующего влияния АТФ, образующейся в избытке при окислении жирных кислот.
Уменьшено и образование оксалоацетата, так как в результате усиленного окисления свободных жирных кислот и повышенного глюконеогенеза увеличивается соотношение NADH/NAD+. Это ведет к недостаточному образованию цитрата и накоплению ацетил-КоА.
Этому процессу способствует увеличение содержания в печени карнитина (особенно в условиях активации эффектов глюкагона). Карнитин стимулирует транспорт жирных кислот в митохондрии клеток печени, где они подвергаются β-окислению, значительно ускоряя кетогенез.
В результате избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона.
У больных сахарным диабетом 1-го типа нарушается белковый обмен, который характеризуется преобладанием процессов катаболизма в результате активации процесса глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка [6].
Гипоксия тканей вызывает активацию анаэробного гликолиза и повышение содержания лактата, который не может быть утилизирован в результате дефицита лактатдегидрогеназы на фоне дефицита инсулина. Это усугубляет нарушение кислотно-щелочного баланса организма и приводит к возникновению лактоацидоза.
Активное нарастание содержания кетоновых тел при декомпенсации сахарного диабета связано не только с усиленной продукцией, но со сниженной периферической утилизацией. При избыточном накоплении кетоновых тел буферная способность крови быстро истощается, что приводит к развитию декомпенсированного метаболического кетоацидоза. Кетоновые тела начинают выделяться с мочой в виде натриевых солей, а ацетон — также и в составе выдыхаемого воздуха.
Следствием увеличения концентрации ацетоацетата является ускорение образования ацетона, который обладает токсическим свойством. Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего — клетки нервной ткани. Нарушается работа многих ферментативных систем. Это может проявляться потерей сознания [7].
При сахарном диабете 2-го типа сохраняется минимальная продукция инсулина, что объясняет редкость развития липолиза и состояния кетоацидоза и кетоацидотической комы при нарастании гипергликемии.
Гипогликемия и гипогликемические состояния
Кетотическая гипогликемия является самой частой причиной низкой концентрации глюкозы в крови. Стимуляция кетогенеза в условиях синдрома гипогликемии связана с активацией процессов липолиза при тяжелом энергетическом голоде. По мере истощения запасов гликогена в печени повышается содержание глюкагона, адреналина, норадреналина, кортизола, гормона роста, которые стимулируют глюконеогенез [8, 9].
Из жировой ткани интенсивно метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и β-оксибутирата.
Гипогликемии при дефиците ферментов
Нарушения обмена гликогена, связанные с его патологическим депонированием, проявляются гликогеновыми болезнями. Это группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза (агликогенозы) или распада гликогена (гликогенозы).
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке). Первичное нарушение при болезни Гирке (гликогеноз 1-го типа) происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата.
Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Характерными чертами заболевания являются: олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [10].
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенитальная дистрофия).
Синдром Лоренса–Муна–Бидля–Борде характеризуется ожирением, гипогонадизмом, умственной отсталостью, дегенерацией сетчатки, полидактилией, глубокими дегенеративными изменениями гипоталамо-гипофизарной системы.
Синдром Дебре–Мари — заболевание обусловлено гиперфункцией задней доли гипофиза и гипофункцией аденогипофиза. Проявляется в раннем детском возрасте. Больные инфантильны, низкорослы, с избыточной массой. В клинической картине типично нарушение водного обмена с олигурией и олигодипсией, плотность мочи высокая. Психическое развитие не нарушено.
Синдром Пехкранца–Бабинского — причиной заболевания считают органические и воспалительные изменения гипоталамуса, которые ведут к ожирению, аномалиям развития скелета и гипоплазии половых органов.
Ожирение
Бурное нарастание ожирения во всех возрастных группах людей в большей степени связано с изменением образа жизни: снижение двигательной активности (компьютеризация, автомобилизация, урбанизация), изменения характера питания (переедание) и т. д. Избыточное поступление энергии или снижение ее затраты приводит к увеличению массы тела и развитию ожирения.
Жировая ткань обладает высокой метаболической активностью. В ней непрерывно совершаются интенсивные процессы обмена веществ, такие как синтез и гидролиз липидов, синтез жирных кислот, в том числе из углеводов, их этерификация в триглицериды или нейтральный жир, депонирование и расщепление их с образованием жирных кислот, использование последних для энергетических целей.
Ожирение приводит к значительным метаболическим и обменным нарушениям. Они характеризуются гиперинсулинизмом и нарушением толерантности к глюкозе; инсулинорезистентностью, вызываемой нарушением инсулинорецепторных взаимоотношений; увеличением содержания свободных жирных кислот в крови, склонностью к кетогенезу при голодании и к гипертриглицеридемии. При ожирении понижается активность липолитических ферментов в жировой ткани: липазы триглицеридов, что приводит к их накоплению, и липопротеинлипазы. Расщепление липопротеидов снижается. Гипертрофированные адипоциты слабее, чем гиперплазированные, реагируют на адреналин, норадреналин и другие липолитические вещества [11].
Важным проявлением нарушения межуточного обмена при ожирении является кетоз, связанный с повышенным липолизом, избыточным поступлением свободных жирных кислот в печень. Скорость реакции в ЦТК снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА используется для синтеза кетоновых тел. Из-за избытка кетоновых тел нарушается их утилизация.
Этому способствует наблюдающаяся гипогликемия, гиперлипидемия, кетонемия при применении длительной гипокалорийной диеты. А сопутствующий дефицит углеводов тормозит использование ацетил-КоА в цикле Кребса. При дефиците углеводов в организме возникает недостаток энергии в клетках. Усиливается липолиз [12].
Избыток неэстерифицированных жирных кислот, поступающих в печень, вызывает развитие жировой инфильтрации в ней, что нарушает окисление и выведение липопротеидов из печени, обуславливая накопление кетоновых тел. Для эффективного использования продуктов распада жира необходимы продукты углеводного обмена — жиры «сгорают» в пламени углеводов.
Окончание статьи читайте в следующем номере.
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва