что такое католическая реакция
Что такое католическая реакция
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
Рис. 9-12. В присутствии катализатора Al2O3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.
Как же работают катализаторы? Ответ на этот вопрос известен далеко не всегда. Однако в ряде случаев каталитические превращения изучены хорошо и химикам понятен механизм этих реакций. Термин «механизм реакции» раньше нам не встречался, поэтому необходимо объяснить его значение. Выяснение механизма реакции – это установление строения короткоживущих промежуточных частиц, возникающих на пути от реагентов к продуктам реакции. Такие неустойчивые промежуточные вещества часто невозможно выделить, но они могут быть изучены косвенными методами. Именно от строения и устойчивости (или неустойчивости) промежуточных частиц зависит скорость любой реакции и выбор того или иного её направления.
Например, использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 о С. Это говорит о еще более значительном снижении энергии активации и ускорении реакции:
Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н + (первая строчка в приведенной ниже схеме):
Разрыв связи С-О в этаноле происходит с образованием двух частиц, из которых неустойчива только одна (карбокатион), а вторая (Н2О), напротив, очень устойчива. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 23 Мб).
** Эта реакция называется реакцией дегидрирования (отщепления водорода). Она такая же эндотермическая, как и реакция дегидратации (отщепления воды). Однако при каталитическом дегидрировании, по сравнению с реакцией без катализатора, возникает новый, весьма важный фактор: выделяющийся в реакции водород тут же окисляется на меди кислородом воздуха с выделением большого количества теплоты. Это приводит к тому, что суммарный тепловой эффект всей последовательности реакций оказывается экзотермическим. Избыточной теплоты выделяется так много, что медная спираль (катализатор) в ходе реакции раскаляется.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 16 Мб).
Если механизмы многих гомогенных каталитических реакций с участием кислот (кислотный катализ) или оснований (основной катализ) хорошо изучены, то о гетерогенном катализе этого сказать нельзя. Однако некоторые его закономерности все же известны.
Во-первых, в гетерогенном катализе большую роль играет адсорбция, то есть концентрирование веществ на поверхности раздела между ними. Например, адсорбция молекул газа происходит на поверхности твердого пористого катализатора. Благодаря адсорбции на поверхности катализатора растет концентрация реагирующих частиц, что уже само по себе может приводить к ускорению реакции. Поэтому важным фактором в гетерогенном катализе является площадь поверхности катализатора, его пористость. Чем больше поверхность, тем выше каталитическая активность твердого катализатора. Количество взятого катализатора тоже влияет на скорость реакции.
В этих реакциях образуются цис-алкены. Геометрическое строение продуктов реакции позволяет предположить, что молекула водорода присоединяется к алкину с поверхности катализатора. Если бы это было не так, то образовывался бы более устойчивый транс-алкен:
Еще одна особенность гетерогенного катализа заключается в том, что около поверхности работающего катализатора всегда концентрируются как исходные вещества, так и продукты реакции. Если продукты адсорбируются на катализаторе слишком прочно, то они плохо вытесняются с поверхности и катализатор постепенно теряет активность. В этом случае говорят, что катализатор отравляется продуктами реакции. Однако во многих случаях каталитическими ядами являются даже не продукты реакции, а различные примеси в исходных веществах. Например, для платиновых катализаторов такими каталитическими ядами являются примеси HCN, H2S, соединений As, Se, Te.
Наибольшее применение гетерогенный катализ находит в промышленном производстве органических веществ. Однако не менее необходим он и при получении таких важных неорганических продуктов, как аммиак NH3 и оксид серы SO3 (последний нужен для производства серной кислоты).
В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al2O3 и K2O. Эти оксиды служат промоторами.
В производстве серной кислоты для получения SO3 раньше в качестве катализатора использовали металлическую платину. На современных сернокислотных заводах работают значительно более дешевые ванадиевые катализаторы (V2O5) с добавками SiO2 и K2О.
В более короткой форме реакцию получения полиэтилена можно выразить уравнением:
Индекс n в формуле полимера называется степенью полимеризации (значение n может достигать десятков тысяч). В результате происходящей сшивки молекул этилена образуются длинные макромолекулы полиэтилена с молекулярной массой от 30000 до 800000 в зависимости от условий реакции. На конце каждой такой гигантской молекулы имеется «пришитый» к ней инициатор, однако его содержание в общей массе полиэтилена ничтожно мало.
В одном параграфе невозможно рассмотреть все многообразие каталитических реакций, известных в неорганической и органической химии, в биохимии (ферментативный катализ), в технике (автомобильные катализаторы дожигания выхлопных газов) и т.д. Здесь мы ставили задачу разобраться лишь в некоторых ключевых вопросах, а именно:
Рекомендуем читателю еще раз вернуться к этим вопросам и ответить на них самостоятельно для закрепления пройденного материала.
Катализаторы
Примерно 90% объема современного химического производства основано на каталитических процессах.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Катализируемые реакции
Ускорение химических реакций катализатором
Определение катализируемых реакций
Катализируемые реакции обычно используются для увеличения скорости протекания химических процессов. Задача катализатора — обеспечить альтернативный, низкоэнергетический путь протекания реакции. Для этого каталитическое вещество взаимодействует с реагентом и образует промежуточное соединение. Это промежуточное вещество является переходным, поскольку после образования оно разрушается, а исходные каталитические компоненты остаются неизменными. Катализатор не расходуется в процессе реакции и не влияет на химическую структуру и массу по ее окончании.
Существует два основных типа катализируемых реакций:
Что нужно исследовать в каталитических реакциях?
Ценность исследования катализируемых реакций с использованием in situ ИКФС
Примеры каталитических реакций
Практический пример: определение промежуточных продуктов в реакции с участием октакарбонил-дикобальта
Адаптировано с разрешения Tuba, R., Mika, L., Bodor, A. Pustai, Z., Toth, I. and Horvath, I., “Mechanism of the Pyridine-Modified Cobalt-Catalyzed Hydroxymethoxycarbonylation of 1,3-Butadiene”, Organometallics, 22, 2003, 1582–1584. Copyright (2018) American Chemical Society.
Используя спектрометрию ReactIR высокого давления, исследователи изучили гидрометоксикарбонилирование 1,3-бутадиена в метил-3-пентеноате. Как известно, присутствие пиридина Co2(CO)8 катализирует эту реакцию. На момент проведения исследования не было выявлено никаких промежуточных продуктов, и одной из целей проекта было идентифицировать такие продукты.
Спектрометр ReactIR помог выявить и идентифицировать промежуточные продукты кобальта, а также глубже понять механизм катализа.
В этом примере благодаря спектрометру ReactIR удалось обнаружить промежуточное соединение кобальт-пиридин и получить информацию о механизме катализа. Также с помощью прибора было установлено, что скорость конверсии была намного выше, когда в качестве растворителя использовали пиридин. Это демонстрирует эффективность применения ИКФС in situ для определения лучшего сочетания катализатора и растворителя и оптимизации каталитической реакции.
Практический пример: каталитическое несимметричное гидрирование в непрерывном потоке
Rueping, M., Bootwicha, T., Sugiono, E., “Continuous-flow catalytic asymmetric hydrogenations: Reaction optimization using FTIR in-line analysis, Beilstein J. Org. Chem. (2012), 8, 300–307.
В этом исследовании ученые впервые продемонстрировали возможность провести каталитическую реакцию несимметричного гидрирования с переносом водорода с помощью методов химии непрерывных потоков. Для контроля за образованием продукта использовали систему ReactIR, оборудованную специально разработанной проточной ячейкой ATR в сочетании с микрореактором. Поскольку одна из целей работы заключалась в том, чтобы найти оптимальный набор условий для реакции, ReactIR подключили в конце потока реакции.
Первоначально исследователи изучали несимметричное гидрирование бензоксазина в присутствии дигидропиридина, полученного по методу Ганча, в качестве источника водорода и хирального кислотного катализатора Бренстеда. Для отслеживания рассматривали полосы ИК-спектра в диапазонах 1479 см-1 и 1495 см-1 для бензоксазинового реагента и продукта дигидробензоксазина соответственно.
Применение ИКФС для отслеживания этих полос в режиме реального времени позволило оптимизировать реакцию.
Одно из множества преимуществ использования технологии непрерывного микропотока для исследования реакций — возможность быстро менять параметры реакции, такие как концентрация реагента и катализатора, скорость потока и температура, а также наблюдать за влиянием этих изменений на результат.
В ходе катализируемого несимметричного гидрирования бензоксазина до дигидробензоксазина температуру реакции повышали с 5 o C до 60 o C. Авторы сообщают о том, что добились выхода продукта 98 % путем проведения реакции при 60 o C, скорости потока 0,1 мл и времени удержания 1 час.
Используя данные первоначальной работы, исследователи продолжили применять этот протокол реакции к ряду бензоксинов, хинолинов, хиноксалинов и 3H-индолов. Для каждой серии были оптимизированы условия реакции.
Авторы пришли к выводу, что «с помощью ИК-Фурье-спектроскопии в технологическом потоке можно оперативно отслеживать параметры отдельной реакции и намного быстрее определять оптимальные условия реакции по сравнению с классической методикой, при которой анализ проводят после реакции».
Понимание каталитической реакции с помощью in situ ИКФС
Новая система ReactIR 702L
Маленький и легкий
Обтекаемый корпус легко разместить в ограниченных пространствах, например в вытяжном шкафу.
Мониторинг реакции в любых химических условиях
Система доступна в разных конфигурациях для реакторов периодического и непрерывного действия, а также для различных условий, включая повышенное давление и (или) температуру, а также присутствие коррозионных реагентов.
Без жидкого азота.
Измерение спектра выполняется в непрерывном режиме без участия оператора. Длительность такого анализа полностью охватывает процесс синтеза.
Мощное программное обеспечение
Программное обеспечение iC IR позволяет настраивать и получать профили реакции простым и интуитивно понятным способом. Имеется пакет ПО iC для кинетического анализа — iC Kinetics and Reaction Progress. Оно позволяет быстро определять скорости реакции на основании данных ИК-спектра.
Понимание несимметричных катализируемых родием карбеноидных реакций.
В этом вебинаре профессор химии Университета Эмори Хув М. Л. Дэвис (Huw M. L. Davies) рассказывает о том, как ИК-Фурье спектроскопия помогает понять влияние катализатора, субстрата и предшественника карбеноида на скорость и эффективность реакций, катализируемых родием. В рамках исследования были разработаны оптимизированные системы с TON свыше 1 000 000.
Эта презентация включает следующие темы:
Мониторинг каталитических реакций в режиме реального времени
Автоматизация каталитических реакций
Катализируемые реакции в отраслевых публикациях
Ниже представлен ряд отраслевых публикаций, в которых для исследования гетерогенных и гомогенных катализируемых реакций применяли ИКФС in situ:
Каталитические реакции
1.4. Каталитические реакции
Каталитическими называются реакции, протекающие с участием веществ-катализаторов, не входящих в состав конечных продуктов. Катализаторы вступают во взаимодействие с участниками данной реакции, образуют с ними те или иные промежуточные вещества, включаются в состав активного комплекса, а после реакции вновь выделяются. Различают положительный катализ (ускорение реакции) и отрицательный катализ (замедление реакции, или ингибирование).
В некоторых случаях катализатором является один из продуктов реакции. Такая реакция называется автокаталитической. При гомогенном катализе катализатор и все реагирующие вещества составляют одну фазу. Различают следующие типы гомогенного катализа: кислотно-основной катализ органических реакций, катализ d-переходными ионами и катализ металлорганическими комплексами. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных фазах, а каталитическая реакция протекает на поверхности раздела фаз. Гетерогенный катализ включает пять обратимых стадий: диффузию реагентов, адсорбцию (сначала физическую, затем химическую), химическую реакцию, десорбцию продуктов и их диффузию.
Все гетерогенные катализаторы можно подразделить на четыре класса: d-переходные металлы, полупроводниковые оксиды, изоляторы (диэлектрики) и кислотные катализаторы.
Эти катализаторы характеризуются следующими свойствами:
-фермент способен катализировать только одну специфическую реакцию или реакцию одного типа;
-обладают высокой эффективностью даже в очень небольших количествах;
-наибольшей активностью обладают при температуре 310 К (температуре человеческого тела, при температуре выше 323-333 К разрушаются;
-ферменты очень чувствительны к присутствию каталитических ядов.
Каталитические реакции характеризуются следующими общими особенностями:
1) Катализатор не влияет на термодинамическое равновесие. Он изменяет лишь скорость достижения состояния равновесия.
2) Действие катализатора специфично. Из всех возможных реакций данных реагирующих веществ определенный катализатор избирательно усиливает лишь некоторые.
3) Скорость гомогенной каталитической реакции чаще всего пропорциональна концентрации катализатора.
4) Действие катализатора зависит от его физического состояния и от присутствия посторонних веществ. Промоторы усиливают действие катализатора, а каталитические яды снижают активность катализатора.
5) Смесь катализаторов часто действует значительно сильнее, чем отдельные катализаторы.
1.5 Сущность каталитического действия
Если энергия активации высока, то лишь небольшая доля сталкивающихся молекул имеет энергию, достаточную для того, чтобы произошла реакция, а если она низка, то реагирует большая часть молекул, и поэтому константа скорости будет большой. Из этого следует, что если каким-либо образом можно снизить энергию активации, то реакция должна протекать с более высокой скоростью.
К(катализатор)/К(без катализатора) = е 7,6 ≈ 2000 раз.
Более существенное изменение энергии активации происходит при добавлении ферментов к биохимическим системам.
Фермент является биологической молекулой, которая обладает большой эффективностью. Это иллюстрируется изменением энергии активации в реакции гидролиза сахарозы от 107 кДж/моль в присутствии иона гидрооксония до 36 кДж/моль при добавлении небольшого количества фермента сахаразы. Такое изменение энергии активации соответствует изменению значения скорости на 22 порядка.
1.6 Методы расчета энергии активации и предэкспоненциального множителя
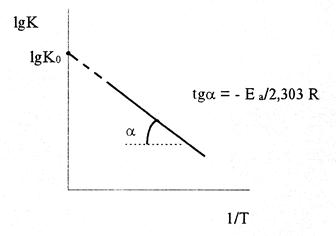
В большинстве случаев для расчета энергии активации Еа по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса (6) или его запись в виде:
Следовательно, lgK линейно зависит от обратной абсолютной температуры (см. рисунок)
Предэкспоненциальный множитель К0 определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить:
Энергия активации Еа имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0 совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа и К зависят от температуры. Однако эту зависимость можно не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа предполагает, что константы скорости реакций при различных температурах известны.
Однако, есть способ расчета Еа, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1 и T2 в смесях одного и того же начального состава протекает химическая реакция. Если к моментам времени τ1 и τ2 реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением (4)
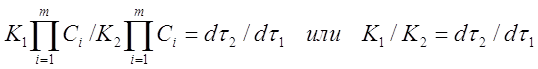
Таким образом, отношение K1 /K2 можно заменить отношением τ1 / τ2
Подставим в отношение (11а) значения констант скорости при температурах T1 и Т2, используя уравнение Аррениуса (5):
Полагая, что для узкого температурного интервала К0 и Еа= const находим
Разделение переменных и интегрирование дают:
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Реакция иодирования ацетона
В качестве объекта исследования в данной работе выбрана реакция иодирования ацетона. Реакция
СНзСОСНз + I2 = СНзСОСH2I + HI (15)
катализируется кислотами Бренстеда(донорами протонов). Эта реакция катализируется сильной минеральной кислотой.
Затем (вторая стадия ) енол реагирует с иодом:
равное количеству вновь образовавшихся оксоний-ионов.
Подставляя (19) в (18), находим:
После интегрирования этого уравнения в пределах от х=0 до х и от τ=0 до х, разрешения относительно K1 получим выражение:
Если перейти к концентрациям веществ, участвующих в реакции, то уравнение (20) приобретет вид:
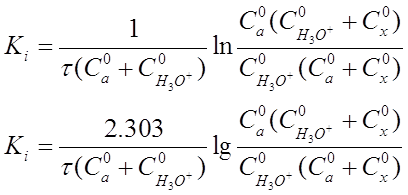
реакции т, моль-экв/л;
По уравнениям (20) и (21) можно рассчитать константу скорости реакции, используя данные о концентрации веществ, участвующих в реакции.