что такое катализатор в химии кратко
«Катализаторы» сообщение кратко
Роль катализаторов в современном производстве сообщение кратко расскажет много полезной информации о них и поможет подготовиться к занятию.
«Катализаторы» сообщение кратко
Что такое катализатор?
Катализаторы представляют собой вещества, способные ускорять химические реакции некоторых продуктов и не входят в их состав. Существуют также и биологические катализаторы – ферменты, ускоряющие химические реакции в живых организмах.
Например, пероксид водорода, попав на ранку или царапину, начинает сильно шипеть и пузыриться. Это и есть действие катализатора. В момент выделения, кислород оказывает дезинфицирующие свойства — из ранки вместе с пеной удаляются загрязнения. Шипение происходит потому, что в крови содержатся вещества, ускоряющие разложение пероксида водорода.
Кто ввел термин «катализатор»?
Шведский химик И. Берцелиус в 1835 году выявил, что в присутствии некоторых веществ скорость определенных химических реакций возрастает в разы. Он ввел термин «катализатор», от греческого «katalysis» — «разрушение», «ослабление».
Какая роль катализаторов?
В жизни человека катализаторы очень играют важную роль. Ферменты применяют с давних времен в сыроварении, хлебопечении, кожевничестве, пивоварении, виноделии.
Сегодня катализаторы активно применяются в промышленности – при получении белков, синтетических антибиотиков и переработке сахара. Так, в моющих средствах добавляются ферменты, ускоряющие расщепление белковых загрязнений; универсальные порошки для удаления пятен, пищевых продуктов, пота, крови содержат в себе ферментные «энзимы».
Без катализаторов невозможно превратить в маргарин растительное масло, изготовить кулинарный жир, другие пищевые продукты. С их помощью очищают газообразные отходы промышленных предприятий и удаляют разнообразные токсичные соединения, выхлопные газы.
В ХХ веке ученые научились при помощи каталитических методов получать органические материалы, нитрилы, эфиры, олефины, кислоты для производства пластмасс, пропан, стирол, бутан, бутен.
Промышленные кислотные катализаторы незаменимы при нефтепереработке, для получения ароматических углеводородов и парафинов. Новейшей технологией по их применению является технология получения высокооктановых видов бензина, а также этилированного топлива.
Надеемся, что сообщение о роли катализаторов помогло Вам подготовиться к занятию, и Вы узнали много полезной информации о них. А свое краткое сообщение о катализаторах Вы можете оставить через форму комментариев ниже.
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
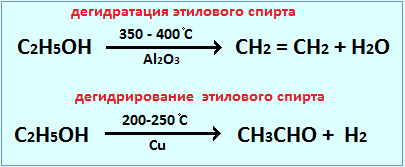
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Катализаторы
Катализа́тор — вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, при реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (сотни, миллионы раз) повторяется.
Содержание
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества (Химическая энциклопедия). Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO (Химическая энциклопедия).
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции (Имянитов, Temkin). Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
В современных автомашинах присутствует каталитический преобразователь или автомобильный катализатор. Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
Катализаторы
Примерно 90% объема современного химического производства основано на каталитических процессах.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Катализатор, их виды и свойства
Катализатор, их виды и свойства.
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализатор (понятие и сущность):
Катализатор – это химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции, и действующее повторно (неоднократно).
Катализаторы – это вещества, которые ускоряют химические реакции, но не входят в состав их конечных продуктов.
Катализаторы – это вещества, ускоряющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Термин катализатор (от греч. katalysis – «ослабление», «разрушение») впервые ввел в 1835 г. шведский химик И. Берцелиус, который установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает.
Соответственно химические реакции, протекающие в присутствии катализаторов, именуются каталитическими реакциями. А процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами, именуется катализом.
Различают положительный катализ и отрицательный катализ. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – при котором она убывает.
Вещества, замедляющие химическую реакцию, именуются ингибиторами. Однако ингибиторы в отличие от катализаторов могут расходоваться в процессе химической реакции.
Все химические реакции в прису тствии катализатора протекают быстрее, поскольку катализатор снижает энергию активации реакции.
В некоторых химических реакциях катализатор реагирует с одним или несколькими реагентами с образованием временного промежуточного продукта, который затем регенерирует исходный катализатор в циклическом процессе. Химическая реакция в таких случаях состоит из нескольких стадий:
X + K → XK,
Y + XK → XYK,
XYK → KZ,
KZ → K + Z,
Z – конечный продукт химической реакции X и Y,
При этом общее уравнение реакции записывается как:
В современном химическом производстве часто применяют каталитические системы из нескольких катализаторов, каждый из которых ускоряет разные стадии химической реакции.
Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В настоящее время многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов. Согласно оценкам, для производства 90 % всех коммерчески производимых химических продуктов на той или иной стадии процесса их изготовления использовались катализаторы.
Типы и виды катализаторов:
Катализаторы, как правило, подразделяются на гомогенные и гетерогенные.
Гомогенный катализатор – это катализатор, молекулы которого диспергированы (т.е. находятся) в одной и той же фазе (обычно в газообразной или жидкой), что и молекулы реагента.
Гетерогенный катализатор – это катализатор, молекулы которого находятся не в той же фазе, что и реагенты (которые обычно представляют собой газы или жидкости, адсорбированные на поверхности твердого катализатора). Гетерогенный катализатор образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества – реагенты.
Действие гомогенного катализатора, как правило, связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, что приводит к снижению энергии активации химической реакции. Впоследствии промежуточные вещества регенерируют исходный катализатор.
Гетерогенные катализаторы имеют, как правило, сильно развитую твердую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.). Их действие основано на ускорении химической реакции на своей твердой поверхности (либо на плоской открытой поверхности, либо на краях кристалла, либо вследствие сочетания этих двух факторов). Поэтому активность гетерогенного катализатора зависит от величины и свойств его поверхности.
Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Одни и те же химические реакции могут протекать как с гомогенными, так и с гетерогенными катализаторами. Для определенных химических реакций эффективны только определённые катализаторы.
В биохимических реакциях роль катализаторов выполняют ферменты, которые часто рассматриваются как третья – отдельная категория.
Соответственно классификации катализаторов положительный катализ подразделяют на три типа:
а) гомогенный катализ, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии;
в) ферментативный катализ, когда катализатором служат сложные белковые образования, ускоряющие течение биологически важных реакций в организмах растительного и животного мира. Ферментативный катализ может быть как гомогенным, так и гетерогенным, но из-за специфических особенностей действия ферментов целесообразно выделение этого вида катализа в самостоятельную область.
Свойства катализаторов:
Катализаторы как вещества, ускоряющие химические реакции, обладают следующими свойствами:
– каталитической активностью. Каталитическая активность – это свойство катализатора ускорять химическую реакцию. Формально каталитическую активность можно определить как скорость каталитической реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора или как соотношение скоростей каталитической и некаталитической реакций;
– селективностью. Селективность – это способность протекания химической реакции в определённом направлении, то есть свойство получать те продукты реакции, на которые направлена химическая реакция;
– неизменностью. Неизменность означает, что после участия в химической реакции они (катализаторы) остаются химически неизменными;
– активностью. Активность катализатора в процессе реакции может понижаться вследствие воздействия на катализатор вредных примесей. К последним относятся каталитические яды и ингибиторы. Каталитические яды – это вещества, вызывающие «отравление» катализатора, т. е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Поэтому важно в процессе реакции исключить воздействие на катализатор вредных факторов.
Другими немаловажными свойствами катализаторов являются твердость, механическая прочность, устойчивость к истиранию и дроблению, срок службы, устойчивость к отравлению каталитическими ядами, размер и форма, масса единицы объема, пористость, удельная поверхность, термостойкость и стабильность.
Каталитические системы на основе катализаторов:
Современные промышленные твердые катализаторы обычно представляют собой сложные смеси, называемые контактными массами. В состав контактных масс входят прежде всего вещества, являющиеся собственно катализаторами, а также носители и активаторы.
Активаторы (промоторы) – это вещества, добавляемые к катализатору в небольших количествах с целью улучшения его свойств, таких, как активность, селективность или стабильность, которые сами по себе могут быть неактивными для данной реакции, но значительно улучшают свойства катализатора. Поэтому деление на сложные и активированные катализаторы носит лишь ориентировочный характер.
Улучшение свойств катализатора при добавлении промотора (активатора) значительно превосходит тот эффект, который можно было бы получить в результате независимого действия самого промотора, т.к. сам промотор может и не обладать каталитической активностью.
В общем случае по своему целевому назначению промоторы могут быть разделены на две группы:
– способствующие протеканию целевой реакции, т. е. увеличивающие активность катализатора;
– подавляющие нежелательные процессы, т. е. увеличивающие селективность катализатора.
Среди промоторов первой группы различают структурообразующие и активирующие. Структурообразующие промоторы, как правило, представляют собой инертные вещества, присутствующие в катализаторе в виде мелких частиц, препятствующих спеканию частиц активной каталитической фазы, что предотвращает уменьшение активной поверхности во время работы катализатора. Активирующие промоторы могут создавать дополнительные активные центры, воздействовать на электронную структуру активной фазы и т.п.