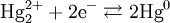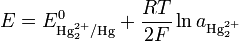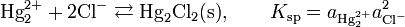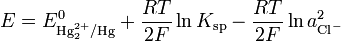что такое каломельный электрод
Каломельный
Потенциал каломельного электрода
Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде, имеет вид
Уравнение Нернста для него может быть записано следующим образом:
Здесь E 0 — стандартный электродный потенциал процесса, aHg — активность ионов Hg + в растворе. Поскольку каломель является малорастворимым соединением, активность ионов Hg + связана с активностью хлорид-ионов через величину произведения растворимости Ksp:
С учётом этого уравнение Нернста может быть записано следующим образом:
Потенциал каломельного электрода зависит, таким образом, только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °С.
Достоинством насыщенных каломельных электродов является хорошая воспроизводимость потенциала. Работоспособны при температурах до 80 °С; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.
См. также
Литература
Полезное
Смотреть что такое «Каломельный» в других словарях:
Каломельный — прил. 1. соотн. с сущ. каломель, связанный с ним 2. Свойственный каломели, характерный для неё. 3. Сделанный с использованием каломели. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
каломельный — каломельный, каломельная, каломельное, каломельные, каломельного, каломельной, каломельного, каломельных, каломельному, каломельной, каломельному, каломельным, каломельный, каломельную, каломельное, каломельные, каломельного, каломельную,… … Формы слов
каломельный — калом ельный … Русский орфографический словарь
Каломельный электрод — Каломельный электрод электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида… … Википедия
каломельный полуэлемент — каломельный электрод … Cловарь химических синонимов I
каломельный электрод — каломельный полуэлемент … Cловарь химических синонимов I
каломельный полуэлемент — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN calomel electrode … Справочник технического переводчика
каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN mercury mercurous chloride electrodecalomel half cellcalomel… … Справочник технического переводчика
каломельный электрод сравнения — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN calomel reference electrode … Справочник технического переводчика
каломельный электрод — kalomelio elektrodas statusas T sritis chemija apibrėžtis Antrosios rūšies elektrodas. formulė Hg|Hg₂Cl₂,KCl atitikmenys: angl. calomel electrode rus. каломельный электрод … Chemijos terminų aiškinamasis žodynas
Каломельный электрод
Потенциал каломельного электрода
Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде, имеет вид
Уравнение Нернста для него может быть записано следующим образом:
Здесь 

С учётом этого уравнение Нернста может быть записано следующим образом:
Потенциал каломельного электрода зависит, таким образом, только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °C.
Достоинством насыщенных каломельных электродов является хорошая воспроизводимость потенциала. Работоспособны при температурах до 80 °C; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.
См. также
Литература
Полезное
Смотреть что такое «Каломельный электрод» в других словарях:
каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN mercury mercurous chloride electrodecalomel half cellcalomel… … Справочник технического переводчика
каломельный электрод — kalomelio elektrodas statusas T sritis chemija apibrėžtis Antrosios rūšies elektrodas. formulė Hg|Hg₂Cl₂,KCl atitikmenys: angl. calomel electrode rus. каломельный электрод … Chemijos terminų aiškinamasis žodynas
каломельный электрод — каломельный полуэлемент … Cловарь химических синонимов I
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД — электрод сравнения, изготовленный с использованием ртути Hg, каломели Hg2Cl2 и вод. р ра хлорида калия КС1. Потенциал насыщенного (по КС1) К. э при 25 0С равен 0,2412 В … Естествознание. Энциклопедический словарь
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД — см. Электроды сравнения … Химическая энциклопедия
каломельный электрод сравнения — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN calomel reference electrode … Справочник технического переводчика
ртутное дно, хлорсеребряный электрод, насыщенный каломельный электрод — – различные виды электродов сравнения. В зависимости от типа электрода сравнения изменяется потенциал пика на вольтамперограмме. Словарь по аналитической химии [3] … Химические термины
насыщенный каломельный электрод — см. ртутное дно, хлорсеребряный электрод, насыщенный каломельный электрод … Химические термины
насыщенный каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999] Тематики электротехника, основные понятия EN saturated calomel electrode … Справочник технического переводчика
нормальный каломельный электрод — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999] Тематики электротехника, основные понятия EN normal calomel electrode … Справочник технического переводчика
Что такое каломельный электрод
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
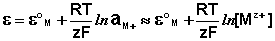
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
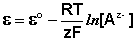
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
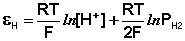
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
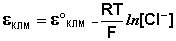
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
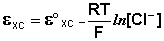
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
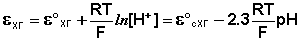
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
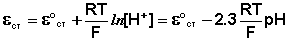
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
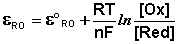
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
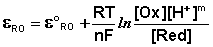
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
red-ox.ru
Электрохимические методы анализа. 1.3. Хлоридсеребряный и каломельный электроды сравнения
1.3. Хлоридсеребряный и каломельный электроды сравнения
Очевидно, что работа со стандартным водородным электродом предполагает строгое соблюдение ряда предосторожностей, и при проведении рутинных исследований он неудобен. Поэтому на практике часто используют другие, более простые в изготовлении и надежные в работе электроды сравнения, относительные потенциалы которых хорошо известны, обратимы и воспроизводимы в достаточно широком диапазоне внешних условий и во времени. Обратимость электрода означает, что направление электродной реакции можно изменить, изменив полярность электрода. Воспроизводимость выражается стандартным отклонением потенциала ячейки при последовательных измерениях.
Хлоридсеребряный электрод (рис. а) состоит из серебряной проволоки, покрытой слоем хлорида серебра электролитическим способом и погруженной в раствор хлорида калия известной концентрации. Потенциалопределяющей полуреакцией является:
а потенциал данного электрода определяется активностью хлорид-анионов:
Подобного рода электроды называют электродами второго рода. Если в качестве раствора используется насыщенный раствор хлорида калия, то электрод называют насыщенным хлоридсеребряным. Его потенциал при 25°С равен +0,222 В (±0,2 мВ) и существенно зависит от температуры (изменяется растворимость KCl).
а потенциал так же определяется активностью хлорид-анионов:
Потенциал насыщенного каломельного электрода при 25 ° С равен +0,242 В (±0,1 мВ). Нормальный каломельный электрод и децинормальный (имеются ввиду концентрации хлорида калия), имеющие потенциалы +0,280 В и +0,334 В, соответственно, менее восприимчивы к изменению температуры, но при длительном использовании изменяют свои показания вследствие испарения воды.
Промышленно изготовленные хлоридсеребряные и каломельные электроды выпускаются в виде компактных датчиков, непосредственно пригодных для погружения в анализируемый раствор, т.к. они уже содержат солевой мостик, а иногда и двойной солевой мостик (один из которых предотвращает загрязнение внутреннего раствора анализируемым веществом) (рис. б).
Определяемая потенциометром разность потенциалов между индикаторным электродом и одним из описанных электродом сравнения есть ни что иное, как ЭДС образованной электрохимической ячейки. Например, для насыщенного хлоридсеребряного электрода:
т.е. разность потенциалов между электродами остается функцией активности определяемого иона.
Авторская редакция главы из книги Н.Г. Ярышев, Д.А. Панкратов, М.И. Токарев, Н.Н. Камкин, С.Н. Родякина. Физические методы исследования и их практическое применение в химическом анализе: Учебное пособие. ISBN: 978-5-4263-0122-1. М.:Прометей, 2012, 160 стр.
Учебное пособие адресовано студентам, аспирантам и др. специалистам химических и биологических факультетов педагогических вузов. Содержание пособия соответствует Государственному образовательному стандарту высшего профессионального образования и учебно-методическим комплексам по дисциплинам: современные физико-химические методы исследования неорганических и органических веществ и химия окружающей среды. Пособие содержит введение, 6 глав и приложение, в котором приведены методики анализа, применяемые в настоящее время в аналитической химии, в том числе в лабораториях экологического мониторинга, испытательных лабораториях и в центрах государственного санитарно-эпидемиологического контроля.
Каломельный электрод



Электроды сравнения и измерения
Основным электродом сравнения, как мы говорили, является водородный электрод. Однако этот электрод очень чувствителен к изменению условий среды, что сильно усложняет работу с ним. Поэтому на практике для определения потенциала некоторого электрода, этот электрод соединяют в электро химический элемент не с водородным, а с другим электродом сравнения, потенциал которого точно известен по отношению к водородному электроду. В качестве таких электродов сравнения обычно используют каломельный или хлорсеребряный электрод.
Электрод второго рода, в котором паста из ртути и каломели (Hg2Cl2) помещена в раствор КСl. Схематически каломельный электрод можно записать так:
На электроде протекает реакция
Потенциал такого электрода определяется уравнением:
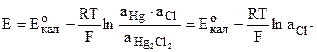
т.к. n=1; аHg=1; аHg2Cl2=1 или при 25 о С Е=0,2678-0,058.
Таким образом, каломельный электрод является электродом, обратимым по ионам хлора, в котором ионы хлора поступают от твердого хлорида ртути. Обычно применяют каломельные электроды с содержанием 0,1 н КСl или 1,0 н. Их потенциалы при 25 о С соответственно равны 0,3337; 0,2801 В.