что такое изотерма адсорбции
изотерма адсорбции
Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений. Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др.
Различают шесть основных типов изотерм адсорбции (см. рисунок). Тип I характерен для микропористых твердых тел с относительно малой долей внешней поверхности. Тип II указывает на полимолекулярную адсорбцию на непористых или макропористых адсорбентах. Тип III характерен для непористых сорбентов с малой энергией взаимодействия адсорбент-адсорбат. Типы IV и V аналогичны типам II и III, но для пористых адсорбентов. Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью.
Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам.
Типы изотерм адсорбции
Полезное
Смотреть что такое «изотерма адсорбции» в других словарях:
изотерма адсорбции — įgerties izoterma statusas T sritis Standartizacija ir metrologija apibrėžtis Įgerties priklausomybės nuo koncentracijos ar slėgio kreivė, esant pastoviai temperatūrai. atitikmenys: angl. adsorption isotherm vok. Adsorptionsisotherme, f rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
изотерма адсорбции — adsorbcijos izoterma statusas T sritis chemija apibrėžtis Kreivė, vaizduojanti adsorbcijos priklausomybę nuo koncentracijos ar slėgio, kai temperatūra pastovi. atitikmenys: angl. adsorption isotherm rus. изотерма адсорбции … Chemijos terminų aiškinamasis žodynas
изотерма адсорбции — Адсорбции изотерма – зависимость равновесной концентрации адсорбированного вещества на поверхности твердой фазы от его концентрации в жидкой (газовой) фазе. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Изотерма — [isothermic line] (от греческого isos равный и therme теплота) кривая или прямая, выражающая функциональную зависимость каких либо двух величин при постоянной температуре. Изотерма на диаграмме состояния изображает процесс, происходящий при… … Энциклопедический словарь по металлургии
ізотерма адсорбції — изотерма адсорбции adsorption isotherm *Adsorptionsisotherme – крива залежності кількості адсорбованого газу від рівноважного тиску (або від рівноважної концентрації адсорбату) при постійній температурі … Гірничий енциклопедичний словник
АДСОРБЦИЯ — (от лат. ad на, при и sorbeo поглощаю), изменение (обычно повышение) концентрации в ва вблизи пов сти раздела фаз ( поглощение на пов сти ). В общем случае причина А. нескомпенсированность межмол. сил вблизи этой пов сти, т. е. наличие адсорбц.… … Химическая энциклопедия
ХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ — изучает химические силы, действующие на поверхности. В общем случае химия поверхности рассматривает свойства трех состояний вещества твердого (Т), жидкого (Ж) и газообразного (Г) и дает описание вещества как фазовой системы. Однако если два… … Энциклопедия Кольера
БЭТ, метод — Термин БЭТ, метод Термин на английском BET Синонимы Аббревиатуры БЭТ Связанные термины адсорбция, изотерма адсорбции, метод BJH, нанопорошок Определение Метод математического описания физической адсорбции, основанный на теории полимолекулярной… … Энциклопедический словарь нанотехнологий
АДСОРБЦИЯ — (от лат. ad на, при и sorbeo поглощаю), процесс, приводящий к аномально высокой концентрации в ва (а д с о р б а т а) из газообразной или жидкой среды на поверхности её раздела с жидкостью или тв. телом (а д с о р б е н т о м). Частный случай… … Физическая энциклопедия
Изотермы адсорбции: понятие, виды, примеры
Содержание:
В изотермы адсорбции Они представляют собой графические изображения поведения адсорбированной частицы на поверхности твердого тела или жидкости при увеличении ее концентрации. Если адсорбированные частицы соответствуют частицам газа, то учитывается его давление.
Наблюдая эту изотерму, можно получить представление о том, как происходит процесс адсорбции; и, следовательно, о том, как взаимодействуют частицы с поверхностью, и о характеристиках поверхности. Анализируя изотерму, выясняется, является ли поверхность гладкой, пористой или микропористой, а также возможны конденсации.
Это простое представление соответствует адсорбции, описываемой изотермой типа I. С помощью изотерм изучается адсорбция бесконечного количества газов или жидкостей на гелях, твердых телах или катализаторах.
Типы изотерм адсорбции
Выше показаны пять основных экспериментальных изотерм, использованных С. Брунауэром для классификации адсорбции газообразных частиц на твердых телах. Каждый описывает свой процесс адсорбции. Аналогичным образом, у каждого из них есть математические модели, которые пытаются вывести поведение его кривых.
Независимо от единиц или переменных, используемых в осях X (p / po) и Y (X), ось X показывает, какое давление или концентрация адсорбата «действует» на твердое тело; тогда как ось Y показывает, сколько адсорбата было фактически адсорбировано на поверхности указанного твердого вещества или адсорбента.
Таким образом, перемещаясь вправо от оси X, мы видим, как количество адсорбированных частиц увеличивается в зависимости от увеличения их давления или концентрации. Это приводит к наблюдению максимума, распада, впадины и т. Д., Что так или иначе позволяет нам интерпретировать, как происходит адсорбция.
Изотерма I типа
Выше у нас есть изотерма типа I, которая также известна как изотерма Ленгмюра, поскольку ваша модель предсказывала форму этой кривой. При просмотре сразу же интерпретируется, что существует максимальное количество (Xmax) адсорбированных частиц, которое не будет изменяться независимо от того, насколько увеличиваются давления.
Это максимальное значение адсорбции может быть вызвано несколькими причинами. Один из них заключается в том, что происходит хемосорбция, что означает, что частицы или адсорбаты прочно прикреплены к поверхности твердого вещества или адсорбента. Как только на поверхности не останется места для размещения большего количества частиц, адсорбция прекратится.
Поэтому говорят, что образовался монослой (как тот, что отмечен фиолетовыми кружками на первом изображении).
Другая причина для обоснования изотермы типа I заключается в том, что происходит физическая адсорбция, что означает, что взаимодействия частицы с поверхностью очень слабые (они не подразумевают образование химических связей).
В этом случае частицы попадают в микропоры, которые после заполнения поверхности не имеют дополнительных участков для последующей адсорбции; то есть у него мало доступной внешней площади (как если бы это была очень тонкая решетка). Такое поведение наблюдается при анализе микропористых порошков.
Тип изотермыII
Выше представлена изотерма типа II, также известная как сигмовидная изотерма. Он описывает процессы физадсорбции как для непористых, так и для макропористых твердых тел.
Обратите внимание, что он изначально напоминает приведенную выше изотерму, что означает, что адсорбированные частицы образуют монослой на поверхности адсорбента. Как только монослой будет готов, другие частицы будут адсорбироваться поверх первых, образуя мультислои. Именно здесь мы видим характерное увеличение этой изотермы (справа).
Другая причина получения изотермы типа II заключается в том, что частицы имеют большее сродство к поверхности, чем к самим себе. Другими словами, монослой (частица-поверхность) будет более стабильным и долговечным, чем многослойный (частица-частица), сформированный позже.
Тип изотермыIII
Изотерма III типа аналогична типу II по интерпретации: многослойность и физисорбция. Однако на этот раз взаимодействия между мультислоями сильнее, чем взаимодействия монослоя с поверхностью твердого тела. Следовательно, это нерегулярная адсорбция с множеством адсорбированных частиц и частей со свободной поверхностью.
Тип изотермыIV
Изотерма IV типа также описывает физадсорбцию и многослойные процессы, напоминая изотерму типа II; но теперь в пористых (и мезопористых) твердых телах, где возможна конденсация газовых частиц в небольших объемах жидкости. Пока поры не «забиты» жидкостью, монослой не является полным.
Тип изотермыV
Изотерма типа V аналогична изотерме типа IV, только на этот раз многослойные образования более склонны, чем соответствующий монослой. То есть она напоминает адсорбцию, описываемую изотермой III типа. Здесь многослойный слой достигает максимальной толщины, и больше нет места для адсорбции большего количества частиц.
Примеры
Некоторые примеры систем газ-твердое тело будут упомянуты ниже вместе с типом изотерм, которые были получены в ходе их экспериментальных исследований:
-Аммиак-углерод (тип I)
-Азотные цеолиты (тип I)
-Водород-углерод при высоких температурах (тип I)
-Кислородно-углеродная сажа (тип I)
-Азот-силикагель (тип II)
-Азотно-железо (тип II)
-Бромсиликагель (тип III)
-Пары йода-силикагель (тип III)
-Зот-полиэтилен (тип III)
-Криптон-технический углерод (тип IV)
-Бензол-оксид железа гель (тип IV)
-Водоуглеродный пар (тип V)
Обратите внимание, что упомянутые твердые вещества представляли собой углерод, технический углерод, металлическое железо, оксид железа, цеолиты и силикагель. Все они являются хорошими примерами адсорбентов для различных промышленных применений.
Ссылки
16 типов рек (и их характеристики)
+500 слов с буквой Y на испанском языке (в начале)
Что такое изотерма адсорбции
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.3 Адсорбция на границе твердое тело – газ
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
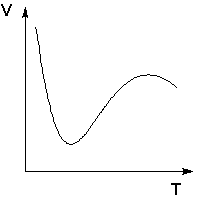
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 4.4).
Рис. 4.4 Зависимость объема адсорбированного никелем водорода от температуры
При постоянной температуре количество адсорбированного вещества зависит только от равновесных давления либо концентрации адсорбата; уравнение, связывающее эти величины, называется изотермой адсорбции.
4.1.4 Теории адсорбции
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому некоторые наиболее распространенные теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело – газ или твердое тело – раствор.
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата ; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
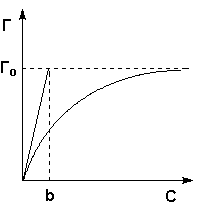
Рис. 4.5 Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х):
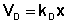
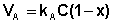
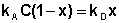
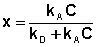
Разделив числитель и знаменатель правой части уравнения (IV.10) на kA, получим:

Максимально возможная величина адсорбции Г о достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Г о. Подставив это в уравнение (IV.11), получаем:
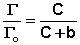
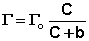
При описании процесса адсорбции газов в уравнении (IV.13) концентрация может быть заменена пропорциональной величиной парциального давления газа:
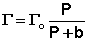
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
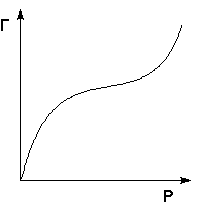
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции (рис. 4.6), форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
Рис. 4.6 Изотерма полимолекулярной адсорбции
4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не меняется.
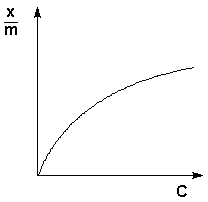
Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
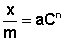
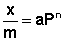
( а)
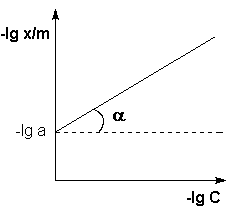
(б)
Рис. 4.7 Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б)
координатах
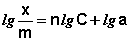
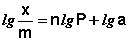
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lg a, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
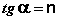
Что такое изотерма адсорбции
Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений. Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др.
Различают шесть основных типов изотерм адсорбции (см. рис.). Тип I характерен для микропористых твердых тел с относительно малой долей внешней поверхности. Тип II указывает на полимолекулярную адсорбцию на непористых или макропористых адсорбентах. Тип III характерен для непористых сорбентов с малой энергией взаимодействия адсорбент-адсорбат. Типы IV и V аналогичны типам II и III, но для пористых адсорбентов. Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью.
Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам.
Строгая теория изотермы адсорбции была предложена И. Ленгмюром для модели монослойной адсорбции на однородной поверхности, в которой можно пренебречь силами притяжения между молекулами адсорбата и их подвижностью вдоль поверхности. Уравнение изотермы Ленгмюра имеет вид: a = ambp/(1 + bp), где b — адсорбционный коэффициент, зависящий от энергии адсорбции и температуры; am — емкость монослоя.
Дальнейшее развитие теории состояло в исключении того или иного допущения, использованного Ленгмюром. Так, С. Брунауэром, П. Эмметом и Э. Теллером была предложена теория полимолекулярной адсорбции ( метод БЭТ ); Т. Хилл и Я. де Бур разработали теорию, учитывающую взаимодействие между адсорбированными молекулами (изотерма Хилла–де-Бура), и т. д.
Уравнение адсорбции Ленгмюра следующее:
СОДЕРЖАНИЕ
Предпосылки и эксперименты
Ленгмюр опубликовал две статьи, которые подтвердили предположение, что адсорбированные пленки не превышают толщину одной молекулы. Первый эксперимент заключался в наблюдении эмиссии электронов из нагретых нитей в газах. Второе, более прямое свидетельство, исследовало и измеряло пленки жидкости на поверхностном слое адсорбента. Он также отметил, что обычно сила притяжения между поверхностью и первым слоем адсорбированного вещества намного больше, чем сила между первым и вторым слоями. Однако бывают случаи, когда последующие слои могут конденсироваться при правильном сочетании температуры и давления.
Основные гипотезы модели
Следующие гипотезы, присущие этой модели, справедливы специально для простейшего случая: адсорбция одного адсорбата на серии эквивалентных участков на поверхности твердого тела.
Вывод изотермы адсорбции Ленгмюра.
Математическое выражение изотермы адсорбции Ленгмюра с участием только одного сорбирующего вещества может быть продемонстрировано разными способами: кинетическим подходом, термодинамическим подходом и подходом статистической механики соответственно. В случае двух конкурирующих адсорбированных частиц требуется модель конкурентной адсорбции, в то время как, когда сорбированные частицы диссоциируют на два отдельных объекта, необходимо использовать модель диссоциативной адсорбции.
Кинетическое происхождение
В этом разделе представлены кинетические выводы для случая одного адсорбата. Случай с несколькими адсорбатами рассматривается в подразделе « Конкурентная адсорбция ». Модель предполагает адсорбцию и десорбцию как элементарные процессы, где скорость адсорбции r ad и скорость десорбции r d определяются выражениями
В состоянии равновесия скорость адсорбции равна скорости десорбции. Полагая r ad = r d и переставляя, получаем
Концентрация сайтов определяется делением общего количества сайтов (S 0 ), покрывающих всю поверхность, на площадь адсорбента (а):
Затем мы можем рассчитать концентрацию всех сайтов, суммируя концентрацию свободных сайтов [ S ] и занятых сайтов:
Комбинируя это с уравнением равновесия, получаем
Это, примененное к предыдущему уравнению, которое объединило баланс центров и равновесие, дает изотерму адсорбции Ленгмюра:
Термодинамическое происхождение
Растворитель (связанный) + Растворитель (свободный) ↔ Растворитель (свободный) + Растворитель (связанный)
Обратите внимание, что вместо коэффициента активности можно использовать концентрацию адсорбата растворенного вещества. Однако константа равновесия больше не будет безразмерной и вместо этого будет иметь единицы измерения 1 / единицы концентрации. Разница между кинетическим и термодинамическим производными модели Ленгмюра состоит в том, что термодинамика использует активности в качестве отправной точки, в то время как кинетическое построение использует скорости реакции. Термодинамический вывод позволяет включить коэффициенты активности адсорбатов в их связанном и свободном состояниях. Термодинамический вывод обычно называют «уравнением типа Ленгмюра».
Статистический механический вывод
Этот вывод, основанный на статистической механике, был первоначально предоставлен Фольмером и Манертом в 1925 году. Статистическая сумма конечного числа адсорбентов, адсорбированных на поверхности, в каноническом ансамбле дается выражением
на основании которого рассчитывается среднее количество занятых сайтов
Теперь, применяя условие, что система находится в равновесии, то есть химический потенциал адсорбированных молекул равен химическому потенциалу молекул в газовой фазе, мы имеем
Химический потенциал идеального газа равен
Конкурентная адсорбция
Полученные с использованием кинетических соображений константы равновесия как для A, так и для B задаются выражением
[ А объявление ] п А [ S ] знак равно K экв А <\ displaystyle <\ frac <[A _ <\ text
В балансе сайтов указано, что общая концентрация сайтов [ S 0 ] равна сумме свободных сайтов, сайтов, занятых A, и сайтов, занятых B :
Подставляя уравнения равновесия и перестраивая так же, как мы делали для адсорбции одного вида, мы получаем аналогичные выражения для θ A и θ B :
Диссоциативная адсорбция
Используя аналогичные кинетические соображения, получаем
Показатель 1/2 при p D 2 возникает из-за того, что одна молекула в газовой фазе производит два адсорбированных вещества. Применяя баланс сайта, как описано выше,
Энтропийные соображения
Чтобы найти уменьшение энтропии, мы находим энтропию молекулы в адсорбированном состоянии.
С другой стороны, энтропия молекулы идеального газа равна
Ограничения модели
Модель адсорбции Ленгмюра во многих случаях значительно отличается, прежде всего потому, что она не учитывает шероховатость поверхности адсорбента. Шероховатые неоднородные поверхности имеют несколько типов участков, доступных для адсорбции, при этом некоторые параметры варьируются от участка к участку, например, теплота адсорбции. Более того, удельная поверхность является величиной, зависящей от масштаба, и для этого параметра не существует единого истинного значения. Таким образом, использование альтернативных зондирующих молекул часто может приводить к различным полученным численным значениям площади поверхности, что делает сравнение проблематичным.
Модель также игнорирует взаимодействия адсорбат / адсорбат. Экспериментально есть четкие доказательства взаимодействия адсорбата / адсорбата по теплоте адсорбции. Существует два типа взаимодействий адсорбат / адсорбат: прямое взаимодействие и косвенное взаимодействие. Прямые взаимодействия происходят между соседними адсорбированными молекулами, что может сделать адсорбцию рядом с другой молекулой адсорбата более или менее благоприятной и сильно влияет на поведение с высокой степенью покрытия. При непрямых взаимодействиях адсорбат изменяет поверхность вокруг адсорбируемого сайта, что, в свою очередь, влияет на адсорбцию других молекул адсорбата поблизости.
Модификации
Модификации пытаются учесть моменты, упомянутые в предыдущем разделе, такие как шероховатость поверхности, неоднородность и взаимодействия адсорбат-адсорбат.
Уравнение типа Ленгмюра с двумя механизмами (TMLLE)
Также известно как двухсайтовое уравнение Ленгмюра. Это уравнение описывает адсорбцию разновидностей адсорбата на двух или более различных типах сайтов адсорбции. Каждый сайт связывания можно описать с помощью его собственной ленгмюровской экспрессии, пока адсорбция на каждом типе сайта связывания не зависит от остальных.
Это уравнение хорошо работает для адсорбции некоторых молекул лекарственного средства на активированный уголь, в котором одни молекулы адсорбата взаимодействуют с водородными связями, в то время как другие взаимодействуют с другой частью поверхности посредством гидрофобных взаимодействий ( гидрофобный эффект ). Уравнение было изменено с учетом гидрофобного эффекта (также известного как энтропийная адсорбция):
Изотерма адсорбции Фрейндлиха
Изотерма Фрейндлиха является наиболее важной изотермой адсорбции с несколькими участками для шероховатых поверхностей.
Тот модифицировал это уравнение, добавив два параметра, α T 0 и C T 0, чтобы сформулировать уравнение Тотта :
θ C Т 0 знак равно α Т 0 п А C Т 0 1 K е q А + п А C Т 0 <\ displaystyle \ theta ^
Изотерма адсорбции Темкина
Эта изотерма учитывает непрямые взаимодействия адсорбат-адсорбат на изотермах адсорбции. Темкин экспериментально отметил, что теплота адсорбции чаще будет уменьшаться, чем увеличиваться с увеличением покрытия.
Теплота адсорбции ΔH ad определяется как:
Он построил модель, предполагая, что по мере того, как поверхность загружается адсорбатом, теплота адсорбции всех молекул в слое будет линейно уменьшаться с увеличением покрытия из-за взаимодействий адсорбат-адсорбат:
Изотерму Ленгмюра можно переписать к такому виду:
Подставив выражение константы равновесия и взяв натуральный логарифм:
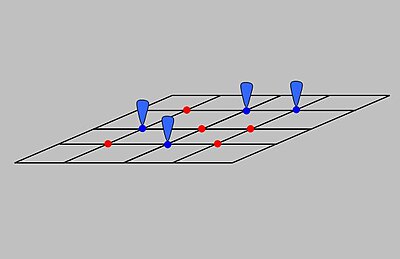
Уравнение BET
Брунауэр, Эммет и Теллер (БЭТ) получили первую изотерму для многослойной адсорбции. Он предполагает случайное распределение сайтов, которые пусты или покрыты одним монослоем, двумя слоями и так далее, как показано рядом. Основное уравнение этой модели:
Адсорбция бинарной жидкости на твердом теле.
В этом разделе описывается покрытие поверхности, когда адсорбат находится в жидкой фазе и представляет собой бинарную смесь.
где действует нормальное определение многокомпонентной системы:
Путем простой перестановки получаем
Это уравнение описывает конкуренцию компонентов «1» и «2».