что такое изобара изотерма изохора изобара
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
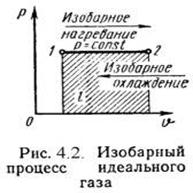
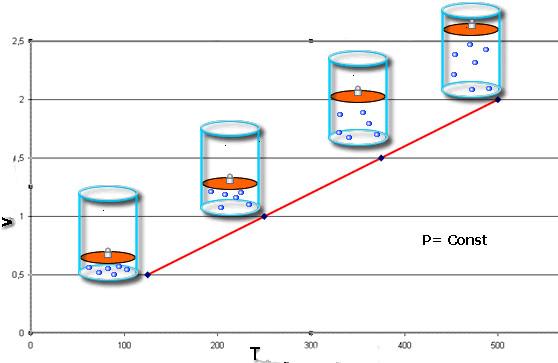
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
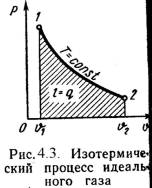
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Изохорный, изобарный, изотермический, адиабатный процессы, их особенности



Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p
|
Уравнение состояния процесса:
Так как V 2 = V 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
Количество теплоты, подведенное в изохорном процессе, равно изменению внутренней энергии. Для произвольной массы вещества:
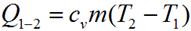
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 1.2).
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
|
Уравнение состояния процесса:
Работа этого процесса:
Уравнение 1-го закона т/д имеет вид:
Выражение для определения количества теплоты для 1 кг газа примет вид:
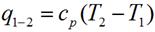
для произвольной массы газа:
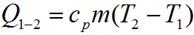
Таким образом, в изобарном процессе теплота расходуется на совершение работы и на изменение внутренней энергии рабочего тела.
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 2.3), которые называются изобарами.
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид:
где R = Rh/ i – газовая постоянная [Дж/(кг·К)].
Теплота, участвующая в изотермическом процессе, определится соотношением:
Это означает что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
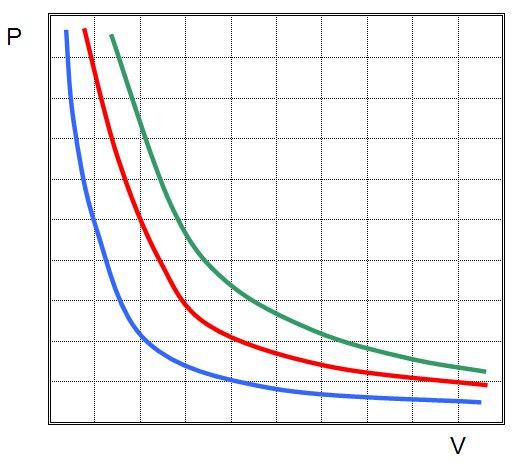
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p
1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.2). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
4) Адиабатный процесс (рис.4).
В данном процессе не подводится и не отводится тепло, т.е. процесс происходит без теплообмена с окружающей средой q =0.
где k = cp / cv – показатель адиабаты.
Cвязь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
Что такое изобара изотерма изохора изобара
| Законы идеальных газов |   |
| В XVII – XIX веках были сформулированы опытные законы идеальных газов. Кратко напомним их. Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным. 1. Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const. График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ— и VT-диаграммах (рис. 1.6). Уравнение изохоры: Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const. График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV— и РT-диаграммах (рис. 1.8). Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT— и РT-диаграммах (рис. 1.10). Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·10 23 молекул (число Авогадро). 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов: При В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа График изотермического процесса. Основные термодинамические процессыГлавным предметом изучения термодинамики газовых систем является изменение термодинамических состояний. В результате таких изменений газ может совершать работу и запасать внутреннюю энергию. Изучим в приведенной ниже статье разные термодинамические переходы в идеальном газе. Особое внимание будет уделено изучению графика изотермического процесса. Идеальные газы Уже судя по самому названию, можно сказать, что 100-процентных идеальных газов в природе не существует. Однако многие реальные вещества удовлетворяют этой концепции с приемлемой для практики точностью.
Идеальным называется любой газ, в котором можно пренебречь взаимодействиями между его частицами и их размерами. Оба условия удовлетворяются только в том случае, если кинетическая энергия молекул будет намного превышать потенциальную энергию связей между ними, а расстояния между молекулами будут намного больше размеров частиц. Чтобы определить, является ли изучаемый газ идеальным, можно воспользоваться простым эмпирическим правилом: если температура в системе выше комнатной, давление не сильно отличается от атмосферного или меньше него, а составляющие систему молекулы являются химически инертными, то газ будет идеальным. Главный закон
Речь идет об уравнении идеального газа, которое также называется законом Клапейрона-Менделеева. Записано это уравнение было в 30-е годы XIX века французским инженером и физиком Эмилем Клапейроном. Спустя несколько десятилетий оно было приведено русским химиком Менделеевым к современному виду. Это уравнение имеет следующий вид: Закон Клапейрона-Менделеева впервые был получен из результатов предыдущих газовых законов, то есть в его основе лежала исключительно экспериментальная база. С развитием современной физики и кинетической теории текучих сред уравнение идеального газа может быть выведено из рассмотрения микроскопического поведения частиц системы. Изотермический процессКасательно газа идеального отметим, что изотермический переход для него называется законом Бойля-Мариотта. Обнаружен этот закон был экспериментальным путем. Причем он стал первым в этой области (вторая половина XVII века). Его может получить каждый школьник, если рассмотрит поведение газа в закрытой системе (n = const) при постоянной температуре (T = const). Пользуясь уравнением состояния, получаем: Последнее равенство представляет собой закон Бойля-Мариотта. В учебниках по физике можно также встретить такую форму его записи: При переходе из изотермического состояния 1 в термодинамическое 2 произведение объема на давление остается постоянным для закрытой газовой системы. Изучаемый закон говорит об обратной пропорциональности между величинами P и V: Это означает, что графиком изотермического процесса в идеальном газе будет кривая гипербола. Три гиперболы изображены на рисунке ниже. Изменение внутренней энергии при изотермическом процессе В физике идеальных газов под внутренней энергией понимают энергию кинетическую, связанную с вращательным и поступательным движением молекул. Из кинетической теории несложно получить следующую формулу для внутренней энергии U: В случае процесса изотермического температура остается постоянной, значит, единственной причиной изменения внутренней энергии является выход или приход в систему частиц вещества. Таким образом, в закрытых системах во время изотермического изменения их состояния внутренняя энергия сохраняется. Изобарный и изохорный процессыПомимо закона Бойля-Мариотта, существуют еще два основных газовых закона, которые также были открыты экспериментальным путем. Они носят фамилии французов Шарля и Гей-Люссака. Математически их записывают так: V / T = const при P = const; P / T = const при V = const. Закон Шарля говорит о том, что во время изобарного процесса (P = const) объем линейно зависит от абсолютной температуры. Закон Гей-Люссака свидетельствует о линейной зависимости между давлением и абсолютной температурой при изохорном переходе (V = const). Из приведенных равенств следует, что от процесса изотермического графики изобарного и изохорного переходов отличаются существенным образом. Если изотерма имеет форму гиперболы, то изобара и изохора являются прямыми линиями. Изобарно-изотермический процессРассматривая газовые законы, иногда забывают, что, помимо величин T, P и V, также может изменяться и величина n в законе Клапейрона-Менделеева. Если зафиксировать давление и температуру, то мы получим уравнение изобарно-изотермического перехода: n / V = const при T = const, P = const. Линейная зависимость между количеством вещества и объемом говорит о том, что при одинаковых условиях разные газы, содержащие одно и то же количество вещества, занимают равные объемы. Например, при нормальных условиях (0 oC, 1 атмосфера) молярный объем любого газа составляет 22,4 литра. Рассмотренный закон называется принципом Авогадро. Он лежит в основе закона Дальтона об идеальных газовых смесях. «Изопроцессы»Разделы: Физика Цели, ориентированные на развитие личности учащегося: Единый план изучения газовых законов: Основные понятия урока: изопроцессы, изотермический, изобарный, изохорный, изотерма, изобара, изохора. I. Организационный момент Сообщение целей и задач урока. II. Актуализация знаний Проверка домашнего задания III. Объяснение нового материала Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами. Первый газовый закон был открыт английским ученым Р. Бойлем. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал давление газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Теперь давайте сформулируем изотермический закон: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. А сам процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим процессом.
Зависимость давления газа от объема при постоянной температуре графически изображается кривой, которая называется изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой. Разным постоянным температурам соответствуют различные изотермы. При повышении температуры давление согласно уравнению состояния Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Провожу закрепление нового материала: Мини-тест, решение задач Следующий закон называется законом Гей-Люссака и происходит при постоянном объеме.
Теперь давайте, ребята, вместе сформулируем закон Гей-Люссака: Для газа данной массы отношение объема к температуре постоянно, если давление газа не изменяется. Сам же процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным. Объем данной массы газа при р = const зависит от температуры по линейному закону
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению (Рисунок 4) В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объем реального газа действительно обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня. При V = const давление данной массы газа при постоянном объеме зависит от температуры по линейному закону: В результате эксперимента получаем таблицу и график зависимости (Р, T) откуда видно, что
Теперь давайте, ребята, вместе сформулируем закон Шарля: Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Сам же процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным.
Эта зависимость давления от температуры изображается прямой, называемой изохорой. Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление согласно закону Бойля – Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1. В соответствии с законом Шарля все изохоры начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равна нулю. Увеличение давление газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема. IV. Структурированный комплексный тест по всем газовым законам Тест составлен в EXSEL (приложение 2). Программа сразу же автоматически выставляет полученную оценку и указывает на ошибки. Причем она позволяет при соответствующем навыке работы с ней исправлять эти ошибки. Это вырабатывает у учащихся уверенность в своих в себе, веру в свои знания, повышает познавательный интерес. V. Домашнее задание На рисунке (смотри слайд №26) дан график изменения состояния идеального газа в координатных осях V, T. Представьте этот процесс в координатных осях P, T и P, V. |



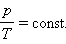

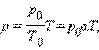
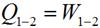

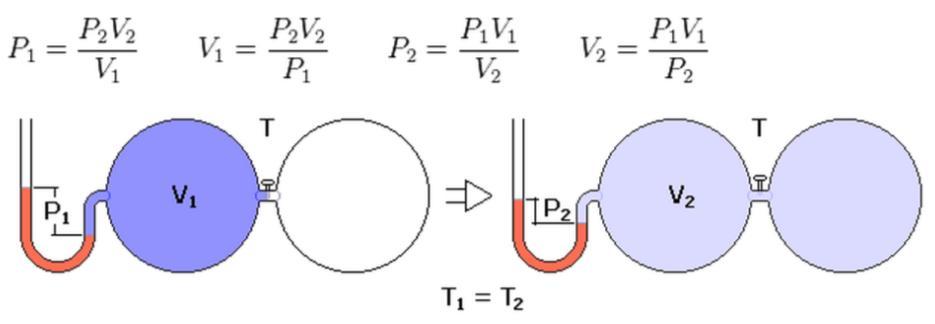
 , давление смеси газов:
, давление смеси газов:
 Вам будет интересно: Осадить — это. Толкование слова
Вам будет интересно: Осадить — это. Толкование слова Вам будет интересно: Формулы вычисления ускорения через скорость. Пример задачи
Вам будет интересно: Формулы вычисления ускорения через скорость. Пример задачи


 увеличивается, если V = const. Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1 (Рисунок 2).
увеличивается, если V = const. Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1 (Рисунок 2).



 (Рисунок 5)
(Рисунок 5)
