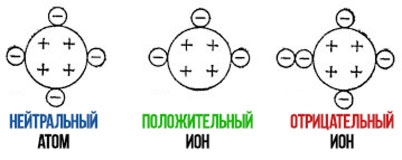
что такое ионы в химии определение
Что такое ионы в химии определение
(от греч. ión — идущий)
электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И. Понятие и термин «И.» ввёл в 1834 М. Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением И. Положительно заряженные И., движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду), — анионами.
В газах И. образуются большей частью под действием ударов частиц большой энергии или при фотоионизации под действием ультрафиолетовых, рентгеновских и гамма-лучей (см. Ионизирующие излучения). Образовавшиеся таким путём И. в обычных условиях недолговечны вследствие способности соединяться, взаимно нейтрализуясь. При высокой температуре ионизация атомов и ионов (термическая ионизация, т. е. термическая диссоциация с отделением электрона) может происходить также как равновесный процесс, в котором степень ионизации возрастает с повышением температуры и с понижением давления. Газ переходит при этом в состояние плазмы (См. Плазма).
И. в газах играют большую роль во многих явлениях. В природных условиях И. образуются в воздухе под действием космических лучей, солнечного излучения или электрического разряда (молнии). Присутствие И., их вид и концентрация влияют на многие физические свойства Воздуха, на его физиологическую активность (см. Ионы в атмосфере). На использовании И. основаны многие методы экспериментального исследования (Масс-спектроскопия, применение Вильсона камеры (См. Вильсона камера) и др.). И. в газах обладают высокой химической активностью, легко вступая во взаимодействие с другими частицами и вызывая те или иные химические реакции. Низкотемпературная плазма, состоящая из ионизированных частиц, используется в работе магнитогидродинамических генераторов. Высокотемпературная плазма — при разработке методов осуществления управляемой термоядерной реакции.
И. в организме — непременные участники обмена веществ. Они, в частности, участвуют в механизмах, обусловливающих проницаемость биологических мембран (См. Биологические мембраны), в регуляции мышечного сокращения, в проведении импульса возбуждения по нервному волокну и т. д. Постоянно протекающая диссоциация молекул на И. и противоположный процесс — ассоциация И. в молекулы — так сбалансированы в организме, что содержание И. в клетках и тканевых жидкостях в норме поддерживается на определённом уровне (см. Гомеостаз). Однако при некоторых воздействиях этот уровень может сдвигаться.
Что такое ионы в химии определение
В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях вещества: в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвёздном пространстве).
Связанные понятия
Упоминания в литературе
Связанные понятия (продолжение)
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических.
Кристалл — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит.
Эта страница частично содержит перевод со страницы на английском языке en:Cluster chemistry.
Что такое ионы в химии определение
Полезное
Смотреть что такое «ионы» в других словарях:
ИОНЫ — (от греч. ion идущий,странствующий), атомы или хим. радикалы, несущие электрические заряды. И с т о р и я. Как установил впервые Фарадей (Faraday), проведение электрического тока в растворах связано с передвижением материальных частиц, несущих… … Большая медицинская энциклопедия
ИОНЫ — ИОНЫ, электрически заряженные частицы, образующиеся из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные ионы анионами … Современная энциклопедия
ионы — – электрически заряженные атомы или молекулы. Общая химия : учебник / А. В. Жолнин [1] Ионы – электрически заряженные частицы, возникающие при потере или присоединении электронов атомами, молекулами и радикалами. Словарь по аналитической химии… … Химические термины
ИОНЫ — Продукты разложения какого либо тела при посредстве электролиза. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
Ионы — Ион (греч. ιόν «идущий») электрически заряженная частица (атом, молекула), образующаяся, обычно[1], в результате потери или присоединения одного или нескольких электронов атомами или молекулами. Заряд иона кратен заряду электрона. Понятие и… … Википедия
Ионы — [ions] (от греческого ion идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов (молекулы, радикалы и др.). Понятие и термин ионы ввел в 1834 г.… … Энциклопедический словарь по металлургии
Ионы — (от греч. ión идущий) электрически заряженные частицы, образующиеся при потере или присоединении электронов (или других заряженных частиц) атомами или группами атомов. Такими группами атомов могут быть молекулы, радикалы или другие И.… … Большая советская энциклопедия
Ионы — (физ.) По терминологии, введенной в учение об электричестве знаменитым Фарадеем, тело, подвергающееся разложению действием на него гальванического тока, называется электролитом, разложение таким путем электролизом, а продукты разложения ионами.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Что такое ионы в химии определение
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
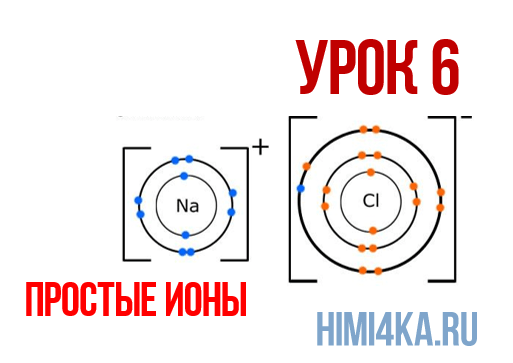
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
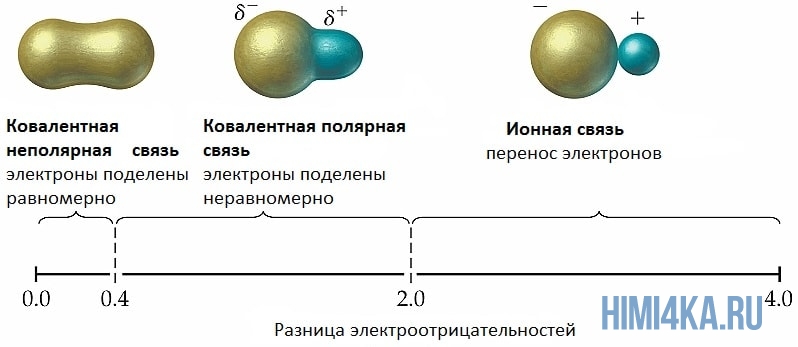
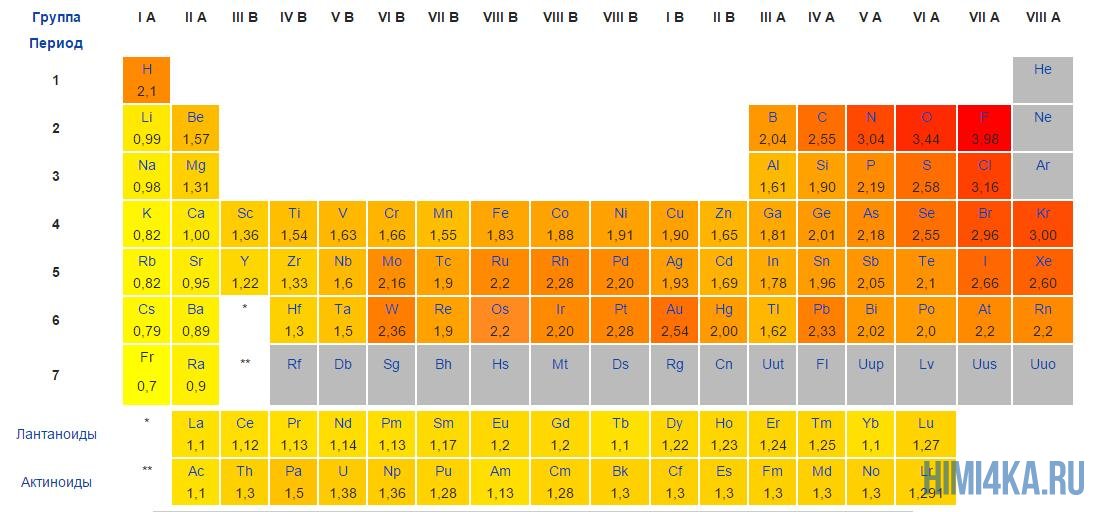
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
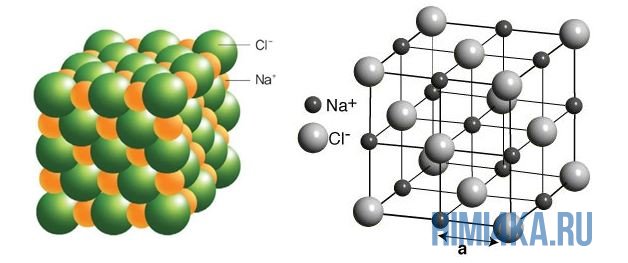
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.