что такое ионы металлов
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
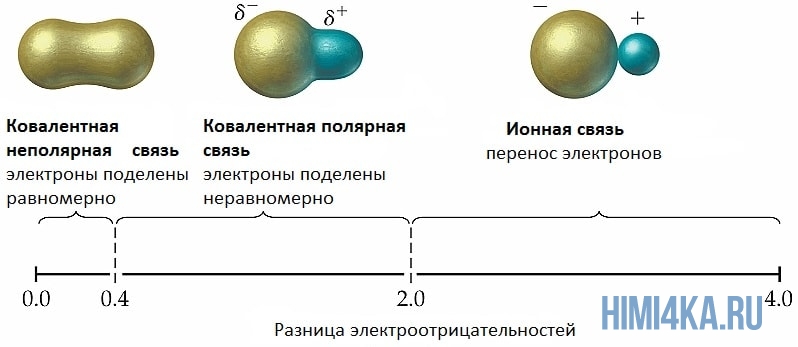
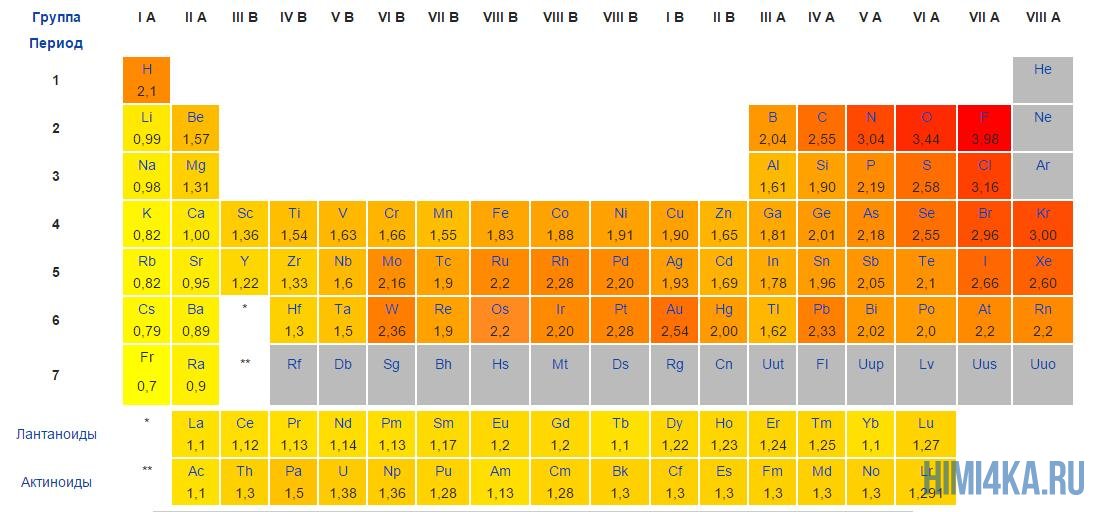
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
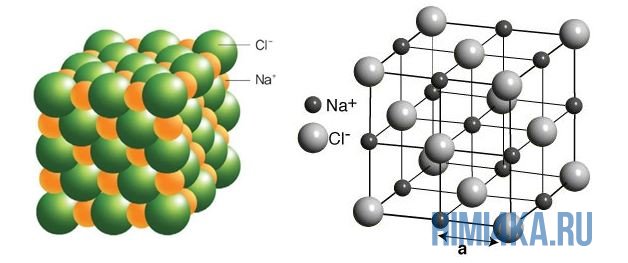
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
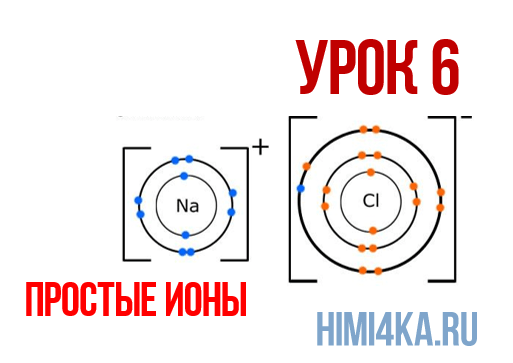
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Что такое ионы металлов
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
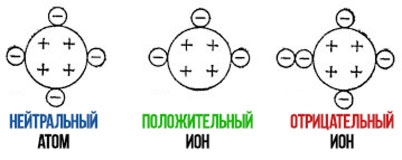
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
СОДЕРЖАНИЕ
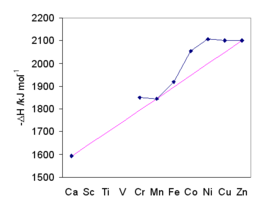
Введение в акваионы металлов
| ЧАС | Он | ||||||||||||||||||||||||||||||
| Ли | Быть | B | C | N | О | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | п | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge * | В виде | Se | Br | Kr | ||||||||||||||
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | Компакт диск | В | Sn | Sb * | Te | я | Xe | ||||||||||||||
| CS | Ба | Ла | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По * | В | Rn |
| Пт * | Ра * | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es * | Fm * | Мкр * | Нет* | Lr * |
* Нет экспериментальной информации о структурах акваионов.
Молекулы воды в первой и второй сольватных оболочках могут меняться местами. Скорость обмена сильно различается в зависимости от металла и степени его окисления. Акваионы металлов всегда сопровождаются в растворе сольватированными анионами, но о сольватации анионов известно гораздо меньше, чем о сольватации катионов.
Встречаемость в природе
Экспериментальные методы
Информация, полученная о природе ионов в растворе, зависит от типа используемого экспериментального метода. Некоторые методы выявляют свойства катиона напрямую, другие выявляют свойства, которые зависят как от катиона, так и от аниона. Некоторые методы предоставляют информацию статического характера, своего рода снимок средних свойств, другие предоставляют информацию о динамике решения.
Ядерный магнитный резонанс (ЯМР)
Ионы, для которых скорость водообмена низкая по шкале времени ЯМР, дают отдельные пики для молекул в первой сольватной оболочке и для других молекул воды. Число сольватации получается как отношение площадей пиков. Здесь это относится к количеству молекул воды в первой сольватной оболочке. Молекулы во второй сольватной оболочке быстро обмениваются с молекулами растворителя, вызывая небольшое изменение значения химического сдвига некоординированных молекул воды по сравнению с самой водой. Основным недостатком этого метода является то, что он требует достаточно концентрированных растворов, что связано с риском образования ионной пары с анионом.
| Ион | Быть 2+ | Мг 2+ | Al 3+ | Ga 3+ | Через 3+ | Fe 2+ | Co 2+ | Ni 2+ | Zn 2+ | Чт 4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| Номер | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Ядро | 1 Н 17 О | 1 ч | 1 ч | 1 Н 17 О | 1 ч | 17 O | 1 ч | 1 Н 17 О | 1 ч | 1 ч |
Рентгеновская дифракция (XRD)
Раствор, содержащий акваион, не имеет дальнего порядка, который присутствовал бы в кристалле, содержащем тот же ион, но есть ближний порядок. Дифракция рентгеновских лучей на растворах дает функцию радиального распределения, из которой можно определить координационное число иона металла и расстояние металл-кислород. С помощью акваионов с большим зарядом можно получить некоторую информацию о второй сольватной оболочке.
Этот метод требует использования относительно концентрированных растворов. Рентгеновские лучи рассеиваются электронами, поэтому рассеивающая способность увеличивается с атомным номером. Это делает атомы водорода почти невидимыми для рассеяния рентгеновских лучей.
Нейтронная дифракция
| Поваренная соль | LiCl | CaCl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Моляльность соли | 27,77 | 9,95 | 3,57 | 4,49 | 2,80 | 1.0 | 3,05 | 0,85 | 0,46 | 0,086 |
| Число гидратации катионов † | 2,3 (2) | 3,0 (5) | 5,5 (3) | 6,4 (3) | 7,2 (2) | 10,0 (6) | 5,8 (2) | 6,6 (5) | 6,8 (8) | 6,8 (8) |
| θ / град ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| Поваренная соль | Ni (ClO 4 ) 2 | Cu (ClO 4 ) 2 | Fe (NO 3 ) 3 | NdCl 3 | DyCl 3 |
|---|---|---|---|---|---|
| Моляльность соли | 3,80 | 2,00 | 2.0 | 2,85 | 2.38 |
| Число гидратации катионов † | 5,8 (2) | 4,9 (3) | 5,0 (2) | 8,5 (2) | 7,4 (5) |
| θ / град ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
† Цифры в скобках представляют собой стандартные отклонения последней значащей цифры значения. ‡ угол между связью M-OH 2 и плоскостью молекулы воды.
Большинство этих данных относятся к концентрированным растворам, в которых очень мало молекул воды, которые не находятся в сферах первичной гидратации катиона или аниона, что может объяснить некоторые вариации сольватационного числа с концентрацией, даже если нет контактного иона. спаривание. Угол θ дает угол наклона молекул воды относительно плоскости в акваионе. На этот угол влияют водородные связи, образующиеся между молекулами воды в первичной и вторичной сольватных оболочках.
Измеренное сольватационное число представляет собой усредненное по времени значение для раствора в целом. Когда измеренное число первичной сольватации является дробным, два или более частиц с целыми числами сольватации находятся в равновесии друг с другом. Это также относится к числам сольватации, которые являются целыми числами в пределах экспериментальной ошибки. Например, сольватационное число 5,5 для раствора хлорида лития можно интерпретировать как результат присутствия двух разных акваионов с равными концентрациями.
лежащий целиком в пользу ионной пары.
Колебательные спектры
Инфракрасные спектры и спектры комбинационного рассеяния могут быть использованы для измерения частоты растяжения МО в акваионах металлов. Рамановская спектроскопия особенно полезна, потому что спектр комбинационного рассеяния воды слаб, тогда как инфракрасный спектр воды интенсивен. Интерпретация частот колебаний несколько усложняется наличием в октаэдрических и тетраэдрических ионах двух колебаний: симметричного, измеренного в спектре комбинационного рассеяния, и антисимметричного, измеренного в инфракрасном спектре.
| ион металла | Быть 2+ | Мг 2+ | Mn 2+ | Fe 2+ | Ni 2+ | Cu 2+ | Zn 2+ | Hg 2+ | Al 3+ | Ga 3+ | Через 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| волновое число / см −1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Хотя связь между частотой колебаний и силовой постоянной непроста, общий вывод, который можно сделать из этих данных, заключается в том, что прочность связи МО увеличивается с увеличением заряда иона и уменьшением размера ионов. Частоту растяжения МО акваиона в растворе можно сравнить с его аналогом в кристалле известной структуры. Если частоты очень похожи, можно сделать вывод, что координационное число иона металла в растворе такое же, как и в соединении в твердом состоянии.
Динамические методы
| Ли + | Na + | CS + | Мг 2+ | Ca 2+ | Ba 2+ | Zn 2+ | Cr 3+ | Al 3+ | |
|---|---|---|---|---|---|---|---|---|---|
| Ионный транспортный номер | 13–22 | 7-13 | 4 | 12–14 | 8–12 | 3-5 | 10-13 | ||
| Ионная подвижность | 3–21 | 2-10 | 10-13 | 7-11 | 5-9 | 10-13 | |||
| Диффузия | 5 | 3 | 1 | 9 | 9 | 8 | 11 | 17 | 13 |
Сольватационные числа и структуры
Водород
Щелочные металлы
Щелочноземельные металлы
Металлы 3 группы, лантаноиды и актиниды
Металлы 4-12 группы
Сольватационное число 6 с октаэдрической структурой хорошо установлено для цинка (II) и кадмия (II) в разбавленных растворах. В концентрированных растворах ион Zn 2+ может принимать четырехкоординатную тетраэдрическую структуру, но доказательства неубедительны из-за возможности образования пар и / или гидролиза ионов. Сольватационное число ртути (II), скорее всего, равно 6.
Металлы 13-17 группы
Олово (II) и свинец (II) имеют 3-х и 6-ти координатную полукорпусную направленность соответственно. Для олова (II) первая координационная сфера рассчитана так, чтобы разделиться на две полусферы на разных расстояниях от иона. На практике эти катионы имеют тенденцию быть полиядерными. Висмут (III) представляет собой 8-координатную искаженную квадратную антипризматическую форму.
Хотя на структуры таллия (I), германия (II), олова (II), свинца (II) и сурьмы (III) влияют неподеленные пары, это не так для висмута (III).
Оксо-аква-катионы
Некоторые элементы в степени окисления выше 3 образуют стабильные, водные оксо-ионы. Хорошо известными примерами являются ионы ванадила (IV) и уранила (VI). Их можно рассматривать как особо стабильные продукты гидролиза в гипотетической реакции, такой как
Термодинамика
M z + (газ) + растворитель → M z + (в растворе)
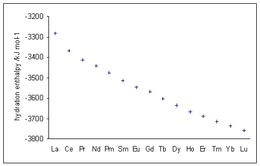
Энтальпию этой реакции нельзя измерить напрямую, потому что во всех измерениях используются солевые растворы, содержащие как катион, так и анион. Большинство экспериментальных измерений относятся к теплу, выделяющемуся при растворении соли в воде, которое дает сумму энтальпий сольватации катионов и анионов. Затем, рассматривая данные для разных анионов с одним и тем же катионом и разных катионов с одним и тем же анионом, получают значения для одного иона относительно произвольного нуля.
Может быть получена энтропия гидратации одного иона. Значения показаны в следующей таблице. Чем отрицательнее значение, тем больше упорядоченности в образовании акваиона. Примечательно, что тяжелые щелочные металлы имеют довольно низкие значения энтропии, что позволяет предположить, что как первая, так и вторая сольватационные оболочки несколько нечеткие.
Гидролиз акваионов
Есть два способа взглянуть на равновесие, связанное с гидролизом акваиона. Учитывая равновесие диссоциации
активность продукта гидролиза, пропуская молекулы воды, дается
Альтернативой является запись равновесия в виде реакции комплексообразования или замещения.
На практике первое определение более полезно, потому что константы равновесия определяются из измерений концентраций ионов водорода. В целом,
Моделирование реакций гидролиза, протекающих в растворе, обычно основано на определении констант равновесия по данным потенциометрического (pH) титрования. Этот процесс далеко не прост по целому ряду причин. Иногда частицы в растворе могут выпадать в осадок в виде солей, и их структура подтверждается рентгеновской кристаллографией. В других случаях осажденные соли не имеют никакого отношения к тому, что предполагается в растворе, потому что определенные кристаллические вещества могут иметь как низкую растворимость, так и очень низкую концентрацию в растворах.
Первая константа гидролиза
показывает линейную зависимость от отношения заряда к расстоянию до МО, z / d. Ионы делятся на четыре группы. Наклон прямой линии одинаков для всех групп, но точка пересечения A различается.
Стандартное изменение энтальпии для первой стадии гидролиза обычно не сильно отличается от изменения энтальпии при диссоциации чистой воды. Следовательно, стандартное изменение энтальпии для реакции замещения
близко к нулю. Это типично для реакций между твердым катионом и твердым анионом, например гидроксид-ионом. Это означает, что стандартный энтропийный заряд вносит основной вклад в изменение стандартной свободной энергии и, следовательно, в константу равновесия.
Изменение заряда иона отвечает за этот эффект, поскольку акваион оказывает большее упорядочивающее действие на раствор, чем гидроксокомплекс с меньшим зарядом.
Множественные реакции гидролиза
Полная реакция потери двух протонов из акваиона может быть записана как
Однако константа равновесия потери двух протонов одинаково хорошо применима к равновесию
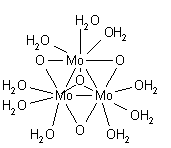
потому что концентрация воды считается постоянной. Это применимо в целом: любая константа равновесия одинаково действительна для продукта с оксидным ионом, как и для продукта с двумя гидроксильными ионами. Эти две возможности можно различить только путем определения структуры соли в твердом состоянии. Оксомосты обычно возникают при высокой степени окисления металла. Примером может служить комплекс молибдена (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+, в котором есть треугольник из атомов молибдена, соединенных σ-связями с оксидным мостиком на каждом краю треугольника и четвертый оксид, связывающий все три атома Мо.
Оксианионы
Оксо-акваионов металлов в степени окисления +5 и выше очень мало. Скорее, разновидностями, обнаруженными в водном растворе, являются мономерные и полимерные оксианионы. Оксианионы можно рассматривать как конечные продукты гидролиза, в которых к металлу присоединены не молекулы воды, а только ионы оксидов.
Кинетика обмена
Символ * означает, что это переходное состояние в химической реакции. Скорость этой реакции пропорциональна концентрации акваиона [A].
Обмен растворителя обычно происходит медленнее для трехвалентных ионов, чем для двухвалентных ионов, поскольку более высокий электрический заряд на катионе способствует более прочным связям M-OH 2 и, как следствие, более высокой энергии активации стадии диссоциативной реакции, [M (H 2 O) n ] 3+ → [M (H 2 O) n-1 ] 3+ + H 2 O. Значения в таблице показывают, что это связано как с энтальпией активации, так и с энтропийным фактором.
Формирование комплексов
pM x + (aq) + qL y− → [M p L q ] (px-qy) +
Электрохимия
| H + 0 | |||||||||||||
| Li + −3,040 | Be 2+ −1,85 | ||||||||||||
| Na + -2,71 | Mg 2+ -2,372 | Al 3+ -1,66 | |||||||||||
| К + −2,931 | Ca 2+ −2,868 | Sc 3+ -2,90 | . | Zn 2+ -0,751 | Ga 3+ −0,53 | Ge 2+ +0,1 | |||||||
| Rb + −2,98 | Sr 2+ −2,899 | Y 3+ −2,37 | . | Cd 2+ -0,403 | В 3+ −0,342 | Sn 2+ -0,136 | Сб 3+ +0,15 | ||||||
| Cs + −3,026 | Ba 2+ −2,912 | Лю 3+ −2,25 | . | Hg 2+ −0,854 | Tl 3+ +0,73 | Pb 2+ -0,126 | Би 3+ +0,16 | По 4+ +0,76 | |||||
| Fr + −2,9 | Ra 2+ −2,8 | Lr 3+ -1,96 | |||||||||||
| La 3+ −2,52 | Ce 3+ −2,32 | Pr 3+ −2,34 | Nd 3+ −2,32 | Рт 3+ -2,30 | См 3+ −2,28 | Eu 3+ -1,98 | Gd 3+ −2,27 | Tb 3+ −2,27 | Dy 3+ −2,32 | Но 3+ −2,37 | Er 3+ −2,33 | Тм 3+ −2,30 | Yb 3+ −2,23 |
| Ас 3+ −2,18 | Чт 4+ -1,83 | Па 4+ -1,46 | U 4+ -1,51 | Np 4+ -1,33 | Pu 4+ -1,80 | Am 3+ −2,06 | Cm 3+ -2,07 | Бк 3+ −2,03 | Cf 3+ −2,01 | Es 3+ -1,99 | Fm 3+ -1,97 | Md 3+ -1,65 | Нет 3+ -1,20 |
| Пара | Ti | V | Cr | Mn | Fe | Co | Ni | Cu |
|---|---|---|---|---|---|---|---|---|
| M 2+ / M | -1,63 | −1,18 | -0,91 | −1,18 | -0,473 | −0,28 | -0,228 | +0,345 |
| M 3+ / M | −1,37 | -0,87 | -0,74 | −0,28 | -0,06 | +0,41 |
| Ag + / Ag | Pd 2+ / Pd | Pt 2+ / Pt | Zr 4+ / Zr | ВЧ 4+ / ВЧ | Au 3+ / Au | Ce 4+ / Ce |
|---|---|---|---|---|---|---|
| +0,799 | +0,915 | +1,18 | −1,53 | -1,70 | +1,50 | -1,32 |