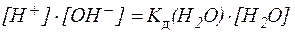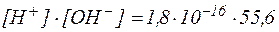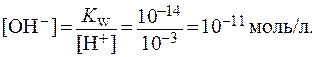что такое ионное произведение воды
Ионное произведение воды. Водородный показатель
Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе.
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O + заменить на H +
H2O ↔ H + + OH —
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H + ]·[OH — ]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H + ]·[OH — ]
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H + ] и [OH — ] — переменные, и по их величинам можно говорить о кислотности или щелочности раствора.
При нейтральном характере раствора, т.е. при равенстве концентраций ионов водорода и гидроксид-ионов [H + ] = [OH — ], получаем следующее выражение:
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды.
Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода.
Более удобно пользоваться водородным показателем pH.
Водородный показатель pH — это отрицательный логарифм концентрации ионов водорода
Отметим, что изменению [H + ] в 10 раз соответствует изменение pH всего на 1 единицу.
Противоположный водородному показатель — показатель основности раствора рОН
pH и pOH нейтрального раствора равен 7:
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH
Активность ионов водорода и гидроксид-ионов
Все рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H + или ОH — составляют большие величины, то ионное произведение воды выражается через активности ионов водорода и гидроксид-ионов:
где aH + и aOH — — соответственно активности ионов водорода и ионов гидроксила;
K ` H2O — истинная константа, значение которой не зависит от величины ионной силы раствора.
Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода.
Диссоциация воды. Водородный показатель. Среды водных растворов электролитов
Вода — слабый амфотерный электролит.
Уравнение ионизации воды с учетом гидратации ионов водорода Н + таково:
Без учета гидратации ионов Н + уравнение диссоциации воды имеет вид:
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (KH2O).
KH2O — величина постоянная, и при температуре 25 о С
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов:
Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш).
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора.
Существуют различные методы измерения рН. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале рН: лакмус — в интервале рН от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0.
Изменение цвета индикаторов показано на схеме:
Заштрихованные области показывают интервал изменения окраски индикатора.

Кроме указанных выше индикаторов, применяют также универсальный индикатор, который можно использовать для приблизительного определения рН в широком интервале от 0 до 14.
Величина рН имеет большое значение в химических и биологических процессах, так как в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях.
Поэтому определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение рН крови или желудочного сока является диагностическим тестом в медицине. Отклонения рН от нормальных, величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме. Постоянство концентраций ионов водорода Н + является одной из важных констант внутренней среды живых организмов.
Так, при нормальной кислотности желудочный сок имеет рН 1,7; рН крови человека равен 7,4; слюны — 6,9. Каждый фермент функционирует при определенном значении рН: каталаза крови при рН 7 пепсин желудочного сока — при рН 1,5—2; и т. д.
Ионное произведение воды. Водородный показатель
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Равновесие процесса диссоциации воды:
Н2О ↔ Н + + ОН —
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н + ] [ОН — ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10 — 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н + и ОН — значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100 о С величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H + ]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
рН + рОН = 14, (3)
Для нейтральных растворов рН = 7, для кислых растворов рН 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Примеры решения задач
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н + ] = 0,001 моль/л.
рН = –lg [H + ] = –lg 0,001 = 3
В растворе КОН: [ОН – ] = 0,001 моль/л. рОН = –lg [ОH — ] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К + + ОН —
рОН = –lg [ОH — ] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н + ] = 10 –14 /[ОН – ] = 10 –14 /0,01 = 10 –12 моль/л.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва 2+ + 2ОН –
-lg [ОH – ] = 2, откуда [ОH – ] = 0,01 М.
Решение.
NH3 H2O ⇔ NH4 + + OH — или упрощенно: NH4ОH ⇔ NH4 + + OH —
рН = –lg [H + ] = –lg 2,4·10 –11 = 10,6.
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО — + Na +
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
[H + ] = 1,75·10 –5 · 0,01 / 0,073 = 2,4·10 –6 моль/л.
Задачи для самостоятельного решения
1. Определите величину рН 0,0001 М раствора HCl.
Ионное произведение воды. Водородный показатель



Кислотно-основное равновесие в водных растворах
Большинство химических реакций протекает в растворах. Среди растворителей исключительное место занимает вода. Это обуслов-лено ее уникальными свойствами, не присущими другим раство-рителям. Так, многие вещества в воде являются сильными электро-литами. Ионизирующая способность воды связана с высоким значе-нием диэлектрической проницаемости (ε = 81) и сольватирующей (гидратирующей) активностью. В этой связи полезно рассмотреть закономерности процессов, протекающих в водных растворах.
Ионное произведение воды. Водородный показатель
Вода относится к очень слабым амфотерным электролитам. Чистая вода в незначительной степени диссоциирует на ионы:
Применяя закон действующих масс, можно написать:
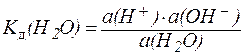 . . | (1) |

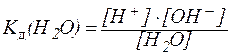 . . | (1¢) |
Так как степень диссоциации воды незначительная, то равновесную концентрацию недиссоциированных молекул воды [Н2О] можно считать постоянной и объединить ее с 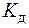
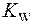
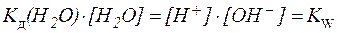 | (2) |
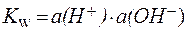 | (3) |
Однако в разбавленных растворах, в которых коэффициенты активности близки к единице, этим различием при не очень точных расчетах можно пренебречь.
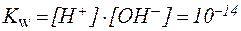 | (4) |
В водных растворах различных соединений в зависимости от соотношения концентраций ионов Н + и ОН – реакция среды может быть:
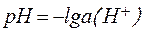 , , | (5) |
а для разбавленных растворов:
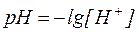 . . | (6) |
Для количественной характеристики активной щелочности применяют гидроксидный показатель (рОН):
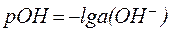 , , | (7) |
а для разбавленных растворов:
 . . | (8) |
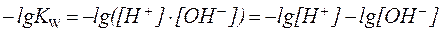
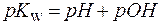 | (9) |
При помощи водородного показателя удобно выражать характер среды:
нейтральная среда: рН = 7 (рН = рОН),
кислая среда: рН 7 (рН > рОН).
Таким образом, увеличение концентрации ионов Н + уменьшает рН (величина рОН при этом возрастает), а уменьшение концентрации ионов Н + увеличивает рН (величина рОН при этом уменьшается). При сопоставлении значений pН разных растворов следует относить эти значения к одной и той же температуре.
В растворах кислот различают: активную кислотность, потенци-альную кислотность и общую кислотность.
Активная кислотностьобусловлена наличием свободных ионов Н + в растворе. Эта кислотность характеризуется определенным значением рН.
Общая кислотность— сумма активной ипотенциальной кислотностей.
В разбавленных растворах кислот, полностью диссоциированных на ионы, общая кислотность практически равна активной кислотности.
В растворах слабых кислот активная кислотность всегда меньше общей кислотности:
Шкала значений pH
Что такое ионное произведение воды
§10.3. Водородный показатель. Шкала рН.
Впрочем, даже для такого слабого электролита, как вода, можно измерить константу диссоциации Кд:
Чтобы разобраться в том, как устроена шкала рН, сначала упростим выражение для константы диссоциации воды. Действительно, величина [Н2О] есть не что иное, как молярная концентрация воды, выраженная в моль/л. Но число молей воды в 1 л воды всегда постоянно! Если рассматривать чистую воду как «раствор воды в воде», то нетрудно посчитать число молей Н2О в 1 л воды.
Масса 1 моля воды 18 г (молярная масса воды), а масса 1 литра воды составляет 1000 г (примем, что плотность Н2О при комнатной температуре не сильно отличается от 1 г/см 3 ):
18 г Н2О – 1 моль,
1000 г Н2О (1 л) – х моль.
Отсюда:
Следовательно, в 1 л чистой воды всегда содержится 55,6 моль Н2О, а значение [Н2О] = 55,6 моль/л является величиной постоянной.
Теперь мы можем умножить константу диссоциации воды на эту постоянную величину 55,6. Получим:
55,6·Кд = [Н + ][ОН – ] = 55,6·1,8·10 –16 = 100·10 –16 = 10 –14
Если новую константу 55,6·Кд обозначить как Кw (от английского water – вода), получается выражение, называемое ионным произведением воды:
# Для воды и ее растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды Кw.
Рис. 10-2. Шкала рН. Ниже шкалы показаны цвета универсальной индикаторной бумаги. Цвет бумажной полоски изменяется в зависимости от рН раствора, которым она смочена.
Водородный показатель можно не только измерить с помощью индикаторной бумаги или рН-метра, но и вычислить. Для этого концентрацию ионов водорода в растворе следует записать как 10 n моль/л. В таком случае рН будет равен показателю степени n, взятому с обратным знаком. Например, концентрация ионов водорода в нейтральном растворе составляет [Н + ] = 10 –7 моль/л (n = –7). Следовательно, в нейтральном растворе рН = 7.
# Для нейтральных растворов и чистой воды рН = 7.
Это значение (рН = 7) располагается точно посередине шкалы. Теперь надо разобраться в том, как получаются крайние значения шкалы слева и справа: 0 и 14.
Допустим, имеется раствор сильной одноосновной кислоты (например, HCl или HBr) концентрации 1 моль/л. В этом случае концентрация ионов водорода Н + тоже составит 1 моль/л. Ионное произведение воды и в таком растворе сохраняет свое значение:
В таком случае [Н + ] = 10 0 (поскольку 10 0 = 1 моль/л). Следовательно, рН = 0. Это самый кислый раствор в шкале рН.
Чем меньше рН, тем выше кислотность среды. И наоборот, чем больше рН, тем выше щелочность среды.
Приведем конкретные примеры. Допустим, имеется раствор сильной кислоты HCl концентрации 0,01 моль/л. Поскольку молекулы HCl в растворе полностью распадаются на ионы, концентрация ионов Н + тоже составит 0,01 моль/л (или 10 –2 моль/л), а рН = 2. Мы видим, что для кислых растворов рН 7. Покажем это на примере раствора сильного основания NaOH, концентрация которого тоже 0,01 моль/л. Концентрация ионов ОН – составит 0,01 моль/л (или 10 –2 ). Поскольку Кw всегда остается постоянной, можно вычислить концентрацию ионов водорода и рН в таком растворе:
Кw = [Н + ][10 –2 ] = 10 –14
или
Следовательно, в данном случае рН = 12.
В общем случае формула, помогающая определить рН щелочных растворов, выглядит так:
Раньше, в §8.5 мы уже рассказывали о специальных веществах – индикаторах – с помощью которых можно качественно определять среду раствора. Индикаторы меняют цвет в зависимости от кислотности или щелочности растворов. Достаточно добавить 1-2 капли разбавленного водно-спиртового раствора индикатора в исследуемый раствор, чтобы проявилась окраска. Например, индикатор фенолфталеин в щелочных растворах малиновый, а в кислых растворах – бесцветный. Индикатор лакмус дает красное окрашивание в кислой среде, а в щелочной – синее. Здеь мы воспроизводим таблицу индикаторов из §8.5, но теперь уже с указанием интервалов рН, в которых происходят цветовые переходы.
Таблица 10-1. Цветовые переходы некоторых индикаторов в зависимости от рН среды.
Цвет индикатора, интервал рН:
В опытах из «Единой коллекции образовательных ресурсов» показывается действие кислот и щелочей на разные индикаторы.
Как видно из таблицы, рН раствора не обязательно может иметь целочисленное значение. В отличие от индикаторной бумаги, современные электронные приборы – рН-метры – измеряют рН с точностью до двух знаков после запятой.
** Более строго водородный показатель определяется следующим образом: рН раствора равен обратному логарифму от концентрации ионов водорода в этом растворе.
Не все наши читатели уже знакомы с логарифмами, поэтому коротко объясним, что это такое. Десятичный логарифм числа а, т.е. логарифм по основанию 10 (обозначение log10а или lgа), показывает, в какую степень надо возвести число 10 (основание логарифма), чтобы получить число а.
Например,
lg100 = 2 (поскольку 10 2 = 100),
lg1000 = 3,
lg10 = 1,
lg1 = 0 (поскольку 10 0 = 1), и т.д.
Логарифмы обладают многими полезными свойствами, необходимыми для сложных вычислений. Среди них два важных соотношения:
рН = – lg 5,1·10 –3 = – (lg 5,1 + lg10 –3 ).
Для второго члена этой суммы можно применить другое свойство логарифмов:
рН = – (lg 5,1 + lg10 –3 ) = – (lg 5,1 – 3 lg10), или
рН = 3 – lg 5,1.
С помощью инженерного калькулятора можно вычислить значение lg 5,1 = 0,7. Отсюда рН = (3 – 0,7) = 2,7.
Область применения водородного показателя очень широка: это не только аналитическая химия, но и пищевая промышленность, экология, биология, медицина. Например, рН свежего молока должен быть в интервале 6,6–6,9. Речная и водопроводная вода имеют рН немного меньше 7. В морской воде среда слабощелочная (рН = 8). Кровь человека должна сохранять значение рН в очень узком интервале: 7,35–7,45. Изменение на 0,1–0,2 единицы рН может иметь тяжелые последствия для здоровья. Косметические и моющие средства проходят проверку на оптимальное значение рН для того, чтобы при их использовании не страдала кожа.
** Но как вычисляют рН в растворах слабых кислот и оснований? Ведь в этом случае распад на ионы происходит не полностью. Например, в растворе слабой кислоты концентрация ионов H + уже не будет равна концентрации самой кислоты. Здесь на помощь приходит закон разбавления Оствальда для слабых электролитов (см. предыдущий параграф). Константа диссоциации Кд и степень диссоциации α слабых электролитов связаны соотношением:
В этом выражении можно умножить левую и правую части на концентрацию С:
Но дело в том, что αС = [H + ] (здесь мы рассматриваем пример слабой кислоты). Поэтому можно записать:
10.7. (НГУ). Рассчитайте рН а) 0,05 М раствора серной кислоты, б) 0,1 М раствора гидроксида калия. Как изменится рН этих растворов при разбавлении в 10 раз?
10.8. Имеется раствор соляной кислоты с рН = 5. Какова концентрация ионов водорода в таком растворе? Раствор разбавили в 10 раз – каким станет его рН? Раствор разбавили еще в 10 раз – каков теперь рН раствора? Если полученный раствор разбавить еще в 10 раз, сможет ли он стать щелочным?
10.9. (НГУ). В 200 мл раствора NaOH содержится 1,204·10 21 ионов натрия. Рассчитайте рН раствора. Как изменится значение рН при добавлении к этому раствору 100 мл 0,05 М раствора HCl?
10.10. (НГУ). Между собой реагируют 2,0 г водорода и 2,0 г хлора. Образовавшийся газ поглощается в 560 мл H2O (без изменения объема раствора). Определите рН полученного раствора.
** 10.12. (НГУ). Рассчитайте рН раствора, полученного при количественном взаимодействии 100 мл 0,01 М водного раствора сероводорода с газообразным хлором, который при Р = 1 атм и t о = 25 о С занимает объем 97,8 мл. Указание: объем раствора не меняется, образующиеся кислоты диссоциируют полностью.