что такое инвазия в гинекологии при беременности
Пренатальный скрининг или анализ крови беременных на маркеры патологии плода
Анализ крови беременных на маркеры (франц. marqueur, от marquer — отметка) патологии плода или биохимический скрининг беременных.
Такой анализ крови служит единственным средством поиска аномалий развития и патологии плода, потому что отображает состояние плода и плаценты посредством специфических белков, проникающих в кровь беременной.
Своевременное выявление изменений позволяет врачу сформировать группы риска беременных женщин с хромосомной патологией плода.
В настоящее время, согласно приказа МОЗ Украины №417 от 15.07.2011г., биохимический скрининг проводится в два этапа – скрининг I триместра (11недель.+1 день – 13 недель+6 дней); и скрининг II триместра (18-21 недель).
При раннем биохимическом скрининге (скрининг I триместра) — в крови беременной определяют уровень двух плацентарных белков: РАРР-А (pregnancy associated plasma protein или связанный с беременностью плазменный протеин А) и свободную бета субъединицу ХГЧ (хорионического гонадотропина человека). Такой анализ называют «двойной тест».
Различные изменения уровня ранних маркеров, указывают на повышенный риск наличия у плода хромосомных и некоторых не хромосомных нарушений. Подозрение на наличие у плода синдрома Дауна вызывает снижение уровня РАРР-А и повышение уровня свободной бета субъединицы ХГЧ.
Для биохимического скрининга II триместра (18-21 недель ) чаще всего в крови беременной определяют уровень АФП (альфафетопротеина), ХГЧ (хорионического гонадотропина человека) и свободного (неконъюгированного) эстриола. Такой анализ называют — «тройной тест». Значительно повышенный уровень АФП наблюдается при грубых пороках развития головного и спинного мозга плода, при неблагоприятном течении беременности, угрозе прерывания, резус-конфликте, внутриутробной гибели плода и является прогностически неблагоприятным признаком.
При многоплодной беременности повышенный уровень АФП является нормой. Сниженный уровень АФП может быть при синдроме Дауна, при низко расположенной плаценте, ожирении, наличии у беременной сахарного диабета, гипотиреоза. Может встречаться при нормально протекающей беременности. Существует зависимость уровня АФП от рассовой принадлежности.
ХГЧ и свободный эстриол являются белками плаценты, их уровень характеризует состояние плаценты на конкретном этапе беременности, может меняться, если у плода (и соответственно в плаценте), имеются хромосомные нарушения, при наличии угрозы прерывания беременности, изменений в плаценте вследствие инфекционного повреждения. Измененный уровень ХГЧ и свободного эстриола может быть при нормально протекающей беременности.
Типичным при наличии у плода синдрома Дауна является повышенный уровень ХГЧ в сочетании со сниженным уровнем АФП и свободного эстриола.
Уровень сывороточных маркеров в крови беременных меняется в соответствии со сроком беременности.
Так как лаборатории используют разные нормы для оценки маркеров, в зависимости от используемых реактивов, то принято оценивать уровни сывороточных маркеров в относительных единицах – МоМ (multiples of median — кратное от среднего значения).
| Типичные профили MoM — Первый триместр | ||
| Аномалия | PAPP-A | Своб. β-ХГЧ |
| Тр.21 (синдром Дауна) | 0,41 | 1,98 |
| Тр.18 (Синдром Эдвардса) | 0,16 | 0,34 |
| Триплоидия типа I/II | 0,75/0,06 | |
| Синдром Шерешевского-Тернера | 0,49 | 1,11 |
| Синдром Клайнфельтера | 0,88 | 1,07 |
Типичные профили MoM — Второй триместр
| Аномалия | АФП | Общ. ХГЧ | Св. эстриол |
| Тр.21 (синдром Дауна) | 0,75 | 2,32 | 0,82 |
| Тр.18 (синдром Эдвардса) | 0,65 | 0,36 | 0,43 |
| Триплоидия типа I/II | 6,97 | 13 | 0,69 |
| Синдром Шерешевского-Тернера | 0,99 | 1,98 | 0,68 |
| Синдром Клайнфельтера | 1,19 | 2,11 | 0,60 |
Изменение какого-то одного показателя биохимического скрининга не имеет существенного значения.
Корректно оценивать результаты пренатального скрининга с использованием компьютерных программ расчета генетического риска, в которых учитываются индивидуальные показатели каждой беременной – возраст, вес, этническая принадлежность, наличие некоторых заболеваний. Данные показателей УЗИ плода.
Результаты расчета Пр. Риска не являются диагнозом заболевания, а представляют собой оценку индивидуального риска.
В настоящее время, наиболее часто используемая стратегия — последовательно объединить риск, определенный по результатам скрининга первого и второго триместров с использованием компьютерного моделирования. В этой пошаговой последовательной стратегии, пары называются «скрининг-положительными» по синдрому Дауна, если срок беременности подтвержден при ультразвуковом обследовании, а предполагаемый риск равен или больше, чем риск для 35- летней женщины. В этот момент паре можно предлагать инвазивное пренатальное исследование, так как их риск по аутосомной трисомии достиг уровня риска у женщин старшего возраста, которым предлагается инвазивная процедура. Остальные пары с меньшим повышением риска затем проходят исследования во втором триместре, при этом для определения показаний к инвазивной процедуре используются комбинированные результаты как первого, так и второго триместра. Эта стратегия может обнаружить вплоть до 95% всех случаев синдрома Дауна с частотой ложно-положительных ответов около 5%.
Для обеспечения компьютерной автоматизации и обработки данных при проведении 2-х этапного пренатального скрининга в КДЛ «ГЛОРИ» инсталлировано лицензированное оборудование и реактивы для реализации программы «Калькулятор риска синдрома Дауна» (КРСД) Хема», разработанной совместно специалистами лаборатории пренатальной диагностики НИИ ПАГ им.Д.О. Отта РАМН и ООО «Интеллектуальные программные системы» (Санкт-Петербург).Программа рассчитывает срок беременности исходя из заключения, сделанного на основании УЗИ, и автоматически запрашивает ввод параметров 1-го или 2-го триместров беременности. Помимо срока беременности, программа учитывает вес беременной, число плодов и расовую принадлежность, наличие сахарного диабета. В отдельном файле автоматически происходит накопление статистических данных по всем проведенным исследованиям и формирование собственных медиан за весь период использования программы пользователем.
Трофобластическая болезнь
Заболевание представляет собой группу редких доброкачественных и злокачественных опухолей, в основе которых лежит аномальный рост и развитие трофобласта.
Что это такое
Трофобластическая болезнь — уникальная группа опухолей женского организма, возникновение которых всегда ассоциировано с беременностью. Они могут возникнуть как во время беременности, так и после её завершения независимо от срока окончания беременности и её исхода. Это может быть благополучно протекавшая беременность, завершившаяся родами, самопроизвольный выкидыш или прерывание на любом сроке беременности. При этом сроки развития заболевания могут составлять от нескольких дней до нескольких лет.
Источником трофобластических опухолей являются трофобласты – клетки, которые окружают эмбрион и участвуют в процессе его прикрепления к стенке матки, а затем – в образовании плаценты во время беременности. При чрезмерном размножении трофобластов возникает опухоль.
Частота развития данной патологии составляет не более 1 % случаев среди всех злокачественных заболеваний женских половых органов. Наиболее склонны к заболеванию женщины, у которых беременность наступила до 21 года или после 35 лет.
Уникальной особенностью этих неоплазий является высокая частота излечения даже при наличии отдаленных метастазов, при этом у большинства пациенток после завершения лечения сохраняется репродуктивная функция.
Классификация
Трофобластическая болезнь – собирательное понятие доброкачественных и злокачественных опухолей. В число первых входит морфологическое изменение, из-за которого возникает:
Полный пузырный занос
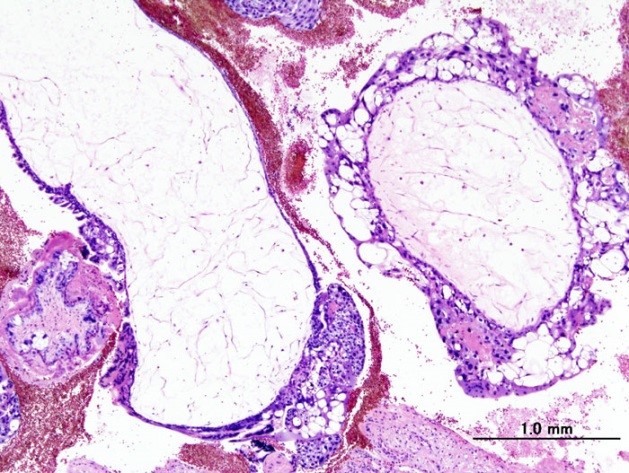
Эти доброкачественные опухоли диагностируются у 70 % больных, при этом как при полном, так и неполном пузырном заносе наблюдается только разрастание трофобластической ткани и превращение ворсинок хориона в пузырьки. Однако в 20 % случаев трофобласты приобретают способность к малигнизации и метастазированию. По мере распространения злокачественных клеток в окружающие ткани различают инвазивный пузырный занос, диссеминированный пузырный занос, хорионкарционому, трофобластическую опухоль плацентарного ложа и эпителиоидную трофобластическую опухоль.
 | ||
 | |
Стадии
В зависимости от степени распространения процесса различают 4 стадии заболевания:

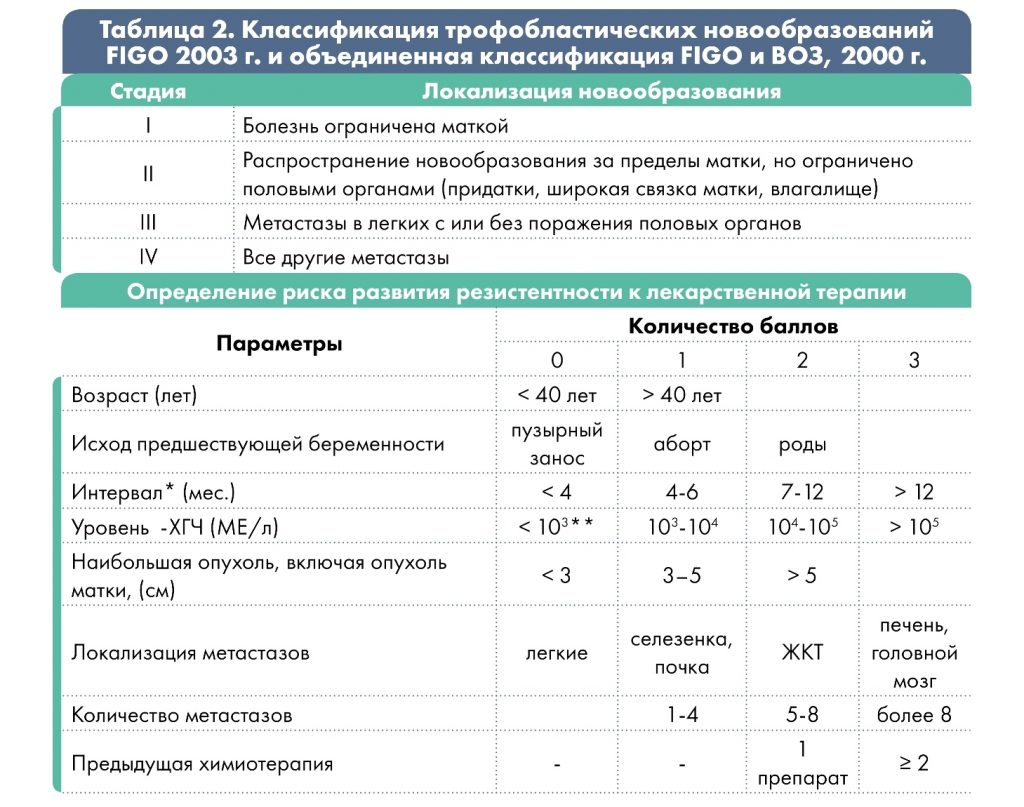
* интервал между окончанием предыдущей беременности и началом химиотерапии;
** низкий уровень β-ХГЧ может быть при трофобластической опухоли на месте плаценты.
При сумме баллов ≤ 6 – низкий риск развития резистентности опухоли; ≥ 7 баллов – высокий.
Лечение
Лечение доброкачественной опухоли невозможно без прерывания беременности. Выполняется аборт, а далее патологические ткани удаляются вакуумным аспиратором. После процедуры на протяжении месяца контролируется уровень β-ХГЧ. Женщина еженедельно сдает анализ крови, пока не получит отрицательный результат три раза подряд. Далее контрольные анализы проводятся ежемесячно в течение года. Важно после эвакуации пузырного заноса выполнить рентгенографию органов грудной клетки и УЗИ органов малого таза.
Если анализ β-ХГЧ остаётся положительным или обнаруживается злокачественная опухоль, то пациентка нуждается в продолжении лечения. Больную следует направить в специализированный центр, имеющий опыт работы и знающий данную патологию, что крайне важно для определения прогноза и эффективности терапии.
Ведущий метод лечения – химиотерапия, которая должна быть начата в кратчайшие сроки. Основные показания для ее проведения:
Врач выбирает рекомендованную схему терапии, основываясь на особенности анамнеза и характеристики опухолевого процесса, т.е. в зависимости от группы риска резистентности опухоли к химиотерапии. Группа риска определяется по шкале FIGO (2000 г.) с учётом результатов обследования: менее 6 баллов соответствует низкому риску, 7 и более баллов – высокому риску.
Если риски рецидива заболевания минимальны, то назначается монотерапия препаратом метотрексат. При высоких рисках рецидива опухоли используется комбинация препаратов, включающих этопозид, дактиномицин, метотрексат, винкристин и циклофосафамид.
Количество циклов химиотерапии определяется индивидуально и зависит от степени снижения уровня β-ХГЧ после каждого цикла. При нормализации уровня специфического маркера дополнительно проводится 2-4 цикла химиотерапии в том же режиме для консолидации полученного эффекта.
Если опухоль приобретает резистентность и нет нормализации уровня маркера, то требуется переход к противоопухолевым препаратам второй линии, например, такие комбинации как дактиномицин, этопозид + дактиномицин + метотрексат + цисплатин или цисплатин + паклитаксел + этопозид.
В некоторых случаях прибегают к хирургическому лечению с последующим проведением адъювантной химиотерапии. Основные показания к оперативному вмешательству являются:
Лучевая терапия используется только при метастазах в головном мозге.
Прогноз
Правильное и своевременное выявление заболевания, а также адекватное лечение в настоящее время позволяют достичь 100 % ремиссии на протяжении пяти лет при простом пузырном заносе и более 90 % – при хорионкарциноме без наличия метастазов.
Повторное развитие опухоли возможно в течение первых 36 месяцев до 10 % случаев. Частота излечение рецидива составляет около 75 %.
Фертильность
После завершения лечения у большинства женщин сохраняется репродуктивная функция. Планировать повторную беременность для пациенток с I-II стадией разрешается через год после последнего цикла химиотерапии, а для больных с III-IV стадией – через полтора-два года. Такие сроки установлены с целью правильной интерпретации наступления беременности или рецидива заболевания, а также для профилактики развития аномалий плода.
Профилактика
После удаления пузырного заноса необходимо следить за уровнем β-ХГЧ, а также выполнить рентгенографию органов грудной клетки и УЗИ органов малого таза. После завершения лечения уровень β-ХГЧ определяется каждые две недели на протяжении первых трех месяцев, затем ежемесячно в течение года. В дальнейшем контрольный анализ крови проводится раз в два месяца, а еще через год – один раз в четыре месяца.
Обязательна контрацепция в течение первого года после нормализации уровня β-ХГЧ. Специалисты рекомендуют в качестве метода контрацепции выбирать комбинированные оральные контрацептивы.
Авторская публикация:
Ульрих Е. А.
Врач высшей категории онкогинекологического отделения ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России, доктор медицинских наук, профессор, профессор кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Под научной редакцией:
Берлев И. В.
Заведующий научным отделом онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, заведующий кафедрой акушерства и гинекологии СЗГМУ им. И.И. Мечникова, заслуженный врач Российской Федерации, доктор медицинских наук, профессор
Под научной редакцией:
Урманчеева А. Ф.
Ведущий научный сотрудник ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России, заслуженный врач Российской Федерации, доктор медицинских наук, профессор, профессор кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Под научной редакцией:
Проценко С. А.
Заведующая отделением химиотерапии и инновационных технологий ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации, доктор медицинских наук, профессор
Под научной редакцией:
Телетаева Г. М.
Врач-онколог отделения химиотерапии и инновационных технологий, научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук
Генетический анализ плода при выкидыше, замершей беременности
Ранняя потеря беременности тяжело переживается будущими родителями.
Согласно данным статистики, выкидышем заканчиваются от 10 до 20% всех диагностированных беременностей. Более, чем в 50% случаев спонтанных ранних выкидышей их причиной является наличие хромосомных дефектов.
Генетический анализ плода (абортивного материала)
В соответствии с принципами доказательной медицины для оказания эффективной помощи при невынашивании беременности необходима диагностика наследственных болезней и генетических нарушений.
Генетический анализ дает возможность:
Показания к молекулярному кариотипированию абортивного материала
Спектр применения исследования довольно широк. Тестирование проводится при наличии определенных состояний и патологий репродуктивной системы, например:
— При постановке диагноза “привычное невынашивание”, двух и более самопроизвольных выкидышах подряд.
— При остановке развития плода (замершей беременности). В случае медикаментозного аборта.
— При диагностировании пузырного заноса.
— При наличии в семье генетических заболеваний.
— После прерывания беременности по медицинским показаниям. В случае преждевременных родов и нежизнеспособности плода.
Результаты генетического анализа плода
Хромосомные отклонения обнаруживаются при кариотипировании абортивного материала в 60-70% случаев. Результат предоставляется в форме количественного и структурного описания хромосомного набора с кратким заключением, указанием нормы, рисков и отклонений.
Нормальный женский (XX) или мужской (XY) кариотип содержит 46 хромосом. Нарушения нормы обычно и являются причиной невынашивания или прекращения развития беременности.
Алгоритмы действий при отборе материала для исследования Процесс сбора биологического материала различается при хирургическом вмешательстве в клинике и при самопроизвольном аборте, произошедшем дома.
Действия в случае замершей беременности
Если процесс извлечения плодного яйца проходит в условиях стационара, следует предупредить медперсонал о необходимости сбора абортивного материала.
В инструкции для врача есть конкретные указания по поводу правил сбора:
Врач, проводящий процедуру, как правило, имеет навык отделения ворсин хориона. В случае затруднений, а также при вакуумной аспирации содержимого матки, в контейнер следует поместить весь полученный материал. Если есть многоплодие, то необходимо собрать ткань каждого эмбриона отдельно.
Эти документы нужно передать гинекологу перед началом процедуры вместе с заранее заказанным контейнером для доставки препарата в лабораторию.
Медикаментозный или самопроизвольный аборт
Позаботиться о сборе абортивного материала необходимо даже в случае спонтанного отторжения плодного яйца. Ведь исследование тканей плода наиболее информативно для выявления возможных генетических нарушений.
Кроме того, кариотипирование позволяет существенно сократить объем прочих анализов и диагностических процедур.
Для полноценной консультации по сбору биоматериал в домашних условиях обязательно свяжитесь с консультантом по телефону горячей линии 8 800 35-05-145.
Также специалист оформит срочную бесплатную курьерскую доставку биообразцов до лаборатории на исследование.
Что такое НИПТ и почему об этом исследовании столько говорят в последнее время? Какие преимущества у данных тестов? Кому они показаны и существуют ли ограничения? Сегодня мы найдём ответы на эти и другие актуальные вопросы.
Биохимические скрининговые программы не обладают высокой точностью, они основаны на cовокупности данных статистики, уровня гормонов и размеров плода по УЗИ. Амниоцентез – самый точный метод, но он инвазивный (нужно сделать прокол плодного пузыря, чтобы получить для исследования клетки, принадлежащие плоду) и угрожает развитием осложнений и прерыванием беременности.
Медицинская наука не прекращала поиски новых тестов для скрининга, которые были бы более точны и не зависели от расчётных показателей. В качестве скрининговых тестов в последнее время хорошо себя зарекомендовали НИПТ (неинвазивные пренатальные тесты) как надёжные, удобные и не мешающие нормальному протеканию беременности. Точность метода достигает 99,9%, так как исследуется генетический материал плода (его ДНК) в венозной крови будущей матери.
Как это возможно? Учёные выяснили, что начиная примерно с 10 недели беременности в крови женщины свободно циркулирует ДНК плода. Благодаря современным технологиям врачи научились выделять её и исследовать, выявляя самые распространенные изменения хромосом.
Таким образом, почти каждая женщина может сдать венозную кровь, дождавшись срока 10 недель беременности, и определить генетическое здоровье будущего малыша.
В каких случаях исследование с применением НИПТ будет наиболее полезно?
В спектре лаборатории KDL представлено несколько комплексов НИПТ. Они отличаются объёмом исследования, показаниями и ограничениями. Важно чтобы понять, какой тест подходит именно Вам.
В каких случаях выполнение НИПТ невозможно?
Итак, выполнение неинвазивных пренатальных тестов возможно при одноплодной и двуплодной беременности. Если беременность одноплодная естественная или наступила после ЭКО с использованием собственной яйцеклетки, то доступны все исследования НИПТ. В остальных случаях существуют ограничения.
В чем отличия разных тестов линейки НИПТ?
НИПС Т21 (Геномед)- диагностика только синдрома Дауна. В исследовании выявляется дополнительная 21 хромосома, если она есть у плода. Синдром Дауна считается одной из самых частых хромосомных аномалий и его частота растёт с увеличением возраста женщины. Выполняется при беременности вследствие естественного зачатия, при ЭКО с собственной яйцеклеткой или при использовании донорской яйцеклетки; при беременности одним плодом и двойней, а также при суррогатном материнстве и если произошла редукция одного эмбриона в двойне.
НИПС 5 – ДНК тест на 5 синдромов (Геномед) – неинвазивный тест на 5 синдромов, можно определить аномалии 13, 18, 21 и в большинстве исследований выявить аномалии половых хромосом X и Y.
НИПС 5 универсальный, его выполнение возможно как при одноплодной естественной беременности, так и при беременности двойней, при носительстве донорской яйцеклетки, суррогатным матерям и в том случае, когда один плод в двойне редуцирован.
3 тестовые базовые панели:
Базовые панели позволяют выявить хромосомные аномалии 13,18, 21, Х и Y хромосом плода, а также триплоидии.
НИПС (Геномед) – включает определение вышеперечисленных синдромов (скрининг 13, 18, 21, Х, Y хромосом плода) и определение носительства у матери частых мутаций, которые могут привести к наследственным болезням, если ребенок унаследует два дефектных рецессивных гена от обоих родителей или один доминантный ген. Данные мутации выявляются в крови без выделения ДНК плода, т.е. оценивается не хромосомная мутация плода, а наличие аномальных вариантов генов у матери.
Генетические заболевания, связанные в тестируемыми в этом исследовании вариантами генов:
НИПС уникален не только клинической значимостью, но и доступностью. Одноплодная беременность, беременность двойней (с определением зиготности), в том числе при редукции одного из эмбрионов в двойне. При ЭКО с донорской яйцеклеткой и суррогатном материнстве этот тест нецелесообразен, так как определять мутации, связанные с генетическими заболеваниями нужно по крови той женщины, чья яйцеклетка дала начало эмбриону.
Следующие 2 панели включают микроделеционные синдромы:
Микроделеции – это поломки сегмента хромосом, которые являются менее распространенными, но не менее опасными, и их невозможно заподозрить на УЗИ.
НИПТ Panorama, расширенная панель (Natera) – исследуются и стандартные аномалии хромосом (13,18,21, Х, Y, триплоидии) и микроделеционные синдромы. Если у Вас беременность одноплодная естественная или в результате ЭКО с собственной яйцеклеткой, то выполнение данных панелей возможно.
При наличии двух плодов, ЭКО с донорской яйцеклеткой и суррогатном материнстве определить сегментарные нарушения технически невозможно.
Можно ли определить пол плода и в каких случаях?
Да, по желанию женщины любой НИПТ определяет пол плода и это доступно как при одноплодной, так и при двуплодной беременности.
Обращаем Ваше внимание, что получение результатов, указывающих на риски развития патологических синдромов, требует консультации генетика и дополнительной инвазивной диагностики.