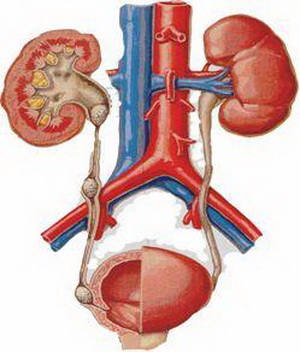
что такое интрамуральный отдел мочеточника
Лечение камней в мочеточнике
Причины появления камней в мочеточниках
Основной и наиболее часто встречаемой причиной камней в мочеточнике считают конкременты, которые спустились в этот орган из почек. Чаще это только один камень, застрявший в выводном протоке – очень узкой трубке длиной до 30 см. Но встречаются случаи, когда камней несколько. Чтобы конкремент застрял, его размер должен составлять более 2 мм. Причины камней в мочеточнике, попавших в него из почек:
Если конкременты спускаются в мочеточник из почек, то их называют вторичными. Такие камни встречаются чаще, чем первичные, которые формируются в самом протоке из-за следующих проблем:
Причины камней в мочеточнике у мужчин те же, что и у женщин. Отличием может быть простатит. Это заболевание встречается только у мужчин, и оно может вызывать появление камней. В ряде случаев образование в протоке конкремента связано с песчинкой, которая двигалась и зацепилась за слизистую органа. На нее нарастают соли и со временем формируется камень.
Симптомы при камнях в мочеточнике
Опасность уретеролитиаза состоит в том, что камни в мочеточниках в сравнении с другим расположением (в мочевом пузыре, мочеиспускательном канале, почках) вызывают более тяжелые и серьезные осложнения. Еще они сопровождаются ярко выраженными признаками. Основные симптомы камней в мочеточниках:
Дополнительно могут появляться:
Этап самостоятельного выведения камней из мочеточника наиболее сложный, поскольку проток очень узкий. Через него могут проходить только неплотные образования. Но даже они вызывают сильнейшие боли.
Характерным симптомом, если камень застрял в мочеточнике, выступает именно очень резкая боль в нижней части живота. Она особенно сильна, когда появляются позывы к мочеиспусканию. Если появилась головная боль, озноб и слабость, это может указывать на задержку мочи и интоксикацию организма. В таком случае необходимо срочно обратиться к врачу.
Виды камней в мочеточниках
Камень может не двигаться по мочеточнику, и тогда его называют фиксированным. Если он перемещается по протоку, то это подвижный конкремент. Еще камни делят на виды в зависимости от состава:
Как диагностируют камни в мочеточниках
На первом этапе обязательно проводится визуальный осмотр и опрос пациента. Для подтверждения подозрений врача проводятся следующие исследования:
Самые эффективные методы лечения
Определенный метод удаления камней из мочеточника выбирают с учетом нескольких важных факторов:
При малом размере прибегают к консервативно-выжидательному лечению камней в мочеточнике. Оно заключается в назначении спазмолитиков, уролитиков, антибиотиков и водной нагрузки более 2 л в сутки. В таких ситуациях конкременты могут быть выведены естественным способом.
В остальных случаях практикуют щадящие способы удаления камней из мочеточника, среди которых:
При камнях размером более 1 см прибегают к открытой или лапароскопической уретеролитотомии. Еще такая операция показана при сильной почечной колике, непродвигающемся камне и закупорке единственной почки.
В клинике урологии имени Р. М. Фронштейна Первого МГМУ имени И. М. Сеченова прибегают к малоинвазивным методам лечения камней в мочеточниках. Но поскольку они наиболее эффективны при конкрементах не слишком больших размерах, от пациента требуется как можно раньше записаться к урологу. В таком случае есть все шансы обойтись без серьезного вмешательства.
По будням Вы можете попасть на прием к урологу в день обращения
Акопян Гагик Нерсесович – профессор, доктор медицинских наук, онколог, уролог в Москве
Прием ведет врач высшей категории, уролог, онколог, доктор медицинских наук, профессор. Автор более 100 научных работ.
Онкоурологический стаж – более 15 лет. Помогает мужчинам и женщинам решать урологические и онкоурологические проблемы.
Проводит диагностику, лечение и сложные операции при таких диагнозах, как:
На консультации уролог подробно ответит на все интересующие вас вопросы
Если не дают покоя затрудненное или учащенное мочеиспускание, боль в поясничной области, кровь в моче, а также другие симптомы (о том, что еще должно вас насторожить, читайте тут), обратитесь за помощью к врачу урологу.
* Если вы планируете обследоваться сразу после встречи с врачом, отправляйтесь в клинику с наполненным мочевым пузырем.
Чтобы встреча с врачом прошла максимально эффективно, подготовьтесь к первичной консультации
Записаться на прием к урологу в Москве можно несколькими способами:
Запись на прием
В будний день мы сможем назначить вам консультацию уже через несколько часов после обращения.
Пузырно-мочеточниковый рефлюкс у детей: лечебная тактика
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна.
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна. Распространенность ПМР и последствия этого заболевания (хронический пиелонефрит, отставание в развитии, артериальная гипертензия, хроническая почечная недостаточность), неизбежно приводящие к инвалидизации, диктуют необходимость поиска путей улучшения лечебной тактики. Среди причин развития ПМР у мальчиков основное место занимают пороки развития устьев мочеточников, в то время как у девочек преобладают вторичные формы ПМР, обусловленные инфекцией мочевых путей и нейрогенными дисфункциями мочевого пузыря (НДМП). Так, на первом году жизни соотношение страдающих ПМР мальчиков и девочек составляет 6:1, а по мере взросления это соотношение изменяется с точностью до наоборот [2].
Чтобы понять причины развития ПМР, необходимо иметь представление о нормальном строении пузырно-мочеточникового сегмента (ПМС) (рис.). Анатомически замыкательная функция ПМС осуществляется благодаря определенному соотношению длины и ширины внутрипузырного отдела мочеточника (5:1), косому прохождению мочеточника через стенку мочевого пузыря. Длинный подслизистый тоннель является пассивным элементом уретеро-везикального «клапана». Активный элемент клапанного механизма представлен мышечно-связочным аппаратом мочеточника, который при сокращении детрузора смыкает устье.
К причинам антифизиологичного тока мочи относятся патологические состояния, приводящие к нарушению замыкательной функции ПМС и высокое внутрипузырное давление мочи. К первым можно отнести врожденные пороки ПМС и воспалительный процесс поверхностного и глубокого слоев треугольников мочевого пузыря (циститы), нарушающий работу детрузора или непосредственно самого ПМС.
Аномалии ПМС являются следствием неправильного развития мочеточникового выроста вольфова протока на 5-й неделе эмбриогенеза [3, 4]. Представить аномалии ПМС можно следующим образом:
Утрата замыкательной функции ПМС встречается при воспалении стенки мочевого пузыря или зоны ПМС. Наиболее часто вторичный ПМР является следствием (осложнением) гранулярной, буллезной или фибринозной форм цистита. Инфекция мочевых путей встречается у 1–2% мальчиков и у 5% девочек. Чаще мочевые пути колонизируются условно-патогенной (кишечной) флорой, среди которой основное место занимает кишечная палочка (40–70%) [3].
В норме ПМС способен противостоять внутрипузырному давлению жидкости до 60–80 см водного столба [5]. Высокое гидростатическое давление является следствием интравезикальной обструкции или функциональных расстройств мочевого пузыря. Интравезикальная обструкция развивается при клапанах задней уретры, рубцовом фимозе у мальчиков, склерозе шейки мочевого пузыря (болезни Мариона), меатальном стенозе у девочек.
НДМП встречаются у 20% детей в возрасте 4–7 лет. К 14 годам число страдающих этими дисфункциями сокращается до 2% [6]. НДМП проявляют себя ирритативной или обструктивной симптоматикой. Основные формы НДМП: гиперактивность детрузора, гипотония детрузора и детрузорно-сфинктерная диссинергия. При этих состояниях ПМР также считается вторичным и является следствием повышения давления жидкости в мочевом пузыре. Гиперактивность детрузора характеризуется резкими скачками внутрипузырного давления и нарушением накопительной функции мочевого пузыря. Гипотония детрузора характеризуется снижением чувствительности стенки пузыря, его переполнением и нарастанием давления мочи в его просвете выше критических цифр. Детрузорно-сфинктерная диссинергия представляет собой нарушение синхронной работы детрузора и сфинктерного аппарата, приводящее к функциональной инфравезикальной обструкции при микции.
С возрастом отмечается тенденция к уменьшению встречаемости первичного и увеличению вторичного ПМР. При этом частота регрессии первичного ПМР находится в обратной зависимости от степени ПМР. При I и II степенях ПМР регрессия отмечается в 80%, а при III — всего в 40% случаев. Объяснение этому дает теория «матурации» ПМС (Hutch, 1961), которая приобрела себе сторонников позднее (Kellerman, 1967; King, 1974). Суть теории заключается в том, что с развитием ребенка происходит физиологическая трансформация ПМС — удлиняется внутрипузырный отдел мочеточника, уменьшается его диаметр относительно длины и изменяется угол впадения в мочевой пузырь.
Современная лечебная стратегия при ПМР включает в себя комплекс мероприятий (терапевтических и хирургических), направленных на устранение причины рефлюкса и ликвидацию его последствий. Выбор метода коррекции ПМР, безусловно, определяется его формой.
Суть консервативной терапии должна сводиться к эрадикации инфекции мочевых путей и устранению функциональных расстройств мочевого пузыря и профилактике гибели почечной паренхимы. По данным Ю. Ф. Исакова, эффективность консервативной терапии при I–III степени ПМР составляет 60–70%. Основными осложнениями (проявлениями) ПМР являются хронический пиелонефрит (50–70%) и рефлюксогенная нефропатия (60–70%) [2]. Этиологическая структура хронического пиелонефрита (по А. Ф. Возианову и др., 2002) представлена следующим образом: кишечная палочка — 40–60%, протей — 9–16%, клебсиелла — 7–20%, стрептококк — 4–10%, L-формы — 15%, микробные ассоциации — 10–15%, энтерококк — 2–5%, синегнойная палочка — 2–7%, энтеробактер — 5–15%, стафилококк — 5–14%.
Антимикробная терапия должна носить длительный характер (6–12 мес) и применяться по результатам посевов мочи. Наиболее удобными для детей являются препараты пероральных форм. При лечении в стационаре применяются внутримышечные или внутривенные формы. Для эрадикации возбудителя нашли применение следующие препараты:
– аугментин, 25–50 мг/кг/сут, перорально в течение 7–10 сут;
– амоксиклав, 20–40 мг/кг/сут, перорально в течение 7–10 сут;
– цефуроксим (зиннат), 20–40 мг/кг/сут (в два приема) в течение 7–10 сут;
– цефаклор (цеклор), 20–40 мг/кг/сут (в три приема) в течение 7–10 сут;
– цефиксим (супракс), 8 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
– цефтибутен (цедекс), 7–14 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
После использования бактерицидных препаратов (антибиотиков) длительным курсом назначается уросептическая терапия:
– налидиксовая кислота — 60 мг/кг/сут, перорально, в течение 3–4 нед;
– пипемидовая кислота (пимидель, палин) — 200–400 мг/сут, перорально, в течение 3–4 нед;
– нитроксолин (5-НОК) — 10 мг/кг/сут, перорально, в течение 3–4 нед.
С целью купирования аллергического компонента назначаются десенсибилизирующие средства:
Важную роль играет применение лекарственных средств, улучшающих внутриклеточный обмен. С антиоксидантной целью назначаются:
С целью коррекции митохондриальной недостаточности применяются:
Обязательным компонентом консервативной терапии является применение фитопрепаратов: листья и плоды брусники, клюквы, смородины, кора дуба, зверобой, крапива, ромашка, черника, мать-и-мачеха и др.
Для повышения эффективности лечения циститов у детей старшего возраста применяется местная терапия — внутрипузырные инстилляции, к которым надо относиться с осторожностью у больных с высокими степенями ПМР. Важно помнить, что объем растворов не должен превышать 20–50 мл. Используются растворы: протаргол; солкосерил; гидрокортизон; хлоргексидин; фурациллин.
Курс лечения рассчитан на 5–10 инстилляций, при буллезном цистите повторяют 2–3 курса. Эффективно дополнение местной терапии физиотерапевтическим лечением.
Особое место в лечении инфекции мочевых путей у детей следует уделять нормализации функции кишечника. Нарушение нормального ритма опорожнения толстой кишки приводит к компрессии нижней трети мочеточника, нарушению васкуляризации, застою в области малого таза, инфицированию мочевых путей (лимфогенный путь).
НДМП наблюдается у пациентов с миелодисплазией и различными ее проявлениями: менингомиелоцеле, рахишизисе, Spina bifida (неполное закрытие позвоночного канала) и др. Лечению НДМП отводится важное звено в комплексной терапии. Устранение функциональных расстройств мочевых путей является сложнейшей задачей и требует длительного времени.
При гипорефлекторном детрузоре рекомендуются:
При гиперактивности детрузора назначаются:
Физиотерапевтическое лечение носит вспомогательный характер, однако значительно повышает эффективность терапии. Этот метод применяется как при НДМП, так и при воспалительных заболеваниях мочевых путей.
Отдельное место в лечении ПМР отводится эндоскопическим методам. Так, согласно опросу, проведенному итальянскими урологами, 80% родителей выбирают эндоскопическое лечение в качестве альтернативы открытым операциям и длительной медикаментозной терапии [7].
Приоритет в медицинском применении тефлоновой пасты принадлежит отоларингологу Arnold, использовавшему ее с целью коррекции голосовой щели (1962). Внедрение в урологическую практику тефлона состоялось в 1974 г., когда V. Politano выполнил парауретральную инъекцию по поводу недержания мочи. Впервые о малоинвазивном эндоскопическом способе коррекции ПМР заявил Е. Маtouschek. В 1981 г. он с положительным результатом выполнил инсуфляцию тефлоновой пасты ребенку 8 лет в область устья рефлюксирующего мочеточника [8]. Впоследствии O. Donnel совместно с P. Puri (1984) описали методику эндоскопического лечения ПМР [9]. За 25 лет опробовано большое количество имплантируемых материалов, начиная с тефлона и заканчивая культурами аутогенных клеток [8–16]. Наиболее полная классификация инъецируемых материалов выглядит следующим образом [17]:
Первый опыт применения антирефлюксных имплантантов настораживал специалистов в связи с возможностью развития нежелательных побочных эффектов: возникновения в месте инъекции некроза, малигнизации, миграции материала с формированием гранулем в регионарных лимфатических узлах и/или паренхиматозных органах [18–20]. Современными экспериментальными и клиническими работами доказана инертность и гипоаллергенность, безопасность используемых в настоящее время биоматериалов [12, 13]. Положительные результаты эндоскопического лечения ПМР, по данным недавних исследований, (Chertin, 2003; Kirsch, 2004) достигают 70–90%.
Показаниями к эндоскопическому способу коррекции ПМР являются неэффективность консервативной терапии в сроки от 6 до 12 мес. Отсутствие острой фазы воспаления мочевого пузыря — обязательное условие для эндоколлагенопластики.
Эндоскопический способ коррекции ПМР благодаря простоте выполнения и достаточно высокой при этом эффективности прочно входит в алгоритм лечебной тактики. Несомненно, важная роль должна отводиться правильному выбору показаний к этому методу. Коллагенизация устья мочеточника оправдана при нормальном его строении, т. е. отсутствии зияния устья и латеральной дистопии. При IV и V степенях ПМР и снижении секреторной функции почки > 50% показано выполнение открытой реимплантации мочеточника.
Метод эндоскопического лечения, направленный на удлинение интрамурального отдела мочеточника и уменьшение диаметра устья, выполняется по следующей методике. Производится цистоскопия, в ходе которой определяется клинико-анатомическая картина мочевого пузыря: состояние мочепузырного треугольника, форма и расположение устьев мочеточника, наличие парауретральных дивертикулов и уретероцеле, воспалительных изменений. Через рабочий канал тубуса цистоскопа проводится длинный инъектор (диаметр 5Сh), присоединенный к шприцу с коллагеном. Коллаген представлен субстанцией в виде геля. Стандартный объем коллагена в шприце — 2 мл. Вкол иглы инъектора (длина 6 мм) осуществляется под устье мочеточника — на 6 ч условного циферблата, на всю глубину. Для профилактики осложнений перед коллагенопластикой возможна катетеризация устья мочеточниковым катетером 5Сh. При давлении на поршень шприца с коллагеном в зоне вкола иглы постепенно образуется валик. В зависимости от степени зияния устья и длины подслизистого отдела мочеточника, вводится от 1 до 2 мл субстанции. При этом устье мочеточника приобретает точечную или щелевидную форму, после чего инструмент удаляется. Мочевой пузырь на сутки дренируется двупросветным уретральным катетером Фоли 8–14Сh, баллон которого наполняется на 5 мл.
Самым эффективным способом коррекции ПМР остается оперативный — 93–97% случаев [21]. Известно более 80 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Принципиальным механизмом всех видов открытых вмешательств является удлинение интрамурального отдела мочеточника с целью создания клапанного механизма, способного пропускать мочу в одном направлении из мочеточника в мочевой пузырь. Наиболее удачной признана техника тоннельного анастомоза, благодаря способности тоннеля противостоять высокому гидростатическому давлению внутри мочевого пузыря (как при наполненном мочевом пузыре, так и при мочеиспускании), препятствуя рефлюксу мочи в мочеточник.
Показаниями к хирургическому лечению являются: рефлюксирующий мегауретер (при ПМР IV, V степени), рецидивирующий характер ПМР при более низких степенях и отсутствии положительного эффекта от консервативного или эндоскопического лечения, сочетание рефлюкса с обструктивным компонентом в зоне ПМС.
В послеоперационный период всем пациентам обязательно проводится профилактическая антибиотикотерапия в течение 3–4 сут с последующим переходом на уросептическую терапию в течение 2–3 нед.
Публикации, касающиеся первого опыта использования тоннельной техники уретероцистоанастомоза, принадлежат D. Williams и J. Hutch и появились они в 60-х годах прошлого столетия [3]. По разным данным, известны от 80 до 120 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Одни выполняются со вскрытием мочевого пузыря (операции Коэна, Политано-Лидбеттера и др.) [22], другие без цистотомии (операции Лича–Грегуара [23, 24], Барри [22]). В любом возрасте эти операции проводятся с применением эндотрахеального наркоза. Осложнения открытых операций в большинстве случаев общие — кровотечение, развитие стриктуры анастомоза, нарушение эвакуации мочи на уровне пузырно-мочеточникового соустья в результате ангуляции и как следствие развитие ретенции верхних мочевых путей, рецидив ПМР, послеоперационный цистит и пиелонефрит [25].
В России наиболее часто выполняются операции Коэна и Политано–Лидбеттера. Уретероцистоанастомоз по Коэну выполняется через разрез передней стенки мочевого пузыря и основан на принципе удлинения внутрипузырной части мочеточника путем его реимплантации во вновь сформированный подслизистый тоннель. Специфичными осложнениями данного способа являются кровотечение из мочепузырного треугольника (Льето) и юкставезикального отдела мочеточника, развитие послеоперационного цистита. Послеоперационное кровотечение из треугольника Льето связано с формированием подслизистого тоннеля в наиболее кровоснабжаемой зоне мочевого пузыря, что обусловлено анатомическими особенностями. Послеоперационное кровотечение из юкставезикального отдела мочеточника возникает вследствие разрыва регионарных артериальных и венозных сплетений во время его слепой тракции для проведения через подслизистый тоннель. Оба варианта кровотечений требуют повторной ревизии операционной раны, гемостаза и ухудшают результат реконструктивно-пластической операции. Из-за чреспузырного доступа, особенностями и слабыми сторонами уретероцистоанастомоза по Коэну являются пересечение всех слоев стенки мочевого пузыря с развитием рубца, препятствующего нормальной сократительной способности пузыря; невозможность расправления перегибов расширенного мочеточника и выполнения его моделирования перед реимплантацией, необходимость в которых возникает при IV и V степенях ПМР (на долю IV и V степеней приходится до 60% среди всех оперативных вмешательств).
В основе принципа уретероцистоанастомоза по Политано–Лидбеттеру лежит создание подслизистого тоннеля мочевого пузыря. Особенностью техники является широкое вскрытие мочевого пузыря и рассечение слизистой оболочки мочевого пузыря в трех местах для создания тоннеля, при этом отсечение мочеточника производится с внешней стороны мочевого пузыря, так как данный способ предполагает резекцию расширенного мочеточника. Специфичными осложнениями операции по Политано-Лидбеттеру являются развитие рубца в месте вскрытия пузыря; развитие ангуляции предпузырного отдела мочеточника из-за использования техники анастомозирования и образование стриктур пузырно-мочеточникового анастомоза, не поддающихся эндоскопической коррекции. Характерным рентгенологическим симптомом ангуляции мочеточника является его трансформация в виде рыболовного крючка. На практике это значительно снижает возможность катетеризации почки при возникающей необходимости (например, при мочекаменной болезни). Применение столь травматичного способа уретероцистоанастомоза при отсутствии расширения мочеточника ограничено или неоправданно.
Экстравезикальный способ уретероцистоанастомоза является максимально эффективным оперативным вмешательством у детей с ПМР (98%). В задачи уретероцистоанастомоза входит создание надежного клапанного механизма ПМС, формирование адекватного просвета мочеточника, не препятствующего свободному пассажу мочи. Экстравезикальная методика уретероцистоанастомоза в полной мере отвечает предъявляемым требованиям. Использование экстравезикальной методики позволяет избежать вскрытия мочевого пузыря (широкого рассечения детрузора) и в то же время дает возможность сформировать подслизистый тоннель на любом участке стенки мочевого пузыря, выбрав бессосудистую зону. Длина тоннеля также может быть выбрана хирургом произвольно.
Появление новых эффективных препаратов при фармакологическом консервативном лечении ПМР у детей, с одной стороны, и внедрение в практическую медицину новых оперативных способов лечения, включая лапароскопическую хирургию, робототехнику — с другой, безусловно, в будущем изменит значение обычных открытых способов коррекции ПМР. Но сегодня в стратегии лечения ПМР открытые оперативные вмешательства играют ключевую роль, так как они позволяют ликвидировать самые сложные формы ПМР.
В заключение хотелось бы подчеркнуть, что выбор метода коррекции ПМР должен быть строго индивидуальным и основываться на объективном анализе врачом данных обследования и оценке возможности применения всех имеющихся способов устранения ПМР у данного конкретного больного.
Литература
А. Ю. Павлов, доктор медицинских наук
С. А. Маслов
Н. В. Поляков, кандидат медицинских наук
А. А. Лисенок, кандидат медицинских наук
Г. В. Симонян
НИИ урологии, Москва
Стриктура мочеточника
Стриктура мочеточника – это патологическое состояние частичного или полного сужения просвета мочеточника, приводящее к нарушению оттока мочи.
Анатомия
Мочеточник – это парный мочевыводящий орган, представляющий собой тонкую длинную трубку (две), соединяющую лоханку почки и мочевой пузырь. Мочеточник имеет три анатомических сужения, которые, при необходимости, благополучно расширяются благодаря эластичной стенке.
Но при стриктуре развиваются фиброзные изменения, по причине которых мышечные ткани стенки мочеточника замещаются на рубцовую ткань, которая не может расширяться и в месте сужения фиксируется уменьшение диаметра выводного протока. По этой причине над местом сужения моча собирается и застаивается, что приводит к растяжению мочеточника и появлению сопутствующих проблем с почками (расширение лоханки, гидронефроз и др.)
Участок стриктуры может быть коротким или длинным, может появляться в разных отделах мочеточника, но, как правило, «привычным» местом локализации стеноза является:
Осложнения стриктуры мочеточника
Поскольку при сужении мочеточник теряет свои функциональные свойства по причине стойкого уменьшения диаметра, развиваются различные патологические состояния:
Все эти факторы могут привести к серьезным осложнениям:
Причины развития стеноза мочеточника
Стриктура мочеточника может быть истинной (паталогические изменения стенки) и ложной (при сдавливании стенок мочеточника извне, например, опухолевыми образованиями).
Основные причины развития заболевания подразделяются на врожденные и приобретенные.
Врожденные причины – наследственные аномалии, с которыми человек родился:
Приобретенные причины – различные заболевания и поражающие воздействия:
Также стеноз мочеточника может быть односторонним и двусторонним, а также одиночным и многочисленным.
Симптомы стриктуры мочеточника
Чаще всего развивается односторонний процесс, который дает не такие яркие симптомы, как стеноз двусторонний. Как правило, заболевание имеет признаки, характерные для большинства заболеваний мочевыделительной системы:
Также могут проявляться интоксикационные симптомы: температура, озноб, слабость, мышечные судороги, тошнота, рвота.
Диагностика стриктуры мочеточника
Диагностика заболевания требует комплексного подхода и включает в себя, кроме осмотра и сбора анамнеза, следующие диагностические мероприятия:
Лечение стриктуры мочеточника
От стриктуры мочеточника можно избавиться только хирургическим путем – консервативное лечение, а тем более народные методы абсолютно неэффективны.
Выбор метода оперативного вмешательства зависит от общего состояния мочеточника и почек, количества и протяженности стриктур, стадии патологического процесса.
Профилактика стриктуры мочеточника
Процесс сужения мочеточника достаточно длительный, поэтому необходимо знать основные причины возникновения заболевания и по возможности стараться их избегать или быстро корректировать.