что такое интрамуральная нервная система
Что такое интрамуральная нервная система
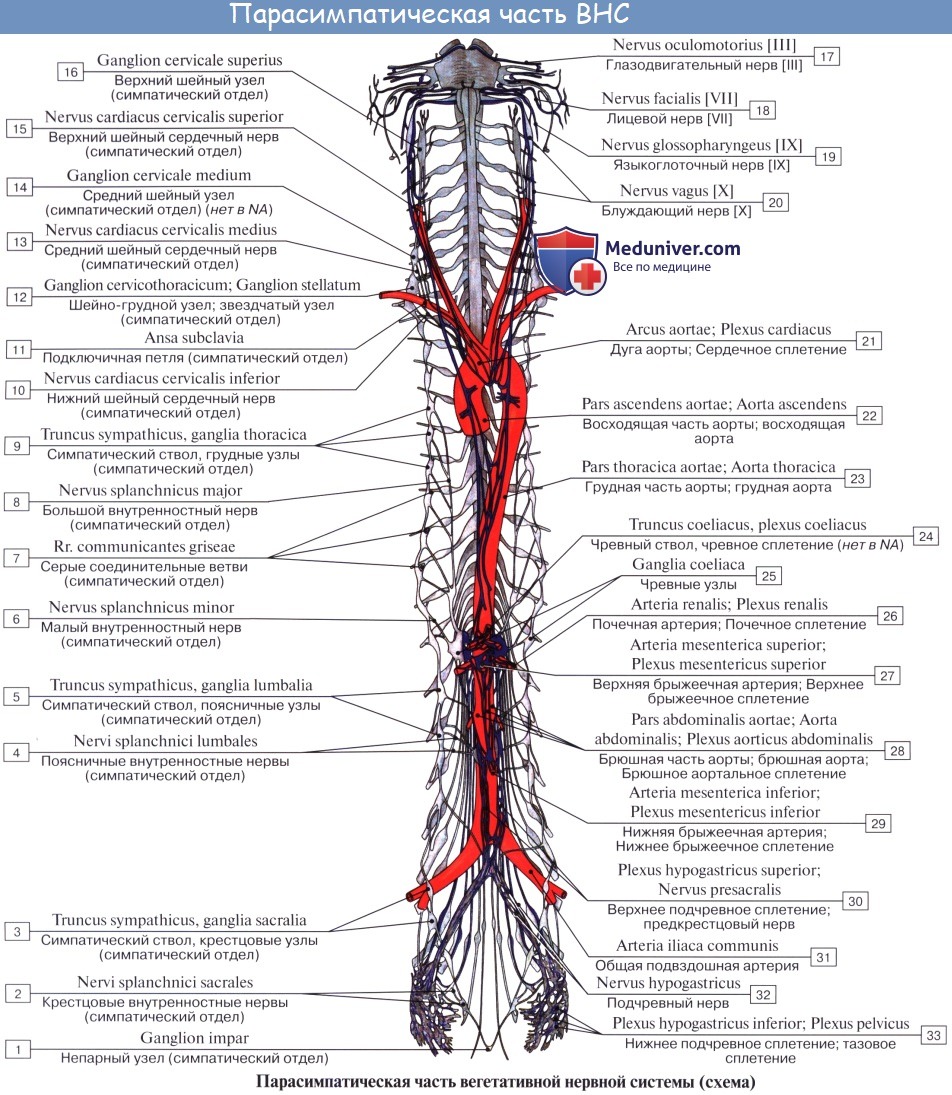
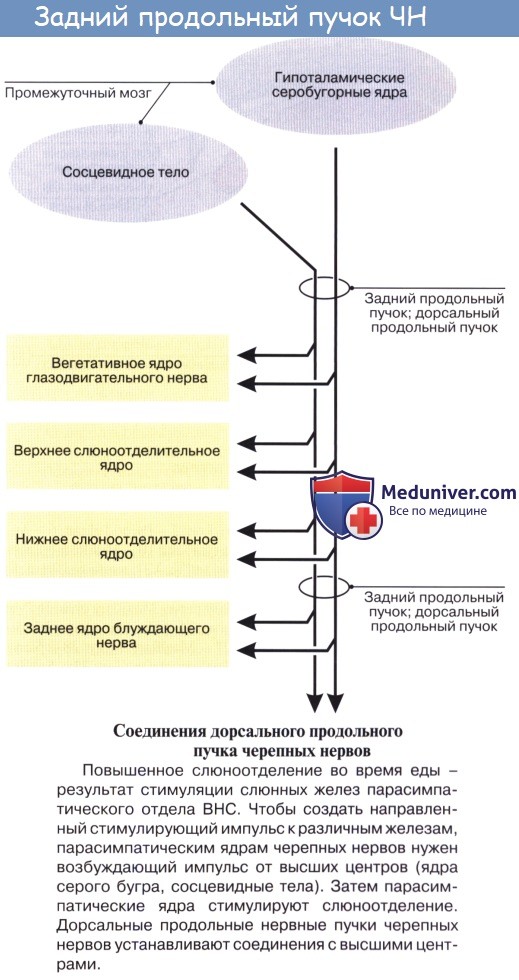
Парасимпатическая часть исторически развивается как надсегментарный отдел, и поэтому центры ее располагаются не только в спинном мозге, но и в головном.
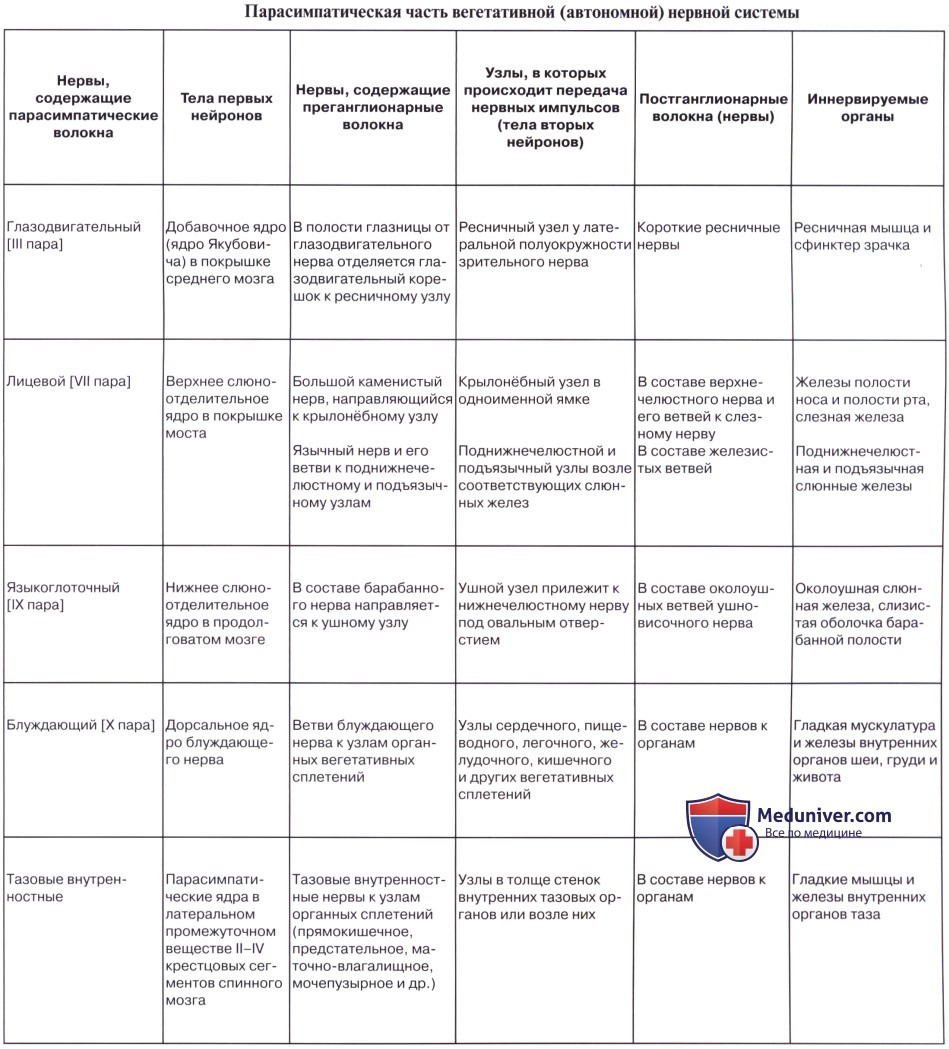
Центры парасимпатической части
Центральная часть парасимпатического отдела состоит из головного, или краниального, отдела и спинномозгового, или сакрального, отдела.
Краниальный отдел в свою очередь состоит из центров, заложенных в среднем мозге (мезэнцефалическая часть), и в ромбовидном мозге — в мосту и продолговатом мозге (бульбарная часть).
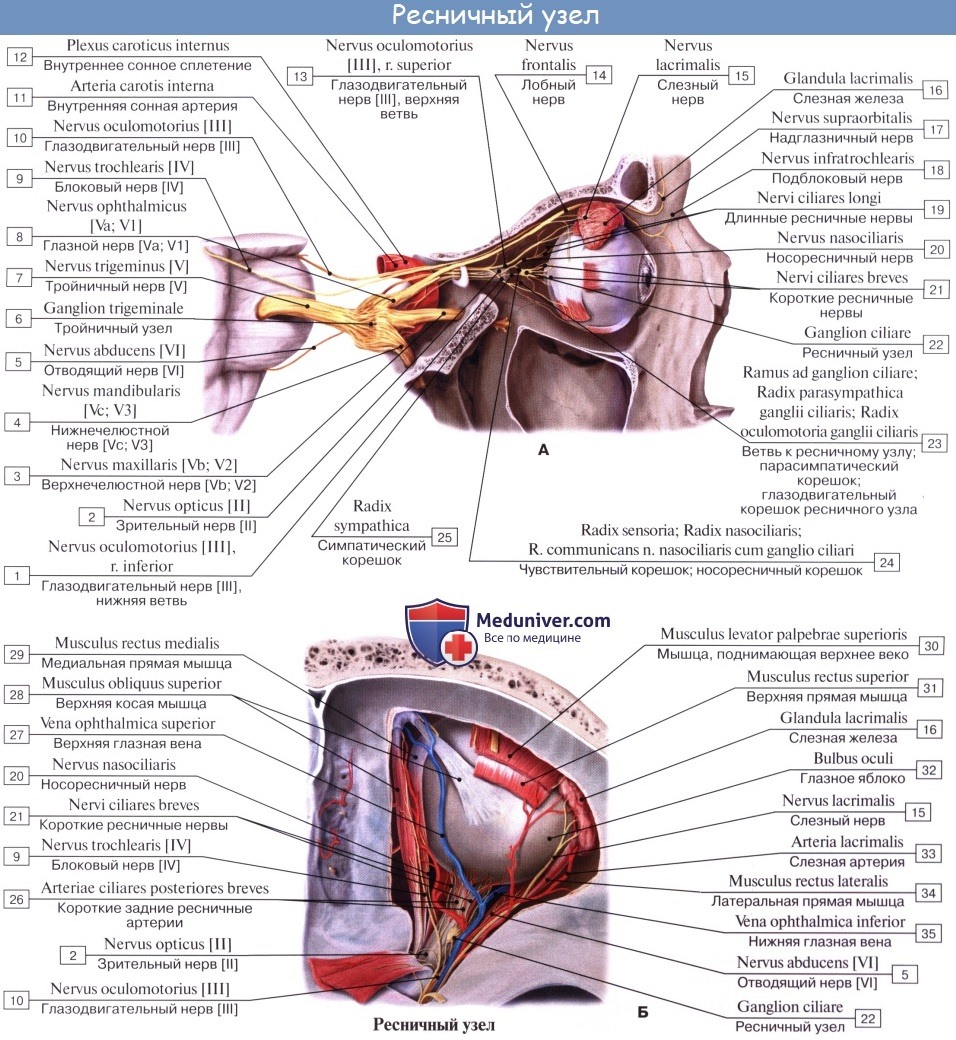
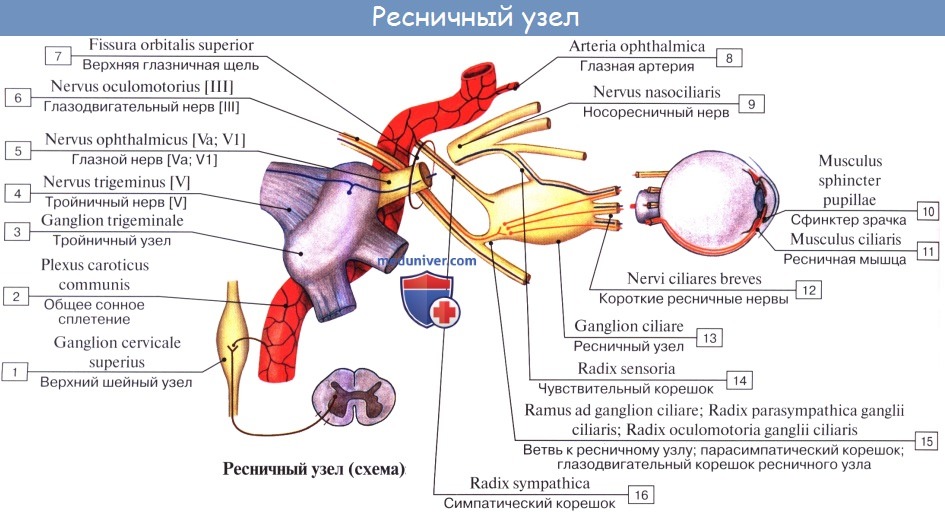
1. Мезэнцефалическая часть представлена nucleus accessorius n. oculomotorii и срединным непарным ядром, за счет которых иннервируется мускулатура глаза — m. sphincter pupillae и m. ciliaris.
2. Бульварная часть представлена nucleus saliva tonus superior n. facialis (точнее, n. intermedius), nucleus salivatorius inferior n. glossopharyngei и nucleus dorsalis n. vagi (см. соответствующие нервы).
Сакральный отдел. Парасимпатические центры лежат в спинном мозге, в substantia itermedialateralis бокового рога на уровне II — IV крестцовых сегментов.
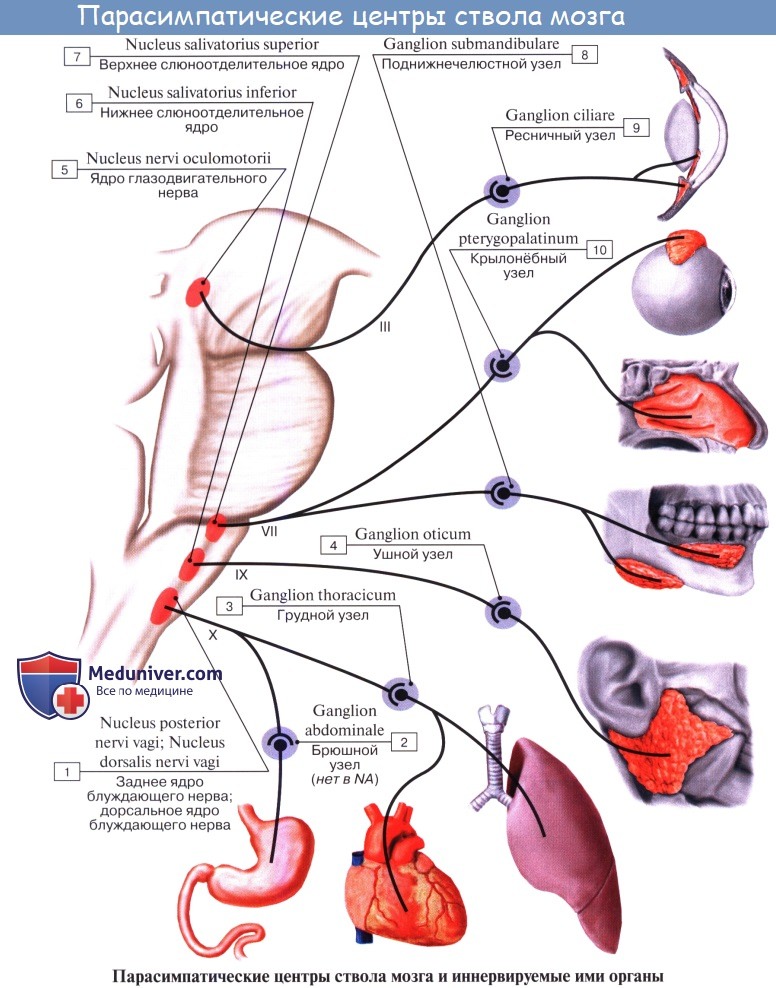

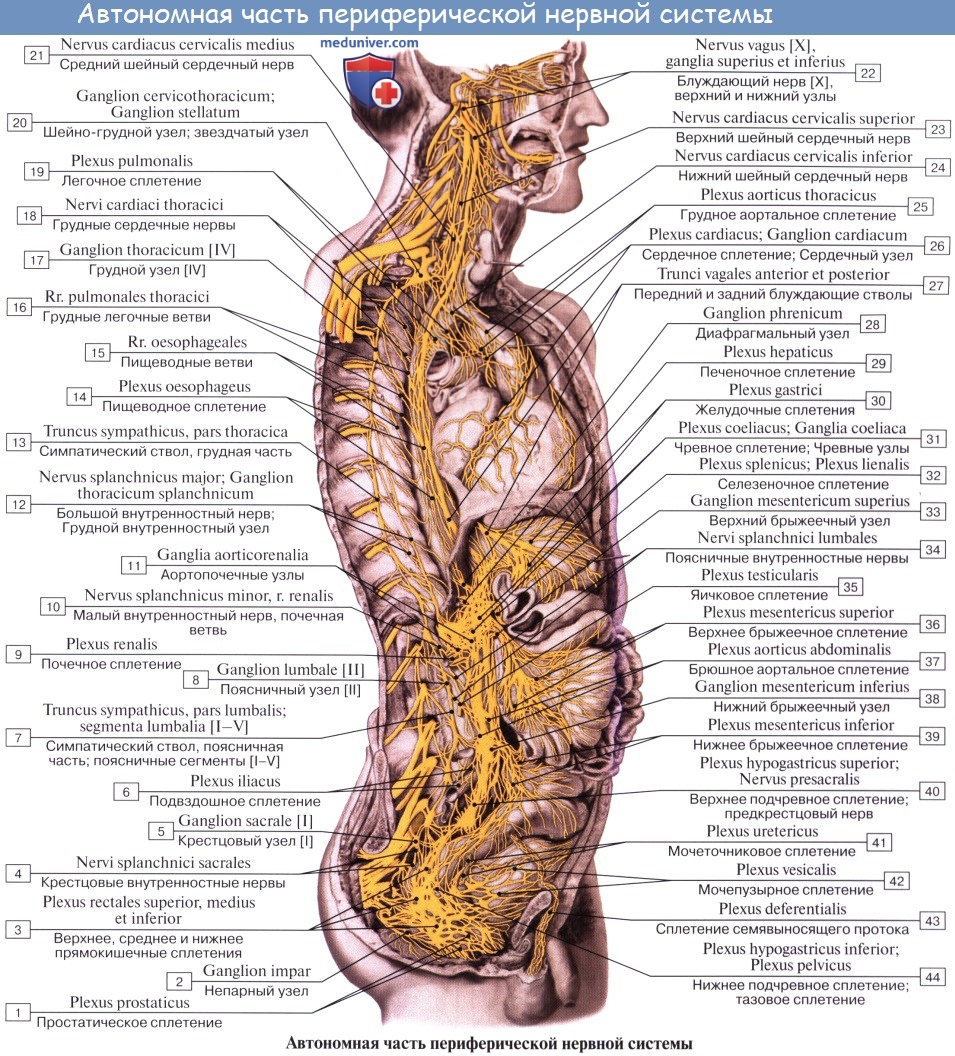
Периферический отдел парасимпатической нервной системы.
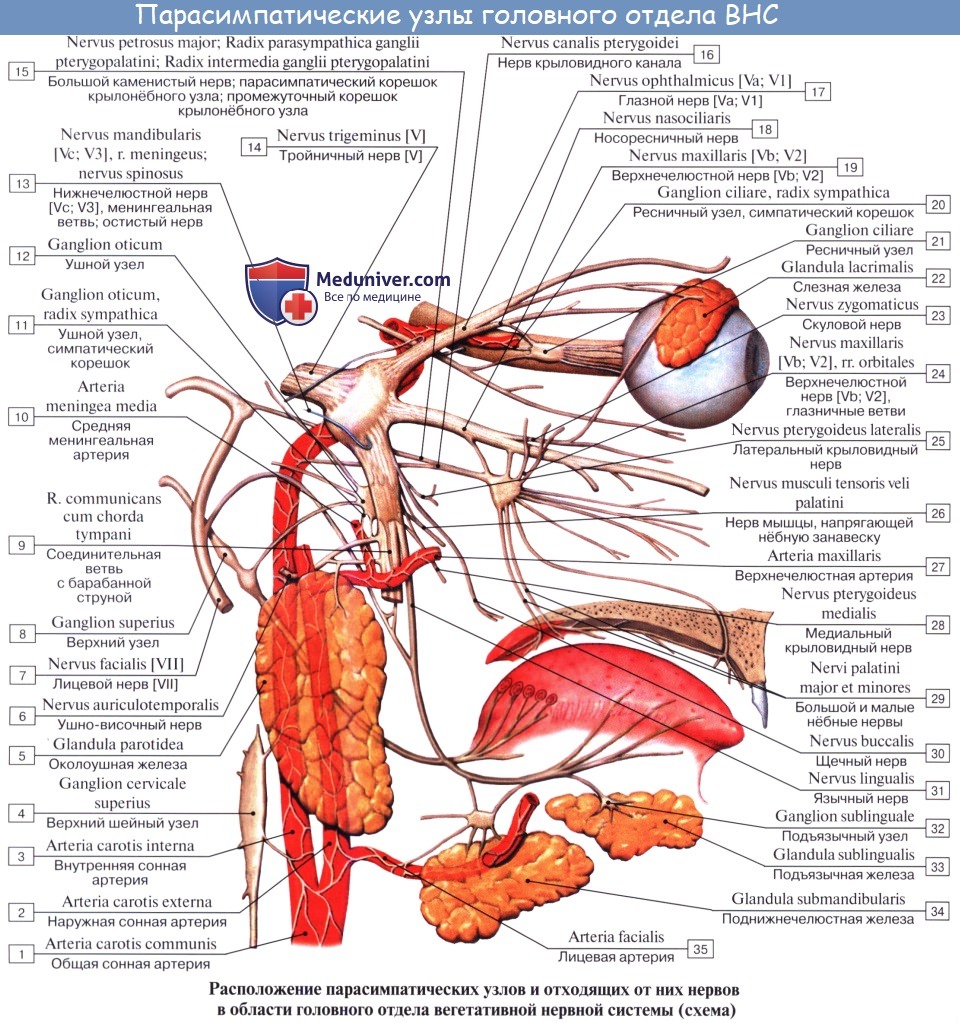
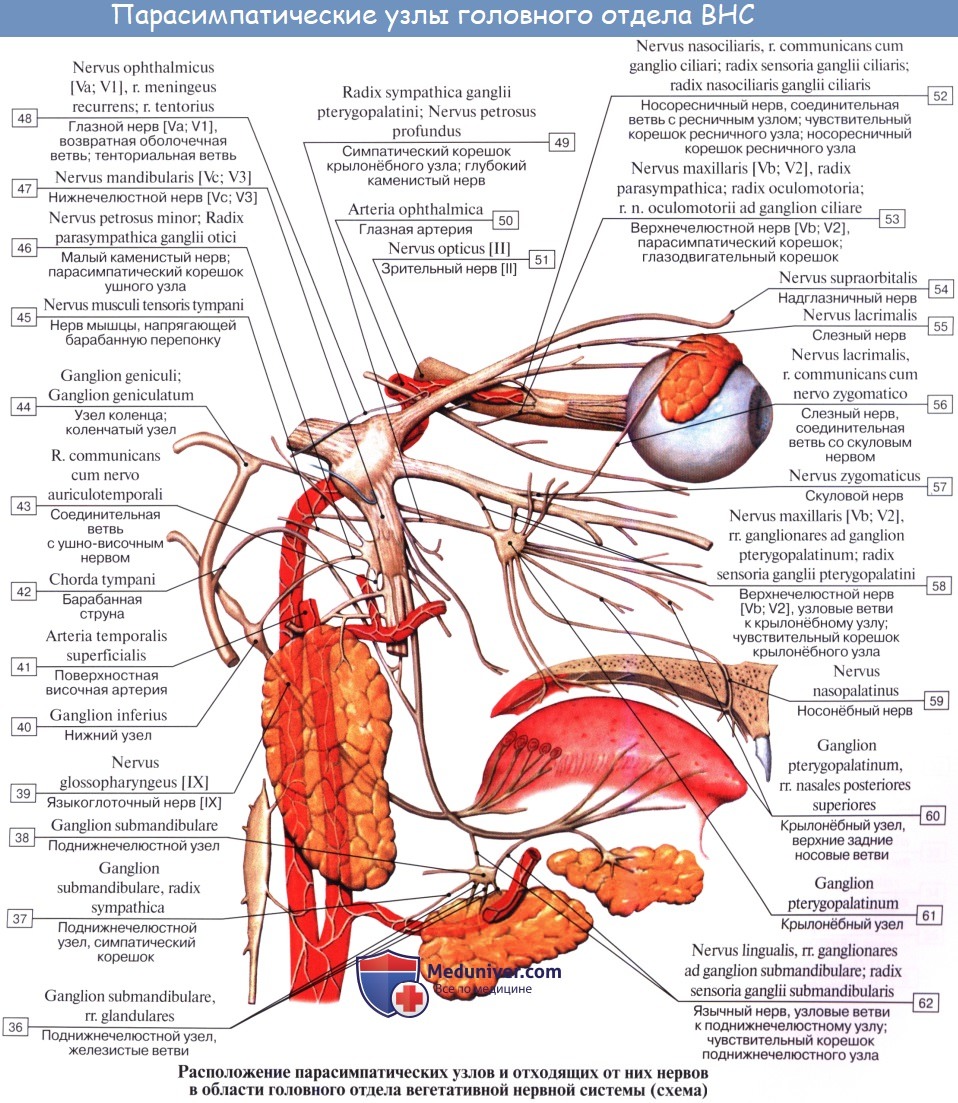
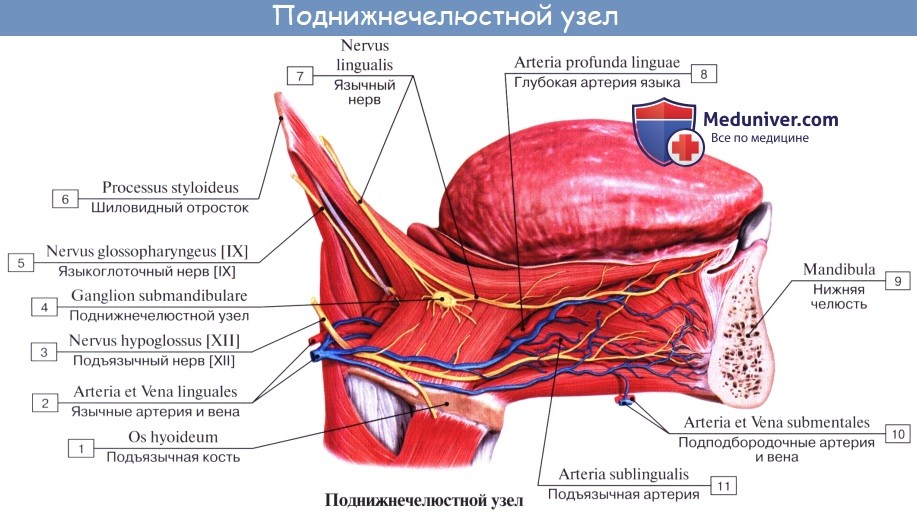
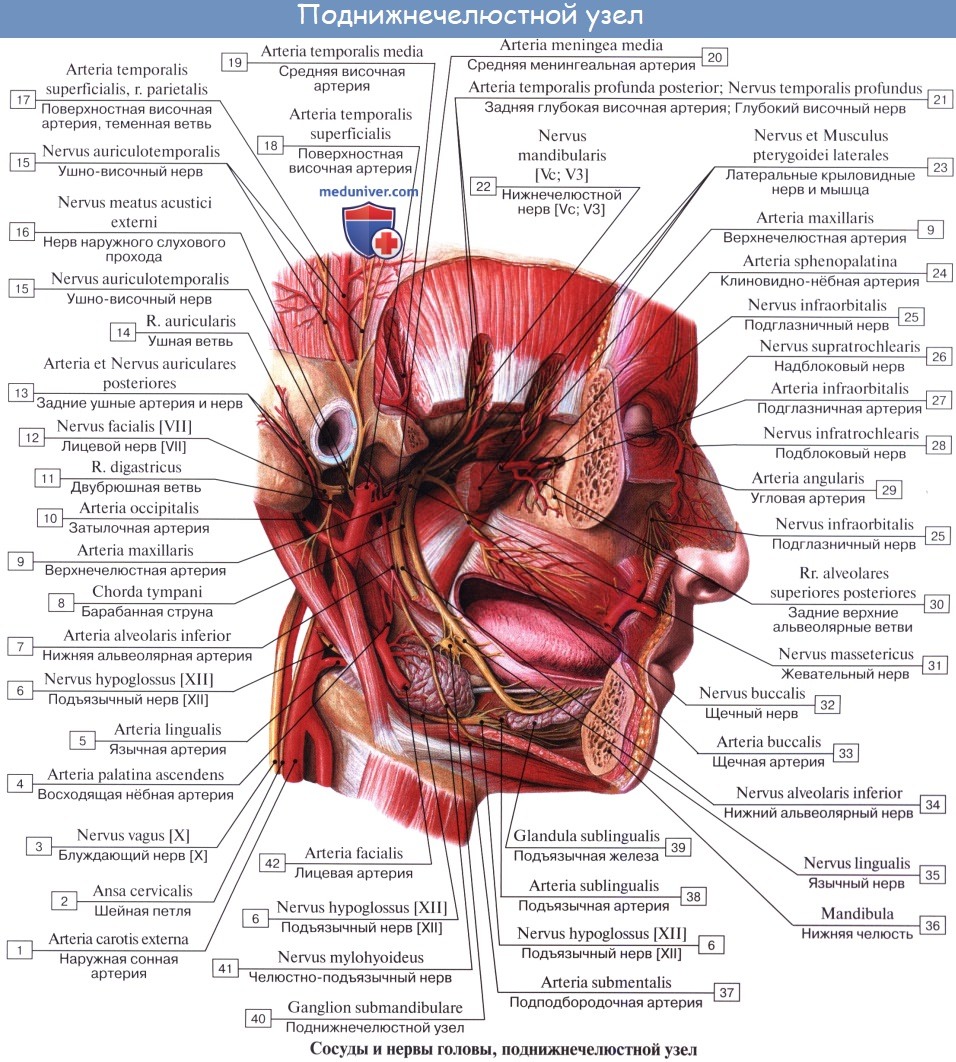
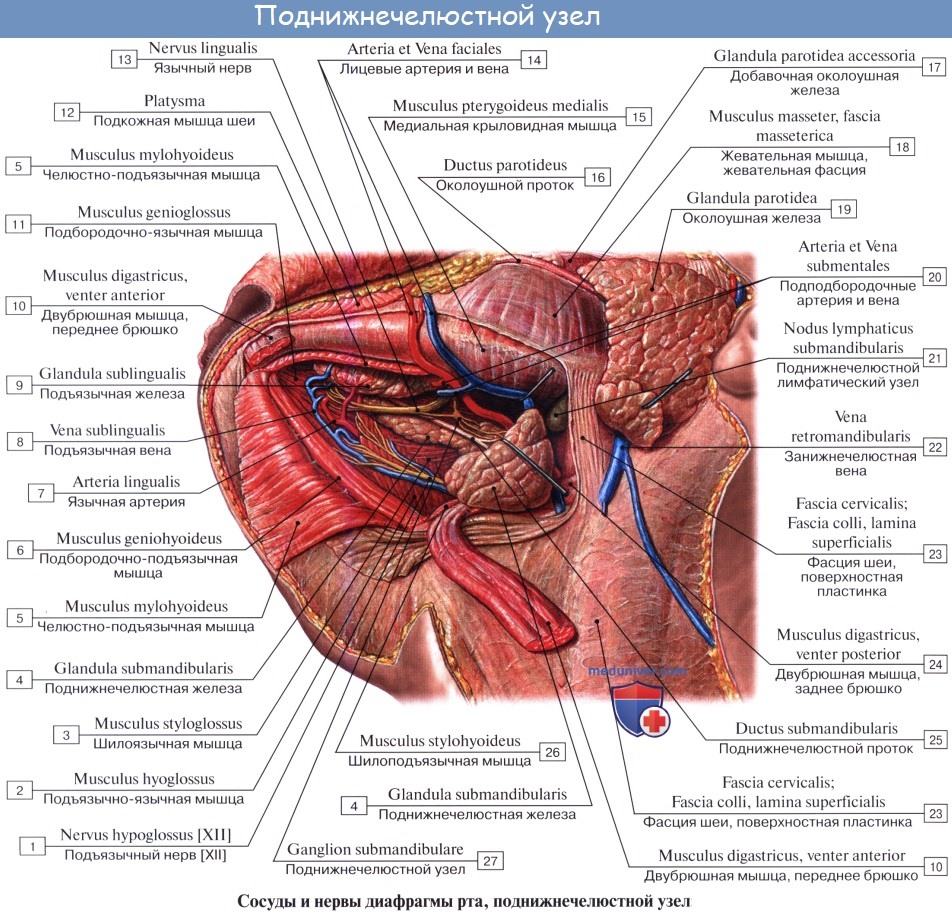
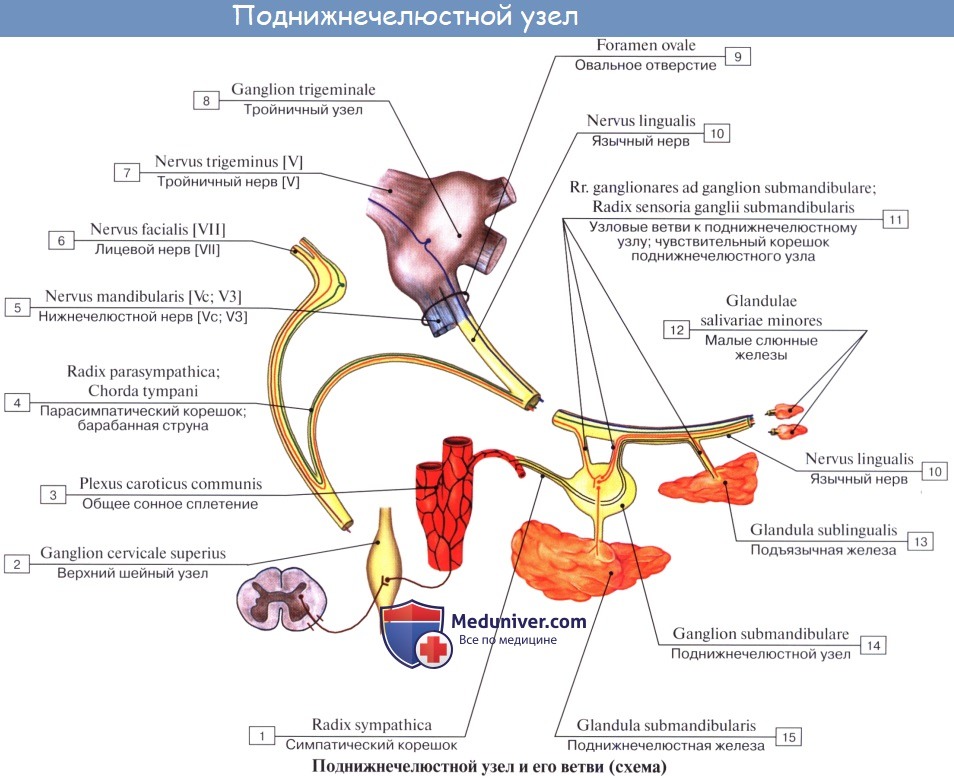
Периферическая часть краниального отдела парасимпатической системы представлена: 1) преганглионарными волокнами, идущими в составе III, VII, IX и X пар черепных нервов (возможно, и в составе I и XI); 2) терминальными узлами, расположенными вблизи органов, а именно: ganglia ciliare, pterygopalatinum, submandibulare, oticum, и З) постганглионарными волокнами; постганглионарные волокна имеют или самостоятельный ход, как, например, nn. ciliares breves, отходящие от ganglion ciliare, или идут в составе каких-либо нервов, как, например, постганглионарные волокна, отходящие от ganglion oticum и идущие в составе n. auriculotemporalis. Некоторые авторы указывают, что парасимпатические волокна выходят также и из других сегментов спинного мозга и идут через передние корешки, направляясь к стенкам туловища и конечностей.
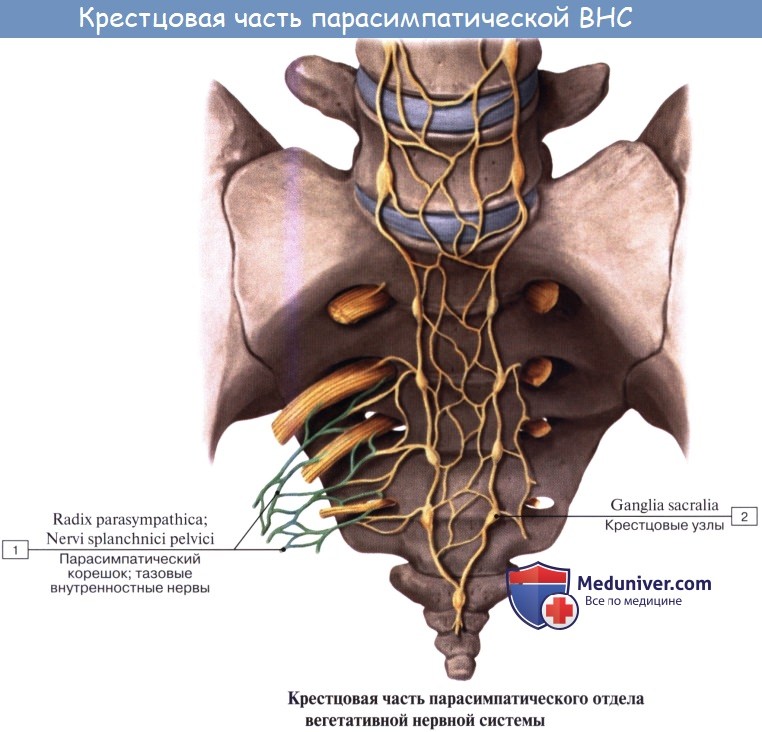
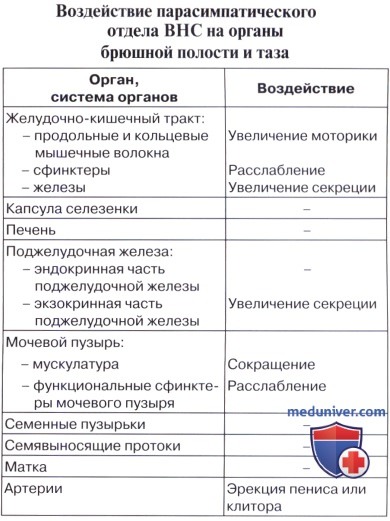
Периферическая часть сакрального отдела парасимпатической системы представлена волокнами, которые в составе передних корешков II —IV крестцовых нервов и далее в составе их передних ветвей, образующих plexus sacralis (анимальное сплетение), входят в малый таз. Здесь они отделяются от сплетения и в виде nn. splanchnici pelvini направляются к plexus hypogastricus inferior, иннервируя вместе с последним тазовые внутренности: прямую кишку с colon sigmoideum, мочевой пузырь, наружные и внутренние половые органы. Раздражение nn. splanchnici pelvini вызывает сокращение прямой кишки и мочевого пузыря (m. detrusor vesicae) с ослаблением их сфинктеров. Волокна симпатического подчревного сплетения задерживают опорожнение этих органов; они же возбуждают сокращение матки, тогда как nn. splanchnici pelvini его тормозят. Nn. splanchnici pelvini содержат в себе еще сосудорасширяющие волокна (nn. erigentes) для corpora cavernosa penis et clitoridis, обусловливающие эрекцию.
Парасимпатические волокна, отходящие от сакрального отдела спинного мозга, идут в тазовые сплетения не только в составе nn. erigentes и nn. splanchnici pelvini, но и в составе nervus pudendus (преганглионарные волокна). Половой нерв является сложным нервом, содержащим в своем составе, кроме анимальных волокон, также и вегетативные (симпатические и парасимпатические), входящие в нижнее подчревное сплетение.
Симпатические волокна, отходящие от узлов крестцового отдела симпатического ствола в качестве постганглионарных, присоединяются к половому нерву в «полости малого таза и проходят через нижнее подчревное сплетение к тазовым органам.
К парасимпатической нервной системе относится также так называемая интрамуральная нервная система.
В стенках ряда полостных органов находятся нервные сплетения, содержащие мелкие узлы (терминальные) с ганглиозными клетками и безмиелиновыми волокнами, — ганглиозно-сетевидная, или интрамуральная, система.
Интрамуральная система особенно выражена в пищеварительном тракте, где она представлена несколькими сплетениями.
1. Мышечно-кишечное сплетение, plexus mysentericus — между продольной и кольцевой мускулатурой пищеварительной трубки.
2. Подслизистое сплетение, plexus submucosus, находящееся в подслизистой основе. Последнее переходит в сплетение желез и ворсинок.
К периферии от названных сплетений располагается диффузная нервная сеть. К сплетениям подходят нервные волокна от симпатической и парасимпатической систем. В интрамуральных сплетениях происходит переключение предузловых волокон парасимпатической системы на послеузловые.
Итрамуральные сплетения, как и экстраорганные сплетения полостей туловища, являются по своему составу смешанными. В последнее время в интрамуральных сплетениях пищеварительного тракта обнаружены и клетки симпатической природы.
Резюме
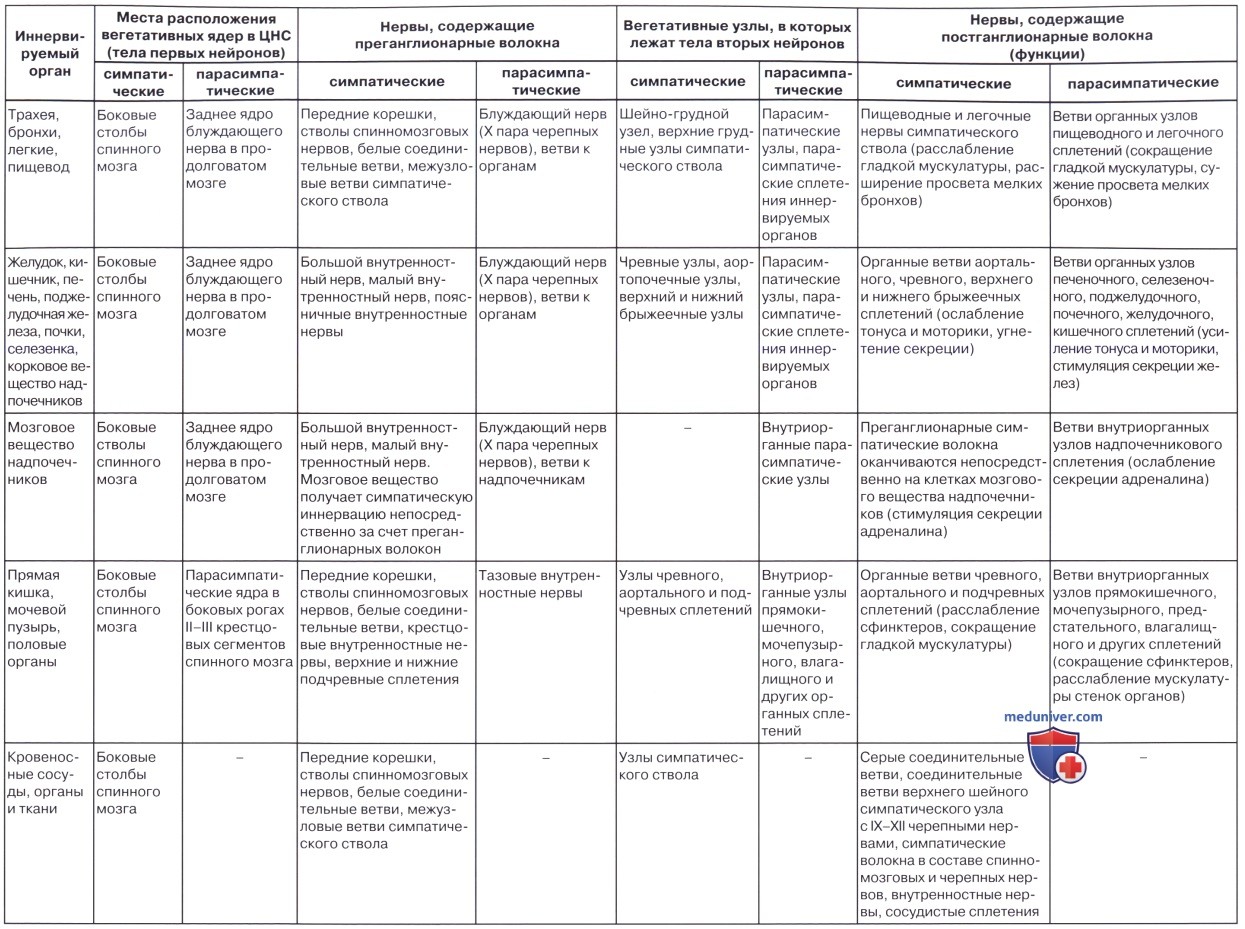
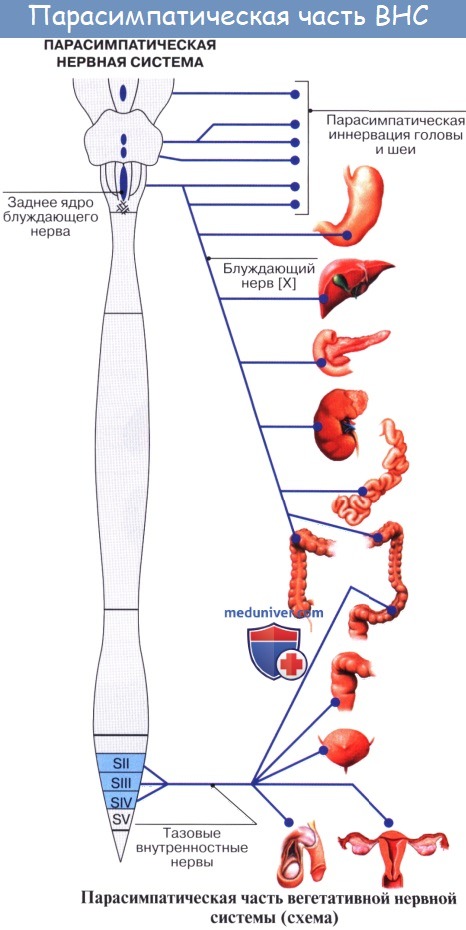
Центры парасимпатической части вегетативной нервной системы расположены в стволе головного мозга (вегетативные ядра III, VII, IX и X черепных нервов) и в крестцовых сегментах (SII-SIV) спинного мозга, где залегают парасимпатические ядра.
Преганглионарные волокна выносящего (эфферентного) пути парасимпатической части заканчиваются в вегетативных узлах, расположенных возле внутренних органов или в толще этих органов. В этих парасимпатических узлах залегают тела клеток вторых эфферентных парасимпатических нейронов. Аксоны вторых нейронов идут к рабочим внутренним органам, расположенным в области головы, шеи, в грудной и брюшной полостях и в полости таза.
• Черепная часть. Преганглионарный нейрон находится в дорзальном ядре блуждающего нерва в продолговатом мозге. Аксоны (преганглионарные нервные волокна) идут вместе с блуждающим нервом к висцеральным или внутристеночным узлам, где они образуют синапсы с постганглионарным нейроном. Парасимпатические волокна блуждающего нерва иннервируют желудок, печень, желчный пузырь, поджелудочную железу, двенадцатиперстную кишку, почки, надпочечники, тонкую и толстую кишку до сигмовидной ободочной кишки.
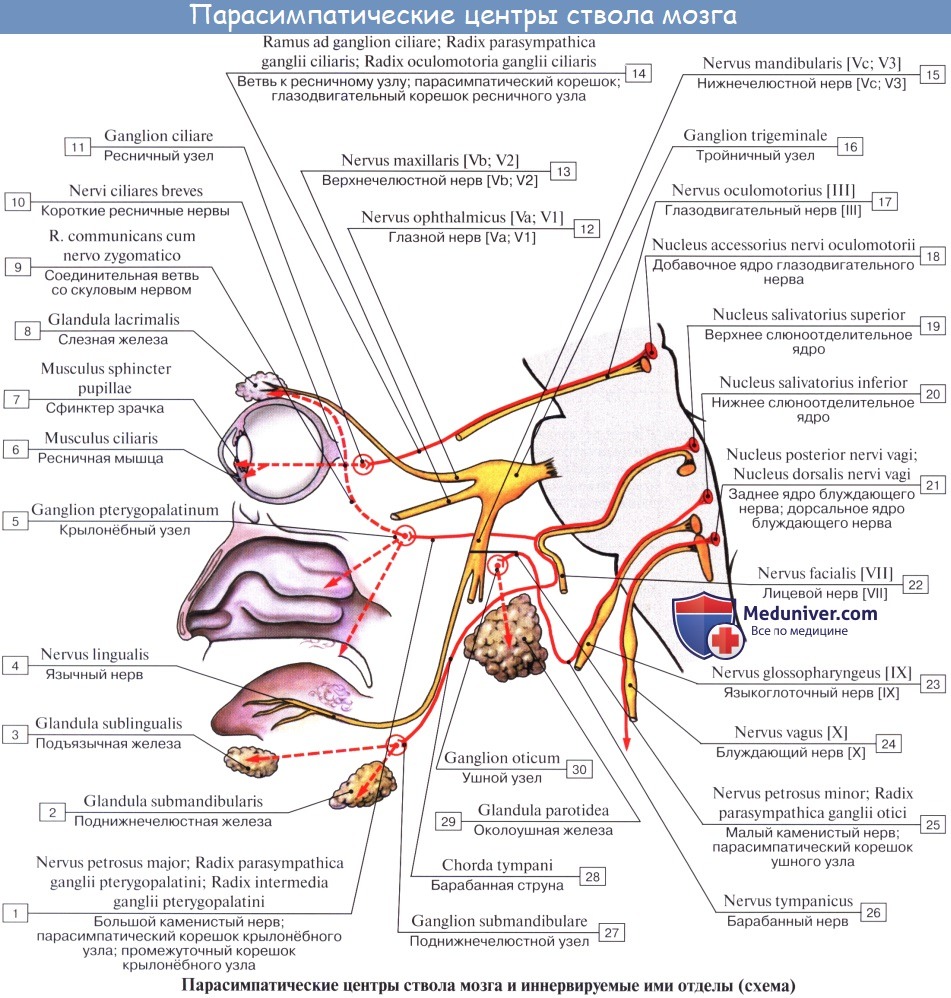
а) Парасимпатический отдел BHC (черепная часть). Четыре из двенадцати черепных нервов имеют вегетативные (парасимпатические) ядра:
• вегетативное ядро (Эдингера-Вестфаля) глазодвигательного нерва [CN III];
• верхнее слюноотделительное ядро лицевого нерва [CN VII];
• нижнее слюноотделительное ядро языкоглоточного нерва [CN IX];
• дорсальное ядро блуждающего нерва (CN X).
б) Парасимпатический отдел вегетативной нервной системы (пояснично-крестцовая часть). Эфферентные волокна выходят из переднего крестцового отверстия в вентральных корнях сегментов SII-SIV. Волокна собираются в пучки и формируют тазовые внутренностные нервы, объединяясь с симпатическими волокнами.
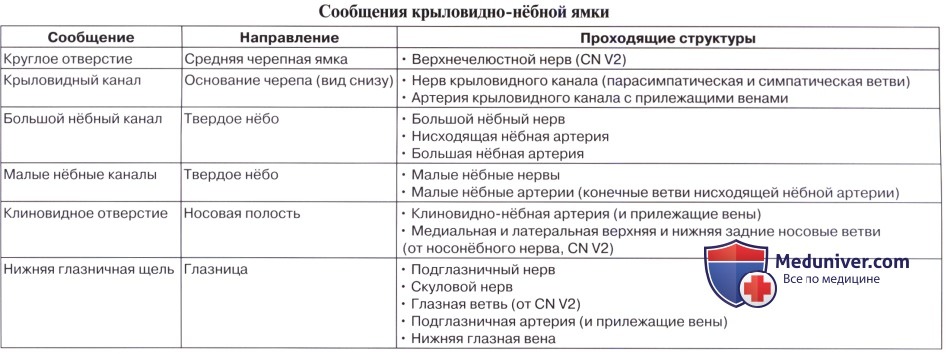
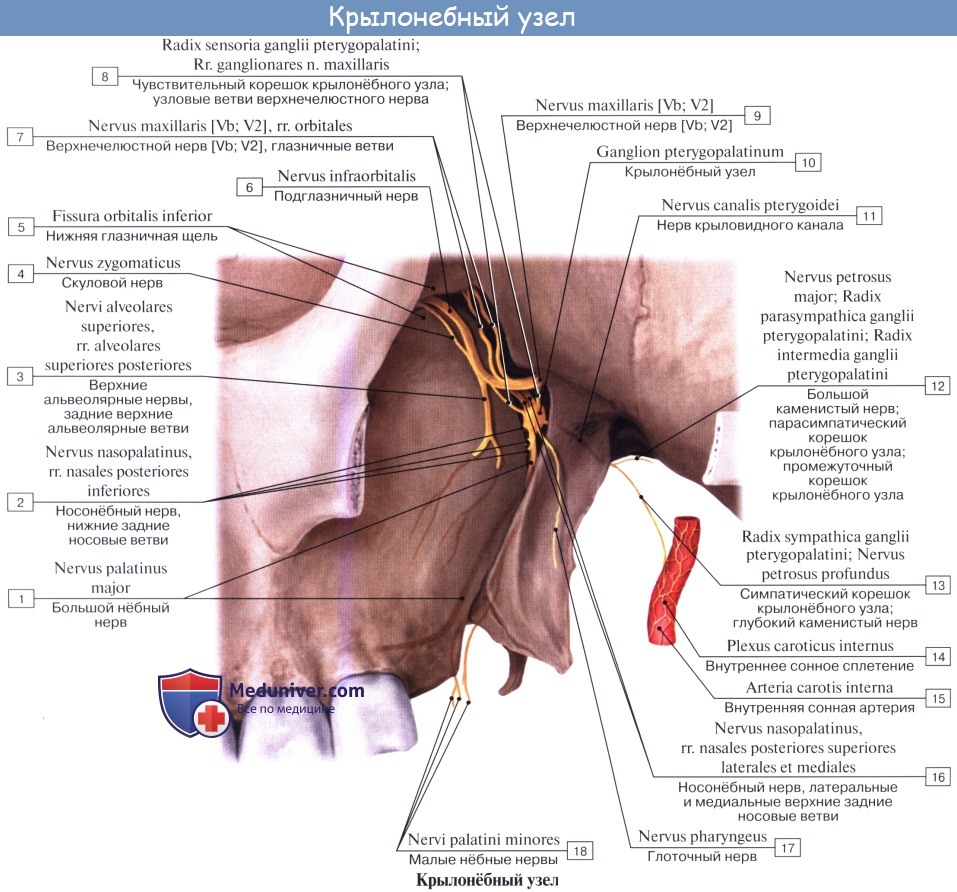
в) Распространение нервов из крыловидно-нёбной ямки. Верхнечелюстной нерв идет из средней черепной ямки через круглое отверстие в крыловидно-нёбную ямку. Близко к верхнечелюстному нерву расположен парасимпатический крылонёбный узел, где предузловые волокна образуют синапсы с клетками узла, которые, в свою очередь, иннервируют слезные, малые носовые и нёбные железы. Крылонёбный узел получает преганглионарные волокна из большего каменистого нерва, который является ветвью лицевого нерва. Симпатические волокна глубокого каменистого нерва, как и чувствительные волокна верхнечелюстного нерва, проходят через этот узел, не образуя синапсов.
Учебное видео анатомии вегетативной нервной системы (ВНС)
Редактор: Искандер Милевски. Дата последнего обновления публикации: 27.8.2020
«САЙТ НАХОДИТСЯ НА РЕКОНСТРУКЦИИ ПРИНОСИМ СВОИ ИЗВИНЕНИЯ ЗА ВРЕМЕННЫЕ НЕУДОБСТВА»
Государственный Научный
Центр Колопроктологии
Ассоциация Колопроктологов
России
Справочник:
Контакты
Адрес:
123423, Москва,
ул. Саляма Адиля 2
Телефон для записи на прием к врачу поликлиники:
8 (499) 642-54-40
с 9:00 до 20:00
Телефон для записи на амбулаторные исследования (регистратура):
8 (499) 199-84-62
пн.-пт. с 9.00 до 16.00
Лечение анальной трещины инновационными малоинвазивными методами (ботулотоксин и т.д.). Телефон для записи на прием к к.м.н
Жаркову Е.Е.:
Телефон для записи онкологических больных на платную консультацию к проф. Е.Г Рыбакову и д.м.н. С.В. Чернышову:
Ведущие специалисты в стране в лечении полипоза (предраковое заболевание), пресакральных тератом малого таза.
Проф. д.м.н. Кузьминов А. М.
Вышегородцев Д. В.
Послеродовые деформации промежности, ректоцел, недержание, HAL/RAR c УЗИ навигацией.
д.м.н. Титов А.Ю.
Ректовагинальные свищи
к.м.н. Мудров А.А.
Лазерные технологии: Геморрой, прямокишечные свищи. Костарев И.В.
Лечение метастатического поражения печени при колоректальном раке.
д.м.н. Пономаренко А.А.
Схема проезда:
Аномалии толстой кишки.
Под аномалиями понимают отклонения от структуры и/ или функции, присущей данному биологическому виду, возникшее вследствие нарушения развития организма.
Причинами приводящие к развитию аномалий, является воздействие на плод время беременности и эмбриогенеза неблагоприятных факторов внешней среды, инфекций, химических веществ, лекарственных средств. Такими факторами являются повышенный уровень радиоактивного излучения, гиперинсоляция, гипертермия, продукты химического производства, краснуха, цитостатики.
Нарушения развития толстой кишки в период эмбриогенеза могут затрагивать все процессы ее формирования.
В связи с этим, по классификации Г.И.Воробъева и соавт ( 1989), выделяют:
Более чем в 80% случаев отмечается сочетание различных видов аномалий.
По происхождению различают аномалии развития и положения толстой кишки:
I. Врожденное нарушение роста ободочной кишки. Если на этапе развития эмбриона рост кишечной стенки в результате каких- либо причин останавливается, то возникает врожденное укорочение или отсутствие какого-либо отдела ободочной кишки. Как правило, такая аномалия сочетается с другими, прежде всего ротационными.
Формирование ободочной кишки необычно большой длины за счет избыточного роста носит название долихоколон. Наиболее часто удлинение отмечается в сигмовидной кишке. В таких случаях говорят о долихосигме.
II. Положение и подвижность ободочной кишки определяется такими факторами, как отношение ее к брюшинным покровам, длина и форма брыжейки, наличие фиксирующих связок и спаек в брюшной полости. Наиболее часто встречающимися и имеющие клиническое значение, нарушения фиксации ободочной кишки являются правосторонний и левосторонний колоптоз, тотальный колоптоз, патологическая подвижность правых отделов ободочной кишки. Наибольшее клиническое значение имеет патологическая подвижность правых отделов ободочной кишки. Это состояние предрасполагает к завороту слепой кишки, илеоцекальной инвагинации, развитию болевого синдрома. Ненормальная подвижность правой половины толстой кишки, обусловленная наличием общей брыжейки. Подвижная правая половина толстой кишки у ряда людей может ничем не проявляться на протяжении всей жизни. Поэтому в анатомическом понимании этот вид нарушения фиксации правой половины толстой кишки дает клиническое проявление и становится источником тяжелых осложнений, следует рассматривать как самостоятельное заболевание. Основными симптомами является боль в животе, локализующаяся, как правило, в правой подвздошной области. Боль чаще постоянная, тупого характера, иногда приступообразная, нередко иррадирует в крестец, спину и нижнюю конечность. Стойкий хронический запор также является частым симптомом этого страдания, что, по- видимому, связано с вторичными изменениями моторики правой половины ободочной кишки. Характерным примером заболевания является метеоризм, сопровождающийся иногда шумом плеска в правой подвздошной области.
III. Ротационные аномалии. Если рост кишечной трубки в процессе эмбриогенеза проходил нормально, но были нарушены поворот ее и фиксация к задней стенке живота на одном из этапов, то такое патологическое состояние приводит к возникновению ротационных аномалий. Отсутствие ротации является редким, сочетающимся с тяжелыми аномалиями других органов и поэтому несовместимым с жизнью плода состоянием. Вот почему больные с отсутствием ротации кишечника во взрослой клинической практике не встречается. При незавершенном повороте, или так называемой неполной ротации, суть аномалии заключается в остановке поворота кишечной трубки на одном из его этапов.
Неполная ротация ( незавершенный поворот кишечника)- основной тип ротационных аномалий, встречающийся у взрослых пациентов.
IV. При нарушении процесса реканализации кишечной трубки может развиться атрезия толстой кишки, что приводит к острой кишечной непроходимости у новорожденного, и поэтому подобные аномалии у взрослых не встречаются. Остальные аномалии, такие как внутрипросветные септы или стриктуры, могут выявляться на протяжении всей жизни человека. Редким состоянием в колопроктологической практике является удвоение толстой кишки, которое чаще всего локализуется в прямой кишке.
V. Эмбриональные тяжи и спайки могут быть представлены различными вариантами, а клинические проявления их будут обусловлены локализацией и выраженностью симптомов нарушения кишечной проходимости.
Диагностика. Наиболее информативным методом диагностики аномалий развития и положения толстой кишки является рентгенологический. Исследование контрастной бариевой клизмой позволяет сразу же определить положение толстой кишки в брюшной полости, ее форму, подвижность при проведении исследования в положении больного стоя и лежа.
Лечение. Если аномалия имеет неосложненный характер течения и в анамнезе заболевания не было упоминания о перенесенных приступах кишечной непроходимости, то такие клинические проявления, как запор и развитие болевого синдрома, требуют проведения консервативных мероприятий. При неэффективности настойчиво проводимых комплексных консервативных мероприятий может предприниматься оперативное вмешательство.
Болезнь Гиршпрунга у взрослых.
Эти изменения состоят, главным образом в отсутствии ганглиев мышечно-кишечного и подслизистого сплетений.
Причиной врожденного недоразвития интрамурального нервного аппарата толстой кишки (аганлиоз) с развитием вторичного мегаколона до конца не ясен. Ведущую роль в механизме развития болезни является мутации 4 генов, также существует теория, согласно которой аганглиоз развивается вследствие нарушения дифференцировки нервных клеток уже достигших кишечной стенки. Влиять на созревание клеток могут различные факторы, такие как гипоксия, воздействие химических агентов, повышенная радиация, вирусная инфекция. Сочетание генетических нарушений с патологическим влиянием факторов внешней и внутренней среды определяет характер поражения не только интрамурального нервного аппарата.
По распространенности аганглионарной зоны выделяют следующие варианты болезни Гиршпрунга:
Характерным для болезни Гиршпрунга является обязательное распространение аганлиоза в дистальном направлении до внутреннего сфинктера. Случаи сегментарного аганлиоза крайне редки.
Клиника. Самым ранним и основным проявлением заболевания является затруднение опорожнения толстой кишки вплоть до полного отсутствия самостоятельного стула.
Возникновение других симптомов ( боль в животе, тошнота, отсутствие апатита, похудание) зависит от продолжительности хронической кишечной непроходимости и мер по ее устранению. Нередко обычные консервативные мероприятия( очистительные клизмы) оказываются неэффективными. Постепенно в расширенных отделах формируются каловые камни, достигающие а отдельных случаях в диаметре 20- 25-30 см. Расширенная, атоничная кишка является местом постоянного скопления газов, поэтому метеоризм – один из самых постоянных симптомов болезни Гиршпрунга и у взрослых. Метеоризм и расширение ободочной кишки постепенно приводят к деформации живота и грудной клетки. Живот значительно увеличен в размере, реберный угол развернут как при эмфиземе легких. При пальпации живота определяется скопление каловых масс, особенно выраженное в левых отделах и сигмовидной кишке. У части больных на фоне длительного отсутствия стула вдруг появляется неудержимый понос, нередко сопровождающийся коллаптоидным состоянием.
Диагностика болезни Гиршпрунга у взрослых основывается на тщательном изучении анамнеза, клинической симптоматики, результатов рентгенологических, и функциональных методов исследования.
Большое значение в диагностике имеет аноректальная манометрия, определяющая состояние ректоанального ингибиторного рефлекса- отсутствие ректоанального рефлекса, что характерно для болезни Гиршпрунга. Ректо-анальный рефлекс при манометрии вызывался путем раздражения прямой кишки баллоном, в котором нагнетался воздух.
Диагностическими критериями болезни Гиршпрунга у взрослых включают в себя:
Достоверный метод диагностики заболевания является выявление аганлионарной зоны в толстой кишке- гистохимическое определение ацетилхолинэстеразы в слизистой оболочке. Он основан на феномене избыточного накопления фермента в слизистой оболочке аганглионарного сегмента толстой кишки. Для проведения исследования при помощи ректоскопа и биопсийных щипцов брались кусочки слизистой оболочки прямой кишки с уровней 5, 10,15 см от анального отверстия.
В сомнительных случаях, при отсутствии характерных жалоб, наличие нечеткой рентгенологической картины, ослабленной реакции внутреннего сфинктера на растяжение прямой кишки, слабоположительной реакции на АХЭ, для более точной диагностики болезни Гиршпрунга и других аномалий развития интрамуральной нервной системы толстой кишки целесообразно применение разработанной в ГНЦК модификации биопсии стенки прямой кишки по Свенсону. Суть техники операции заключается начиная на расстоянии 6 см, проксимальнее зубчатой линии, в дистальном направлении из стенки прямой кишки, захватываются все ее слои, и иссекается полоска тканей длиной 6 см и шириной 1 см. Гистологическое исследование биоптата прямой кишки, включающего в себя зону физиологического гипоганглиоза и вышерасположенный участок с потенциально нормальными нервными сплетениями, позволяет дать более полную и объективную оценку состояния нервного аппарата прямой кишки. При отсутствии ганглиев на всем протяжении исследуемого препарата устанавливается диагноз толстой кишки. Выявление редких отдельных ганглиев, как в дистальной, так и в проксимальной части препарата говорит о гипоганглиозе толстой кишки.
Дифференциальная диагностика болезни Гиршпрунга должна прежде проводиться с другими формами или типами мегаколона.
Лечение. Целью лечения пациентов с болезнью Гиршпрунга является нормализация эвакуации содержимого толстой кишки. Эта цель может достигнута быть только удалением или выключением аганлионарной зоны, если вышележащие отделы толстой кишки не находятся в состоянии декомпенсации.
В течении последних лет, применяются многоэтапное хирургическое лечение. 1 этап резекция сигмовидной кишки по Микуличу, субтотальная резекция толстой кишки включает в себя: колостомия, илеостомия, резекция сигмовидной кишки по Гартману, по Лахею. При достижении компенсации расширенных отделов ободочной кишки, второй этап лечения колеблется от 6 до 1,5 года, выполняют реконструктивно-восстановительные операции, операцию Дюамеля в модификации клиники ГНЦК.
Как кишечные микробы взаимодействуют с кишечной (энтеральной) нервной системой (ЭНС)
Кишечная (энтеральная) нервная система и кишечный микробиом
(A + B) Организация кишечной (энтеральной) нервной системы (ЭНС или англ. ENS). ЭНС имеет ганглиозные сплетения, мышечно-кишечное сплетение между продольным и круговым слоями внешней мускулатуры и подслизистое сплетение, которое имеет наружный и внутренний компоненты. Пучки нервных волокон соединяют ганглии, а также образуют сплетения, которые иннервируют продольную мышцу, круговую мышцу, мышечную слизистую оболочку, внутренние артерии и слизистую оболочку. По материалам: (A) Furness,The Enteric Nervous System (Blackwell, Oxford, 2006); (B) Rao and Gershon, The bowel and beyond: the enteric nervous system in neurological disorders (Nat. Rev. Gastroenterol. Hepatol., 2016).
Как кишечные микробы взаимодействуют с энтеральной (кишечной) нервной системой
Примечание редактора. Разные авторы по-разнома трактуют термин «энтеральная нервная система» (ЭНС), и нередко это название заменяется «кишечной нервной системой». Однако это упрощенный вариант, т.к. речь идет не только о кишечнике (тонком и толстом), но также и о пищеводе с желудком (*нередко включают туда и полые органы мочевыделительной системы). Дадим краткое определение ЭНС:
Резюме:
1. Кишечная (энтеральная) нервная система (ЭНС) и ось кишечник – мозг
1.1. Схема кишечной нервной системы
Нейроны ЭНС общаются друг с другом, используя тот же «язык», что и в центральной нервной системе. С функциональной точки зрения рефлексы в ЭНС можно разделить на две основные категории: (1) аксонные рефлексы, где тонкое афферентное нервное волокно связано с центральной нервной системой (часто активируемое вредными раздражителями слизистой оболочки), причем афферентные волокна контактируют с эффекторной клеткой (например, эпителием, кровеносными сосудами или другим нейроном), и (2) интрамуральные рефлексы, т. е. рефлексы, ограниченные нейронами, содержащимися в стенке желудочно-кишечного тракта [20]. В последнем случае вредный внутрипросветный стимул (например, бактериальные токсины) может активировать эндокринные клетки слизистой оболочки для выработки пептидов, которые достигают нервных окончаний подслизистого сплетения, в свою очередь стимулируя миэнтериальное (мышечно-кишечное) сплетение, которое оказывает свое действие на постганглионарные волокна и конечные эффекторы (например, эпителиальные клетки, сосуды и мышцы) [21].
2. Комменсальные бактерии и кишечная нервная система
Микробиота кишечника синтезирует различные метаболиты, то есть сложные эфиры, серотонин, триптофан и различные жирные кислоты, которые могут влиять на мозг. Было продемонстрировано, что непрямой эффект, оказываемый микробиотой кишечника, влияет на серотонинергическую передачу, регулируя триптофан, концентрация которого выше у самцов стерильных (безмикробных) мышей по сравнению с контрольной группой с кишечной микробиотой [30], у которых также наблюдается более высокая концентрация серотонина в гиппокампе [14].
Было хорошо продемонстрировано, что микробиота продуцирует метаболиты короткоцепочечных жирных кислот ( SCFAs ), то есть бутират, пропионат и ацетат. Они оказывают прямое влияние на восстановление микроглии у мышей, свободных от микробов [31,32]. Более того, SCFAs воздействуют по крайней мере на две системы молекулярной передачи сигналов, которые имеют широко распространенные регуляторные эффекты по всему телу: деацетилирование гистонов ( HDAC ) и рецепторы, связанные с G-белками ( GPCRs ) [33]. SCFAs являются естественными ингибиторами HDAC и активаторами специфических рецепторов, связанных с G-белком (GPCRs). Дисбаланс в сторону чрезмерного деацетилирование гистонов был обнаружен при болезни Паркинсона [34]. GPCRs представляют собой трансмембранные белки, которые представляют собой важные ворота, через которые клетки преобразуют внешние сигналы во внутриклеточные сигналы (29). SCFAs активируют два специфических GPCR ( GPR41 и GPR43 ) без каких-либо других известных лигандов [35,36]. GPR41 широко распространен в симпатических ганглиях человека, где его активация пропионовой кислотой увеличивает отток симпатической нервной системы и является одним из потенциальных механизмов, с помощью которого пищевые волокна (обогащенные SCFA) могут увеличивать базальную скорость метаболизма и помогать контролировать ожирение [36,37]. Также было доказано, что пропионат и бутират, вводимые в нейробласты крыс, увеличивают экспрессию тирозингидроксилазы, которая является ферментом, ограничивающим скорость в норадреналине, и синтез дофамина [14,38]. Основные данные о влиянии бактерий на ЭНС представлены в таблице 1 и графически представлены на рисунке 1.
Таблица 1. Бактерии и кишечная нервная система.
Рис. 1. Кишечная нервная система и центральная нервная система постоянно взаимодействуют друг с другом, и изменения микробиоты могут быть вовлечены в патогенез нескольких заболеваний.
2.1. Микробиота и социальное поведение
В различных исследованиях отмечается фундаментальная роль микробиоты кишечника в социальном поведении. Это, вероятно, связано с горизонтальной передачей микробов между сородичами [14], например, у конкретных тараканов, через социальные события, такие как копрофагия и проктодальный трофалаксис, или у социальных пчел [39]. Присутствие Bifidobacterium и Lactobacillus в кишечнике является основополагающим для производства SCFA, что становится важным для питания в периоды голодания [40,41]. Различное социальное поведение, такое как уход, у бабуинов определяется конвергенцией основных кишечных микробных таксонов [42]. Эти данные кажутся еще более впечатляющими, если учесть, что мыши, рожденные от матерей на диете с высоким содержанием жиров, имеют измененный состав микробиоты со значительным сокращением Lactobacillus spp. и сниженной способностью различать знакомых и неизвестных сородичей [43]. Этот дефект может быть замещен Lactobacillus reuteri с последующим увеличением окситоцина в паравентрикулярном ядре гипоталамуса [44], улучшая их социальное поведение [14].
Экспериментальные модели животных, свободных от микробов, и животных, леченных антибиотиками, которые определяют полное отсутствие микробиоты, демонстрируют макроскопические изменения обмена нейромедиаторов, измененную морфологию нейронов и значительное нейровоспаление [49] в зависимости от времени появления микробиоты. Аналогичным образом, замена микробиоты приводит к резкому изменению поведения и социального поведения у экспериментальных животных, таких как грызуны. Напротив, добавление Bifidobacterium и Lactobacillus может привести к заметным улучшениям в социальном поведении в раннем и взрослом возрасте [14]. Как замечательно написано Шервином и др. [14]: «Новые исследования теперь рассматривают животных как «холобионтов»: динамические экосистемы, включающие хозяина и связанные с ним микроорганизмы, которые могут меняться со временем, локализацией и функциями. В совокупности геномы хозяина и микробов холобионта называются гологеномами, и вариации в гологеноме, вызванные изменениями в хозяине и / или микробах, могут влиять на фенотипы, которые могут быть предметом естественного отбора».
2.2. Микробиота, цикл сна и расстройства настроения
2.3. Микробиота и болезнь Альцгеймера
2.4. Микробиота и болезнь Паркинсона
Больше исследований было проведено по второй наиболее частой форме нейродегенеративного заболевания, которой является болезнь Паркинсона (PD). Сходящаяся линия этих исследований разделяет две общие точки: высокая плотность микробной популяции обонятельной луковицы и кишечника и высокая плотность отложения неправильно свернутого альфа-синуклеина на двух участках [12,99–101]. Было продемонстрировано, что отложения альфа-синуклеина имеют рострокаудальный градиент [102] с более высокой концентрацией в подчелюстной железе и более низкой концентрацией в пищеводе [102,103]. Было высказано предположение, что основными эффектами блуждающего нерва могут быть пути прорастания от периферических участков к стволу мозга [100], а ваготомия снизила скорректированный риск развития PD в популяции наблюдения через 20 лет [104,105]. Было продемонстрировано, что у пациентов с PD наблюдается более высокая проницаемость кишечника [106] (с более высоким присутствием Enterobacterales (E. coli)) при окрашивании слизистой оболочки, что связано с более высоким плазматическим белком, связывающим ЛПС у пациентов с PD [106,107]. У мышей дикого типа с избыточной экспрессией альфа-синуклеина условия, свободные от микробов, вызывают меньше двигательных симптомов и минимальные признаки общего воспаления мозга и альфа-синуклеина [108]. Те же аспекты наблюдаются у мышей, получавших антибиотики, в то время как колонизация фекалиями мышей дикого типа или здоровых субъектов или с высоким количеством SCFAs определяет ухудшение Паркинсонических двигательных симптомов [106]. В трех поперечных исследованиях сообщалось об относительном обилии Prevotellaceae при PD, но не в контроле [109]. В сочетании с тяжестью запора обилие Prevotellaceae, Lactobacillaceae, Bradyrhyizobiaceae и Clostridiales IV может быть использовано для выявления случаев PD с чувствительностью 66,7% и специфичностью 90,3%. Постуральная нестабильность и симптомы походки были связаны с относительным обилием Enterobacterales [102,109,110]. Также сообщалось, что синтез ЛПС увеличивается у пациентов с PD по сравнению с контролем [110]. Тот же аспект был подтвержден в другом исследовании, которое показало более низкие сывороточные уровни ЛПС-связывающего белка [107], а также снижение абсолютной концентрации фекальных SCFAs (ацетата, пропионата и бутирата) [111].
2.5. Микробиота и другие нейродегенеративные заболевания
Было проведено несколько исследований на животных и человеческих моделях демиелинизирующих заболеваний, таких как экспериментальный аутоиммунный энцефаломиелит ( EAE ), рассеянный склероз ( MS ) и оптиконевромиелит ( NMO ) 114.
Безмикробные мыши были очень устойчивы к развитию аутоиммунного энцефалита [113,114] или имели более низкие клинические оценки из-за их энцефалита [114]. Однако это состояние резко изменилось, когда эти стерильные мыши получили трансплантат фекалий от здоровых мышей [116]. Считалось, что условия окружающей среды, которые, по-видимому, влияют на прогрессирование рассеянного склероза, такие как ожирение, курение, низкий уровень витамина D и измененная реакция на человеческие вирусы [23,117–120], по-видимому, влияют на это через микробиоту [121,122]. « Дырявый кишечник » [123] широко присутствует при ремиттирующем рассеянном склерозе, и различные исследования показали различный состав микробиоты кишечника при MS, а не у контрольных субъектов [123–128]. Была замечена любая специфичность для данного состава микробиоты в случаях рассеянного склероза, но провоспалительная среда является постоянной находкой [102,123]. Документально подтверждено совпадение с другими воспалительными хроническими состояниями, такими как болезнь Крона, избыточный бактериальный рост в тонком кишечнике, ревматоидный артрит и недифференцированные патологии соединительной ткани [129–131]. Существует тенденция сообщать о некоторых конкретных группах микробов в MS-микробиоте, например, архей (род Methanobrevibacter) [125] или об истощении видов Firmicutes (роды Clostridium) [123] и типа Bacteroidetes [126–128]. Даже животные модели EAE (приматы) могут показывать низкие уровни липида 654 (функционирует как лиганд Толл-подобного рецептора 2 человека и мыши – ред.), который является липопептидом, предположительно полученным из кишечных Bacteroidetes [132]. Были проведены минимальные исследования для определения уровней рассеянного склероза и прогрессирования заболевания, и с помощью таких исследований можно было получить определенный результат. Тем не менее, в популяции детей с MS истощение фузобактерий (Fusobacteria) было связано с более высоким коэффициентом риска более раннего рецидива [123], и в настоящее время проводятся различные исследования по этой увлекательной теме [133].
Сценарий для NMO отличается, что часто связано с анти-аквапорином 4 и присутствием АТФ-связывающего кассетного транспортера Clostridium в микробиоте кишечника [134, 135], даже если все набранные пациенты с NMO проходят терапию ритуксимабом [135, 136].
3. Патогенные бактерии и кишечная нервная система
Помимо комменсальной микробиоты, патогенные бактерии в просвете также взаимодействуют с ЭНС косвенно, через ненейрональные промежуточные клетки, такие как эндокринные (в частности, энтерохромаффинные клетки ( ECs )) или иммунные резидентные клетки кишечника. Некоторые энтеротоксины вызывают секрецию кишечника через нервные рефлексы, происходящие параллельно с токсинами и оказывающие прямое секретирующее действие на клетки кишечника.
3.1. Токсины, способствующие секреции
3.2. Токсины, способствующие рвоте
4. Влияние вирусов на кишечную нервную систему
Некоторые нарушения моторики желудочно-кишечного тракта ( GIMDs ) могут зависеть от функциональных или анатомических изменений ЭНС [153–155]. Молекулярная основа этих изменений неоднородна, включая дегенеративные и опосредованные воспалением аномалии [156]. В этом контексте инфекционные агенты, такие как нейротропные вирусы, могут быть идентифицированы как этиологические факторы, влияющие на целостность ЭНС либо напрямую, либо через иммуно-опосредованные механизмы [157]. Основные результаты с точки зрения вирусного влияния на ЭНС представлены в таблице 2 и графически представлены на рисунке 2.
Таблица 2. Вирусы и кишечная нервная система
В таблице представлены основные вирусные агенты, их патогенетические механизмы и болезнь. TBEV: клещевой энцефалит; WNV: вирус Западного Нила; ZIKV: вирус Зика; HSV-1: вирус простого герпеса-1; EBV: вирус Эпштейна – Барра; VZV: вирус ветряной оспы; JCV: вирус Джона Каннингема; EGCs: энтероглиальные клетки; CIIPO: хроническая кишечная идиопатическая псевдообструкция; ВИЧ: вирус иммунодефицита человека; Клетки EC: энтерохромаффинные клетки; HAdV-41: аденовирус-41.

Рисунок 2. Патогенные бактерии, вирусы и паразиты, поражающие в первую очередь желудочно-кишечную систему, взаимодействуют с кишечной нервной системой, устанавливая связь между кишечником и центральной нервной системой.
Некоторые случаи нарушений моторики кишечника, по-видимому, связаны с вирусной инфекцией [170–172]. В мышиных моделях инокуляция нейротропными флавивирусами приводит к повреждению и гибели энтеральных нейронов, воспалению, кишечной дилатации и замедленному кишечному транзиту. Точнее, прививка мышей флавивирусами вируса Западного Нила (WNV) и вируса Зика (ZIKV) приводит к репликации вируса по всему кишечному тракту и расширению кишечных сегментов. Вирусная репликация особенно наблюдалась в кишечных нейронах, вызывая гибель клеток, но не в глиальных клетках или эпителиальных клетках слизистой оболочки. Кроме того, у животных, переживших WNV-инфекцию, наблюдаются дефекты моторики желудочно-кишечного тракта от 4 до 7 недель после заражения. В целом эти наблюдения подтверждают гипотезу о том, что некоторые нарушения моторики желудочно-кишечного тракта могут быть эпизодическими после инфекции/воспаления или хроническими, которые могут периодически усугубляться дополнительными инфекциями или воспалением [173].
Отсроченный эффект вирусной инфекции можно предположить в начальном нейропатогенезе болезни Паркинсона в соответствии с гипотезой «виремического удара», основанной на теории двойного удара. В частности, вирус гриппа A может «ударить и убежать», инициируя патологические изменения в структурах ЭНС, тогда как HSV-1 может «поразить» и установить пожизненную персистенцию с повторяющимися реактивациями из латентности, в зависимости от уровня иммуносенсации [174]. Эти виремические удары могут вызывать образование фибрилл α-синуклеина в периферических нервных тканях, что приводит к постепенному транснейрональному распространению α-синуклеопатии в головном мозге [175–177].
EGCs могут быть активированы ECs, зараженными вирусами. ECs распределяются по слизистой оболочке кишечника для высвобождения медиаторов с базолатеральной поверхности и для активации окончаний афферентных нейронов, в основном внутри собственной пластинки [188]. Среди своих медиаторов ECs выделяют серотонин [189], который активирует ЭНС и внешние афференты блуждающего нерва к мозгу, а также может активировать EGCs [21]. Было продемонстрировано, что участие серотонина играет ключевую роль в регуляции кишечной секреции, моторики кишечника, некоторых желудочно-кишечных расстройств, тошноты, рвоты и острого гастроэнтерита [190, 191]. Ротавирусы (RV) могут инфицировать EC-клетки и стимулировать секрецию серотонина в зависимости от дозы и времени, что приводит к RV-связанной диарее [192]. Точно так же аденовирус-41 (HAdV-41) может стимулировать серотонин из вируса Коксаки и аденовирусные рецепторы (CAR), экспрессирующие EC-клетки человека, активируя EGCs. Эти наблюдения подчеркивают серотонин-зависимый перекрестный обмен между HAdV-41, EC-клетками и EGCs, что может иметь значение для понимания того, как HAdV-41 вызывает диарею [193].
Была выдвинута гипотеза об активации EGCs при связанной с SARS-CoV-2 диарее. Действительно, активированные EGCs массово высвобождают IL-6 и другие медиаторы воспаления, что приводит к так называемому «цитокиновому Шторму», наблюдаемому у пациентов с COVID-19. Поэтому в этих случаях дисфункцию ЖКТ можно рассматривать как возможный маркер вовлечения ЭНС/EGC, а не как вспомогательный симптом, подчеркивая патофизиологический механизм, лежащий в основе нейроинвазии SARS-CoV-2 194.
Количество вирусов, физиологически обитающих в кишечнике человека, оценивается до 10 9 на грамм фекалий [15], в основном состоящих из бактериофагов (вирусов, инфицирующих прокариот) и в меньшей степени-вирусов, инфицирующих растения, амебы, человека и других животных [200]. Человеческий Виром в основном приобретается постнатально и находится под влиянием комбинации пищевых, материнских и экологических источников [201]. В течение своей жизни виром диверсифицируется и достигает своего пика к взрослой жизни [202]. Эукариотические вирусы, такие как Parvoviridae, Anelloviridae, Picobirnaviridae, Circoviridae и Reoviridae, часто являются частью кишечного вирома здоровых людей [200], несмотря на то, что они являются условно-патогенными микроорганизмами. Пока не ясно, какие вирусные сенсорные и сигнальные пути важны для регулирования иммунных ответов, чтобы контролировать количество и состав кишечного вирома человека.
5. Паразитарное влияние на кишечную нервную систему
Опосредованный нейронами ответ ЭНС и иммунной системы на паразитарную инфекцию еще полностью не выяснен [203]. Основные результаты, касающиеся паразитарного влияния на ЭНС, представлены в Таблице 3 и графически представлены на Рисунке 2. Кишечные паразитарные инфекции могут нарушить баланс гомеостаза кишечника, в основном за счет модификации компонентов ЭНС, участвующих в нейротрансмиссии, особенно продукции 5-HT.
Таблица 3. Паразиты и кишечная нервная система.