что такое интерметаллическое соединение
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
Полезное
Смотреть что такое «ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ» в других словарях:
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (интерметаллиды устар.) хим. соединения металла с металлом, напр. CuAl2, MgZn2, Al2CuMg и др. В таких соединениях преобладает (см.). И. с. не подчиняются законам постоянства состава и простых кратных отношений (см. ). Практическое применение И. с … Большая политехническая энциклопедия
Интерметаллические соединения — химические соединения металлов друг с другом; см. Металлиды … Большая советская энциклопедия
Интерметаллические соединения — Интерметаллид (интерметаллическое соединение) химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой… … Википедия
СОЕДИНЕНИЯ ИНТЕРМЕТАЛЛИЧЕСКИЕ — соединения металлов друг с другом. Обладают преимущественно метал. связью. В отличие от обычных хим. соединений часто не подчиняются законам постоянства состава и простых кратных отношений. Геологический словарь: в 2 х томах. М.: Недра. Под… … Геологическая энциклопедия
Металлические соединения — интерметаллические соединения, то же, что Металлиды … Большая советская энциклопедия
Антимониды — соединения сурьмы с металлами. Твёрдые вещества с относительно высокой температурой плавления. Некоторые А. (Na3Sb, Ca3Sb2, Zn3Sb2 и др.) можно рассматривать как производные сурьмянистого водорода SbH3 (стибина), другие (ZnSb, SnSb, Ni4Sb … Большая советская энциклопедия
Олово — 50 Индий ← Олово → Сурьма … Википедия
Sn — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Крик олова — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Оловянная чума — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Интерметаллиды
Среди множества химических элементов, существующих в природе или искусственно созданных в лабораторных условиях, особе место занимают интерметаллиды. Обусловлено это, прежде всего их уникальными свойствами, за счет которых эти соединения получили повсеместное применение в хозяйственной жизни человека, легкой, тяжелой, добывающей промышленности.
Понятие, химические связи, примеры интерметаллидов
Интерметаллиды отличаются не совсем обычными химическими связями. Дело в том, что в зависимости от состава и характеристик каждого из первоначальных составляющих, складывается жесткость и прочность их кристаллических решеток. Обратим внимание, что характеристика этих сплавов заметно отличается от состава первичных металлов, которые послужили основой. Фактически образуется не одно, а несколько соединений в одном «флаконе». Причем новое вещество вобрало в себя все характеристики первоначальных материалов, которые в новой структуре в некоторых случаях имеют более выраженный характер.
Внутренняя структура рассматриваемых сплавов зависит от фактуры атомов и обладает хорошей устойчивостью в пределах области гомогенности. По составу выделяют соединения:
В качестве примера наглядно показана связь магния с несколькими разными металлами образующими интерметаллиды – MgZn, MgY, MgSn. Эти металлы еще могут называть по классу одного из элементов – к примеру – алюминиды, магниевые, никельные.
По своей природе интерметаллиды бывают дальтониды и бертоллиды. В первом случае они имеют постоянный состав во втором – переменный.
Свойства интерметаллидов
Данный параметр зависит в основном от жесткости и конфигурации химической связи, нежели от структуры первоначальных составляющих этих сплавов, из которых они произошли. Если сравнивать их показатели, то больше всего по своим характеристикам, например ионные интерметаллиды схожи с солями. Интерметаллид, где преобладает металлическая связь, больше напоминает по своим параметрам с металлами.
Первая категория (ионные интерметаллиды) обладает следующими свойствами:
Второй группе (металлические интерметаллиды) присущи несколько отличные параметры исходя из более прочной межкристаллической связи. К их особенностям следует отнести:
Еще один важный аспект – при соединении неметаллов с металлами получается отличный проводниковый эффект. Применяя их токопроводящих конструкциях, высокое напряжение постоянного и переменного тока не будут влиять на их свойства. Это сегодня чрезвычайно востребовано в электротехнической и добывающих отраслях.
Применение
Спектр использования интерметаллидов весьма широк. Из них выпускают разнообразные компоненты и детали оборудования, агрегатов. Причем изделия, производимые из них, отличаются прекрасными эксплуатационными параметрами.
Например, их алюминиевая разновидность (отличающаяся небольшим весом и прекрасной защитой от межкристаллической коррозии), в составе которых присутствует титан, нашла свое применение в авиастроении и космической промышленности. Из них выпускают разнообразные технические узлы самолетов, космических кораблей. Они незаменимы при монтаже сотовых конструкций реактивных военных самолетов, изготовлении деталей фюзеляжа, сопел форсажных камер. Их применяют при прокладке трубных коммуникаций внутри летальных аппаратов, опор механических узлов, корпусов турбин. Прекрасно они себя зарекомендовали при сооружении обшивки воздушных и космических судов, зондов и спутников. Отметим, что изоляция, произведенная на основе интерметаллических сплавов, без проблем выдерживает экстремальные температуры, не разрушается в безвоздушном пространстве, имеет минимальную степень теплового расширения.
Турбокомпрессоры и отдельные детали двигатели транспортных средств выполнены из высококачественных интерметаллидов. Эти материалы не только обеспечивают длительный срок службы данных агрегатов (роторов, поршней, нагревательных труб) где, но и улучшают их эксплуатационные показатели и облегчая их массу (если речь идет об алюминии). Интерметаллиды SmCo 5, Fe 3 Ni, задействованы при производстве магнитных материалов, которые применяется электрической технике и при сборке высокоточного оборудования.
Такие продукты как Nb 3 Ge, V 3 Si являются великолепными сверхпроводниками, используемыми в электротехнической и металлургической промышленности, наукоемких производствах. Их закупают для нужд атомной энергетики, при выпуске летательных аппаратов, компьютерной техники микросхем для радио-, и микроэлектроники.
LaNi 5, CeMg 12. – являются аккумуляторами водорода. Они нашли свое применение в химической индустрии. Их задействуют при создании жаропрочного оборудования соприкасающегося с разными (часто агрессивными) реагентами и растворами. Применяют при создании водородной техники, нагревательных и топливных элементов.
Еще одни направлением их использования является медицина. В статмологии они прекрасно себя зарекомендовали при изготовлении зубных имплантатов. Нередко их применяют для производства инструментария и оборудования, для больниц, лечебно-профилактических центров.
С уверенностью можно констатировать, что интерметаллиды весьма популярные сплавы, повсеместно применяемые в различных областях хозяйственной деятельности человека. Они доказали свою практичность и износостойкость благодаря своим прекрасным эксплуатационным характеристикам. Изобретение этих материалов предопределило экономический прорыв в ряде современных производств.
Интерметаллические соединения
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Некоторые из них имеют полупроводниковые свойства.
Некоторые из металлов могут реагировать друг с другом очень активно. Например, реакция цинка и никеля при температурах выше 1000 °C носит взрывной характер.
Примеры интерметаллидов
См. также
Смотреть что такое «Интерметаллические соединения» в других словарях:
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлические соединения, металлиды) в узком смысле кристаллы, представляющие собой соединения металлов друг с другом; в широком смысле двух или многокомпонентные кристаллы, электронное строение к рых имеет характерные признаки металла (или… … Физическая энциклопедия
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (интерметаллиды устар.) хим. соединения металла с металлом, напр. CuAl2, MgZn2, Al2CuMg и др. В таких соединениях преобладает (см.). И. с. не подчиняются законам постоянства состава и простых кратных отношений (см. ). Практическое применение И. с … Большая политехническая энциклопедия
Интерметаллические соединения — химические соединения металлов друг с другом; см. Металлиды … Большая советская энциклопедия
СОЕДИНЕНИЯ ИНТЕРМЕТАЛЛИЧЕСКИЕ — соединения металлов друг с другом. Обладают преимущественно метал. связью. В отличие от обычных хим. соединений часто не подчиняются законам постоянства состава и простых кратных отношений. Геологический словарь: в 2 х томах. М.: Недра. Под… … Геологическая энциклопедия
Металлические соединения — интерметаллические соединения, то же, что Металлиды … Большая советская энциклопедия
Антимониды — соединения сурьмы с металлами. Твёрдые вещества с относительно высокой температурой плавления. Некоторые А. (Na3Sb, Ca3Sb2, Zn3Sb2 и др.) можно рассматривать как производные сурьмянистого водорода SbH3 (стибина), другие (ZnSb, SnSb, Ni4Sb … Большая советская энциклопедия
Олово — 50 Индий ← Олово → Сурьма … Википедия
Sn — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Крик олова — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
Оловянная чума — Олово / Stannum (Sn) Атомный номер 50 Внешний вид простого вещества серебристо белый мягкий, пластичный металл (β олово) или серый порошок (α олово) Свойства атома Атомная масса (молярная масса) 118,71 а. е. м. (г/моль) … Википедия
интерметаллиды
ИНТЕРМЕТАЛЛИДЫ (интерметаллические соединения) (от лат. inter — между и металл)
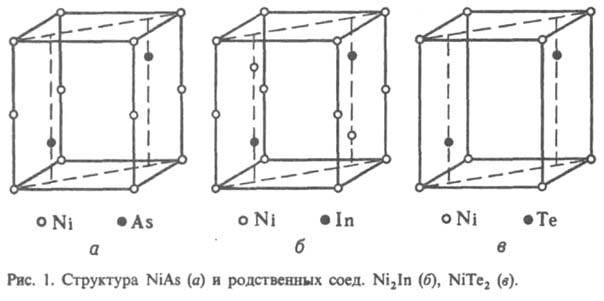
хим. соед. двух или неск. металлов между собой. Относятся к металлическим соединениям, или металлидам. И. образуются в результате взаимод. компонентов при сплавлении, конденсации из пара, а также при реакциях в твердом состоянии вследствие взаимной диффузии (при химико-термич. обработке), при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластич. деформации при мех. сплавлении (механоактивации). Для И. характерны преим. металлич. тип хим. связи и специфич. металлич. свойства. Однако среди И. имеются также солеобразные соед. с ионной связью ( т. наз. валентные соед., образующиеся из элементов разл. хим. природы и представляющие собой стехиометрич. соед.), напр. NaAu, соед. с промежут. характером связи — ионно-металлич. и ковалентно-металлической, а также с ковалентной. Так, в ряду соед. Mg с элементами подгруппы IVa вместе с уменьшением различия в электрохим. характеристиках компонентов наблюдается и изменение свойств И. — от характерных для ионных соед. (Mg2Si, Mg2Ge) к свойствам, типичным для металлов (Mg2Pb). В соед. структурного типа NiAs (рис. 1) или родственных типов Ni2In, NiTe2 или CdI2, представляющих собой соед. переходных металлов подгрупп VIIб, VIIIб и металлов подгруппы Cu с элементами подгрупп IIIa-VIa ( т. наз. никель-арсенидные фазы, или фазы Макарова), сложная природа хим. связи, которая изменяется с изменением положения компонентов в периодич. системе; одновременно изменяется и состав И. Для соед. состава АВ характерна ковалентно-металлич. связь; при изменении состава И. от АВ2 ( напр., NiTe2) до А2В ( напр., Ni2In) наблюдается изменение природы связи — от преобладающей ионно-ковалентной до металлической.
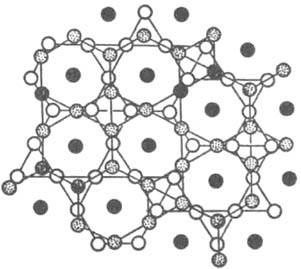
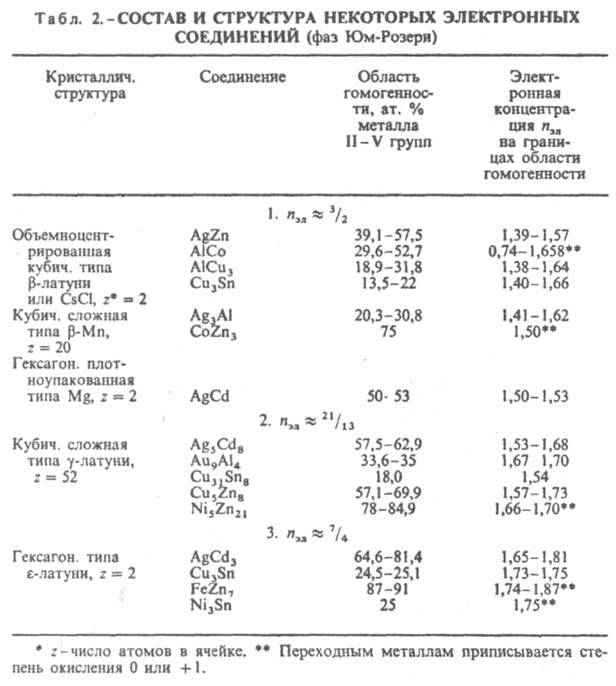
Среди двойных И. наиб. распространены соед. Курнакова, фазы Лавеса, фазы Юм-Розери (электронные соед.), σ-фазы, σ-подобные фазы. Известны и некоторые др. И. Особенно многочисленными являются соед. Курнакова (сверхструктуры, упорядоченные твердые растворы), характеризующиеся упорядоченным расположением атомов компонентов (атомы каждого из металлов занимают в кристаллич. решетке И. строго определенное положение, создавая как бы неск. вставленных одна в другую подрешеток). Сверхструктуры по сравнению с неупорядоченными твердыми растворами того же состава часто имеют большие (в 2–3 раза) размеры элементарных ячеек, а также добавочные дифракц. линии на рентгенограммах. Соед. Курнакова имеют составы АВ, А2В, А3В и т. д., однако в силу металлич. характера связи эти фазы могут обладать широкими областями гомогенности. В некоторых сплавах упорядоченное расположение атомов компонентов возникает уже при кристаллизации, но в большинстве случаев упорядочение происходит в твердом состоянии ниже определенной температуры, наз. точкой Курнакова. Фазы Лавеса — соед. состава АВ2 (реже АВ) — образуются обычно при определенном соотношении атомных радиусов компонентов rА/rВ и обладают узкими областями гомогенности. При взаимодействии металлов подгруппы Iб, а также некоторых переходных с металлами подгрупп IIIa, IVa, IIб-Vб при условии достаточно малого различия в величинах атомных радиусов компонентов образуются фазы Юм-Розери, часто наз. также электронными соединениями. σ-Фазы образуют переходные металлы гл. обр. подгрупп Vб, VIб с металлами подгрупп VIIб, VIIIб также при условии достаточно малого различия в величинах их атомных радиусов (эти И. иногда наз. электронными соед. переходных металлов). σ-Подобные фазы, напр., m-, c-, Р-фазы, сходны по кристаллич. структуре с σ-фазами, но все же имеют небольшие отличия. Состав большинства И. не отвечает простым атомным соотношениям компонентов, т. к. обычно эти соотношения определяются структурным типом и наличием упорядоченного расположения атомов компонентов. Упорядоченные структуры характерны для многих β-фаз Юм-Розери, фаз Лавеса и родственных им соед. ( напр., SmCo5), для фаз структурного типа Cr3Si, m-фаз ( напр., Fe7Mo6), некоторых σ-фаз. Многие И., напр., ε-фазы Юм-Розери, фаза σ-FeCr, являются неупорядоченными.
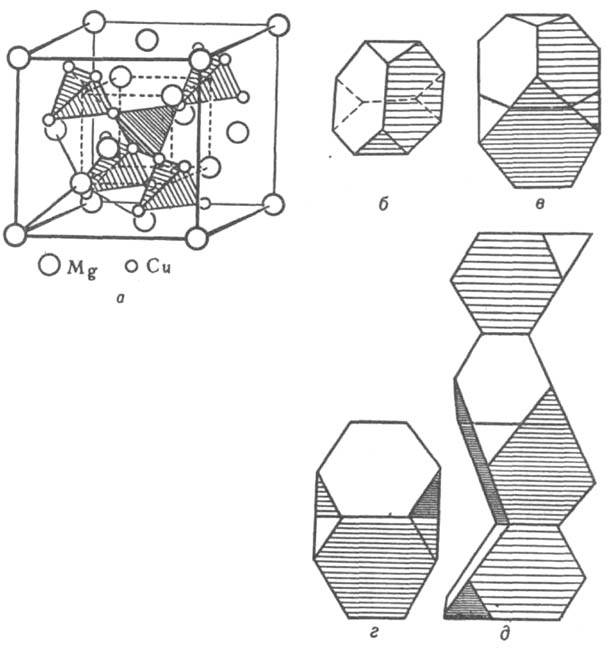
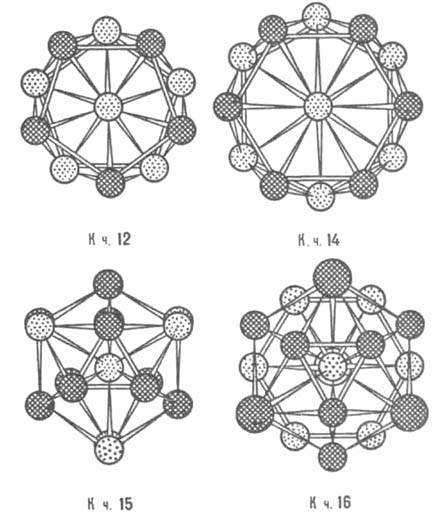
Кристаллическая структура. Классификация И. по кристаллич. структурным типам плохо коррелирует с типами хим. связи, т. к. одни и те же структуры м. б. у соед. с разл. природой хим. связи. Можно лишь выделить структуры с низкими координац. числами (к. ч.), характерные для И. с ковалентной связью. При этом атомы элемента из подгрупп б периодич. системы в структуре типа СаF2 расположены внутри тетраэдра (к. ч. = 4, напр., PtAl2, AuIn2), а в структуре типа NiAs — в центре тригональной призмы (к. ч. = 6). Структуры ионных и металлич. кристаллов можно рассматривать как плотные упаковки сферич. частиц ( см. плотная упаковка). Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлич. типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлич. кристаллов, — отношение соотв. ионных и металлич. радиусов компонентов. Ограничение числа реализующихся структурных типов для И. связано с тем, что диапазон изменений металлич. атомных радиусов существенно уже, чем диапазон изменений радиусов катионов и анионов в ионных соединениях. Вместе с тем среди И., как и среди металлов, имеются специфич. кристаллич. структуры. Предложенный Л. Полингом метод описания структуры ионных кристаллов с помощью координац. полиэдров используют и для описания структур И. Например, легко устанавливается родственность И. трех структурных типов фаз Лавеса (усеченные тетраэдры) MgCu2, MgZn2 и MgNi2 (рис. 2). В основе наиб. общей систематики структурных типов И. (П. И. Крипякевич, 1963) лежат координац. характеристики атома меньшего размера. Всего выделено 14 классов (или семейств) структурных типов, главные из них указаны в табл. 1.
Рис. 2. Структура фаз Лавеса: a — MgCu2. Атомы Mg образуют подрешетку со структурой типа алмаза. Атомы Cu расположены в пустотах (порах) этой подрешетки, образуя тетраэдры (показаны крупной штриховкой); центры этих тетраэдров совпадают с центрами тетраэдрич. пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр (показан мелкой штриховкой); это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса; б — полиэдр Лавеса — усеченный тетраэдр; в, г, д — изображения структурных типов фаз Лавеса в полиэдрах соотв. MgCu2, MgZn2, MgNi2.
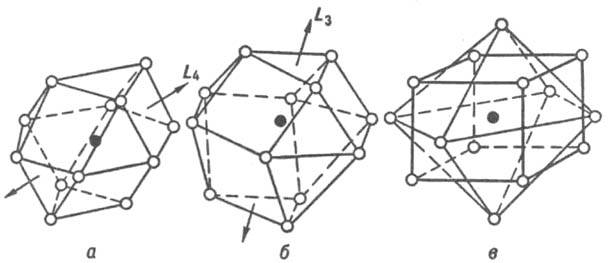
К числу наиболее распространенных относятся И., имеющие структуры, близкие к структурам чистых металлов, — плотнейшие кубич. гранецентрированную и гексагональную (к. ч. = 12), а также кубич. объемноцентрированную (к. ч. = 8 + 6, где 8 и 6 — число атомов соотв. в первой и второй координац. сферах). Координац. многогранники для плотнейших упаковок шаров одинакового размера — кубооктаэдр и его гексагон. аналог (рис. 3, а, б) — характерны для И., компоненты которых имеют близкие атомные радиусы. Кроме соед. со структурами типов Cu и Mg к данному классу принадлежат семейства сверхструктур ( напр., AuCu, AuCu3, Pt7Cu), а также структурные типы Ni3Sn, TiCu3 и др. К. ч. = 8 + 6 соответствует координац. многогранник в виде куба (8 соседей у центр. атома), атомы второй координац. сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы α-Fe, сверхструктуры на основе решетки типа α-Fe ( напр., β-латунь или CuZn, Fe3Al).
Др. подход к систематике кристаллич. структур металлов и их сплавов основан на выявлении наиб. характерных плотных и плоских (или почти плоских) сеток и последовательностей их укладки (У. Пирсон, 1972).
Рис. 3. Наиболее распространенные координац. многогранники для интерметаллидов: а — кубооктаэдр, к. ч. = 12 (гранецентрир. кубич. структура); б — гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагон. плотноупакованная структура); в — куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объемноцентрированная кубич. структура). Атом в центре координац. многогранника показан черным кружком, атомы в вершинах — светлыми, принадлежат первой координац. сфере (а, б) или первой и второй (в).
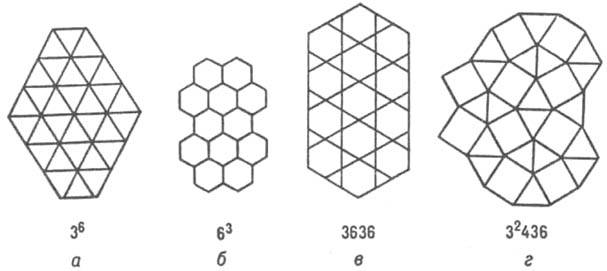
Примерно половина всех известных структурных типов металлич. и полупроводниковых соед. описываются укладкой правильных атомных треугольных (3 6 ), гексагональных (6 3 ) сеток, сеток кагомэ (3636) и сеток (3 2 434), содержащих квадраты (рис. 4; в обозначениях сеток большие цифры указывают форму ячейки, напр. 3 — треугольная, 4 — квадрат и т. д., цифры в верх. индексах — число таких ячеек, окружающих узел сетки).
Рис. 4. Структуры интерметаллидов, изображенные атомными сетками.
Известные решетки металлов — гексагональная плотноупакованная и кубич. гранецентрированная — представляют собой двух- (ABA. ) и трехслойные (АВСА. ) упаковки треугольных сеток 3 6 ; в структурах соед. сетки содержат атомы разного сорта с упорядоченным или неупорядоченным расположением, м. б. искаженными и иметь пятиугольные ячейки. В качестве примера на рис. 5 представлена структура σ-фазы, показанная сетками.
Рис. 5. Структура σ-фазы; представлена двумя сетками кагоме, повернутыми одна по отношению к другой на 90°; атомы, находящиеся между этими сетками, обозначены черными кружками.
Несмотря на удобство описания мн. структур с помощью плоских атомных сеток, следует учитывать трехмерный характер координации атомов в структурах кристаллов И. Одним из главных принципов структурообразования для этих кристаллов следует считать предложенный Ф. Лавесом в 1967 принцип наиб. полного заполнения пространства, которое обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; поры, или пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой неск. искаженных тетраэдров (характеризуется только одним типом пор — тетраэдрическим).
Рис. 6. Координац. многогранники Каспера — Франка; показаны проекциями атомов на плоскость чертежа; атомы, находящиеся на разных уровнях по отношению к центральному, изображены разл. способами.
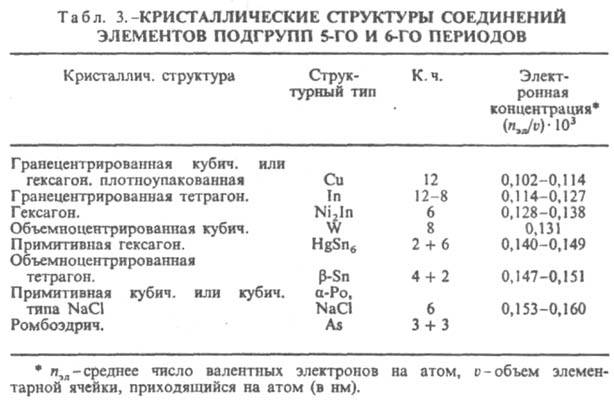
Ограничивающее действие фактора электронной концентрации сказывается при образовании σ-фаз, возникающих в сплавах металлов подгрупп Vб-VIIб с металлами подгруппы VIIIб. σ-Фазы имеют частично или полностью упорядоченное расположение атомов в решетке типа β-U и отличаются одинаковой электронной концентрацией (ns+d = 6,7–7,2, где ns+d — отношение суммы s- и d-электронов к числу атомов в решетке). Состав σ-фазы в системе V-Fe близок к АВ3 (17–28% V), в системе V-Ni — к А2В (55–65 ат. % V). В двух- и особенно в трехкомпонентных системах фактор электронной концентрации проявляется в определенной последовательности смены σ- и σ-подобных фаз (σ : Р : m : R : c) с изменением состава. Во всех рассмотренных случаях сопоставляются структуры с одинаковыми или близкими координацией и компактностью кристаллич. решетки (типичные металлич. структуры в случае фаз Юм-Розери, одинаковая координация в случае σ-подобных фаз). При сравнении ряда структур с существенно разл. координациями и компактностью должен быть др. подход к количеств. оценке фактора электронной концентрации. В случае И., образуемых элементами подгрупп б, удалось установить (В. Ф. Дегтярева, Ю. А. Скаков, 1976) связь последовательности смены структур (в одной или в разных системах) с изменением состава при определении электронной концентрации как отношения числа валентных электронов к единице объема (табл. 3). Необходимость такого способа выражения электронной концентрации обусловлена тем, что в отличие от ряда фаз Юм-Розери в ряду соед. металлов подгрупп б сильно изменяются компактность решеток и к. ч. В случае др. И. электронный фактор может не оказывать ограничивающего действия на концентрац. область существования И., т. к. ограничивающим становится др. фактор — геометрический (или размерный) rА/rВ, — требующий определенного соотношения числа атомов компонентов в связи с особой ролью атомного упорядочения, напр. соед. Ni4Mo, или в связи с тем, что позиции, занимаемые атомами в кристаллич. решетке, не равноценны, напр., фазы Лавеса АВ2.
Эти фазы (структурные типы MgCu2 — кубич., MgNi2 — гексагон. и MgZn2 — гексагон.) возникают при взаимодействии металлов практически всех групп периодич. системы при условии, что соотношение атомных радиусов компонентов rА/rВ
1,22 (практически для табличных значений радиусов rА/rВ
1,10–1,40). Ограничивающее действие фактора электронной концентрации проявляется в том, что некоторые элементы вообще не образуют фаз Лавеса, напр., переходные элементы в системах состава АВ2 при ns+d [ 7,7. При анализе возможности образования того или иного И. исходят не из конкретных значений геом. факторов и эффективных атомных радиусов, а из табличных для к. ч. = 12; в случае переходных металлов следует иметь в виду, что их атомные радиусы сравнительно мало изменяются в пределах одного периода, поскольку при переходе от элемента к элементу достраиваются внутр. электронные оболочки. Благодаря эффекту лантаноидного сжатия малы различия атомных радиусов элементов 5-го и 6-го периодов, 24 элемента имеют атомные радиусы в пределах 0,125–0,160 нм, и различия между ними составляют 10% и менее. Влияние геом. фактора на состав и структуру И. наблюдается при переходе от фаз Лавеса АВ2 к соед. АВ5 (или АВn). Если в соед. АВ2 один из атомов А (имеет больший радиус) из каждых двух формульных единиц в ячейке кристаллич. решетки замещается атомом В, возникают И. состава АВ5, напр. AuВе5 (структурный тип MgCu2) или CaCu5 (структурный тип MgZn2). Дальнейшее замещение в структуре типа CaCu5 1 /3 или 1 /2 атомов А парами менее крупных атомов приводит к структурным типам Th2Ni17 и ThMn12; при этом чем больше отношение rА/rВ, тем больше n в формуле АВn. Ряд таких И. образуется в системе Co-Sm и в др. подобных системах, содержащих РЗЭ. При взаимодействии Ti, Sc, Hf, Zr с переходными элементами VIII гр. — Ni, Co, Pd, Rh, Pt — возникают фазы А2В, близкие по структуре к т. наз. карбиду быстрорежущей стали Fe3W3C ( кубич. структура, 96 атомов в ячейке); геом. фактор rА/rВ
1,20 (к. ч. = 12), однако на образование этих фаз оказывает ограничивающее действие и фактор электронной концентрации, чем объясняется отсутствие двойных фаз с участием Fe. С этим же фактором, вероятно, надо связывать появление таких фаз в ряде систем при наличии кислорода, азота или углерода, которые выступают как стабилизаторы (подобно фазам внедрения). В тройных системах образуются И., имеющие как отличия, так и сходства в структурных типах с двойными И. Например, Cu2AlMn по структурному типу ( кубич. сингония, 16 атомов в ячейке) близок к Fe3Al; элементарная ячейка кристаллич. решетки σ-подобной Р-фазы в трехкомпонентном сплаве Cr18Mo42Ni40 (ромбич. сингония, 56 атомов в ячейке) м. б. описана как сдвоенная по оси с ячейка решетки σ-фазы. Вместе с тем добавление третьего (или четвертого) компонента в систему часто приводит к появлению новых, не существовавших в данной двойной системе И. в связи с действием фактора электронной концентрации ( напр., образование а-фазы в системе Cr-Ni при добавлении 8–15% Si). Найден особый тип И., в которых отсутствует трансляционная симметрия кристалла, поскольку существует ось симметрии 5-го порядка. Эти соед. наз. квазикристаллич. ( см. квазикристалл), или икосаэдрическими. Впервые такое соед. было получено как метастабильная фаза в системе Al-Mn при содержании ок. 16 ат. % Mn в условиях закалки из жидкого состояния. Для ряда сплавов в области концентраций, где образуются И., в условиях большой скорости охлаждения расплава получают метастабильные аморфные фазы, или металлич. стекла ( напр., в системах Cu-Zr, Ni-Ti). Аморфные И. возможно получить также при конденсации из пара, сильной деформацией смеси порошков, при ионной имплантации или путем радиац. воздействия на И.
Свойства. Физ. и хим. свойства И. в гораздо большей степени, чем кристаллич. структура, зависят от природы хим. связи. Ионные И. обладают свойствами, характерными для солей, — высокой температурой плавления, пониженной (по сравнению с металлической) электрич. проводимостью, наличием на диаграммах состояния узких областей гомогенности и др., многие разлагаются водой. Для И. с преобладающей металлич. связью характерны свойства металлов, прежде всего более или менее значит. способность к пластич. деформации. Все же мн. И. отличаются низкой пластичностью и сообщают повыш. хрупкость сплавам, в которых они являются одной из структурных составляющих ( напр., фаза σ-FeCr в хромистых сталях) или основой ( напр., SmCo5 в сплаве для постоянных магнитов). Благодаря особенностям кристаллич. и электронной структур И. в них происходит как бы оптимизация важных в практич. отношении физ. свойств (высокая температура плавления и низкая диффузионная подвижность компонентов в жаропрочных сплавах, магнитокристаллич. анизотропия и высокая коэрцитивная сила в сплавах для постоянных магнитов, нулевая магнитострикция и высокая магн. проницаемость в магнитно-мягких сплавах, сверхпроводимость, напр., в сплавах Nb3Sn, Nb3Al и др.). Свойствами полупроводников обладают, как правило, соед. металлов с неметаллами. В связи с использованием И. для получения высокопрочных сплавов, в т. ч. коррозионно- и жаростойких, жаропрочных, важны хим. свойства И., особенно их отношение к окислению. При окислении тугоплавких И. при низких температурах в связи с малой подвижностью атомов в решетках могут образовываться как простые оксиды, так и сложные ( напр., Nb2O5.Al2O3 при окислении NbAl3), они м. б. кристаллич., аморфными или метастабильной кристаллич. структуры. Образование поверхностных оксидных пленок повышает сопротивляемость И. к окислению. Наиб. стойки к окислению при повышенных температурах (выше 1000 °C) алюминиды и бериллиды. Ряд И., в частности И. щелочных и щел.-зем. металлов и некоторые соед. Al, разлагаются в присутствии влаги. Скорость разложения легкоплавких И. возрастает в ходе реакции (20–40 ч); MgCu2, MgZn2, Al3Mg2, CuAl2 влагой не разлагаются. Характер взаимод. И. с H2 зависит от реакц. способности компонентов по отношению к водороду. Если все компоненты И. являются активными гидридообразователями, происходит диссоциация И. с образованием индивидуальных гидридов, насыщение водородом может привести к аморфизации И. В др. случаях возникают сложные гидриды как фазы на основе И. ( см. гидриды). Это определяется не только особенностями кристаллич. структуры ( напр., наличием мест внедрения), но и особенностями электронной структуры компонентов и самого И. (наличием электронных вакансий). Такими особенностями обладают фазы Лавеса, а также родственные им фазы с участием переходных металлов, прежде всего РЗЭ.
Применение. Некоторые И. используют как магн. материалы (SmCo5, Fe3Ni, Cu2MnAl и др.), сверхпроводники (Nb3Sn и др.), аккумуляторы H2 ( соед. РЗЭ, РЗЭ и Mg, напр. LaNi5, CeMg12). И. входят в состав высокопрочных конструкц. материалов ( напр., обеспечивают высокую прочность в дисперсионно-твердеющих сплавах на основе Al, Cu, Fe и др.), жаропрочных сплавов [ напр., γ’-Ni3 (Al, Ti) в сплавах на основе Ni создает высокодисперсную микроструктуру, сохраняющую высокую прочность в условиях длительной работы при повышенных температурах]. На основе И. созданы защитные покрытия из тугоплавких металлов (Ni3Al, Ni3Nb, Ti3Al и др.). Фазовое превращ. TiNi ( кубич. ⇄ ромбич. фаза) обусловливает специфич. свойство этого материала — «память формы»; TiNi используют для изготовления термочувствит. элементов и преобразователей тепловой энергии в механическую.
Лит.: Белов Н. В., Структура ионных кристаллов и металлических фаз, М., 1947; Крипякевич П. И., «Ж. структурн. химии». 1963. т. 4, № 1, с. 117–36; там же, № 2, с. 282–99; Теслюк М. Ю., Металлические соединения со структурами фаз Лавеса, М., 1969; Интерметаллическис соединения, сб. под ред. И. И. Корнилова, пер. с англ., М., 1970; Дегтярева В. Ф., Скаков Ю. А., «Кристаллография», 1976, т. 21, в. 2, с. 405–07; Пирсон У. Б., Кристаллохимия и физика металлов и сплавов, ч. 1–2, пер. с англ., М., 1977; Уманский Я. С., Скаков Ю. А., Физика металлов (Атомное строение металлов и сплавов), М., 1978; Смитлз К. Дж., Металлы. Справочник. 5 изд., пер. с англ., М., 1980; Николин Б. И., Многослойные структуры и политинизм в металлических сплавах, К., 1984.