что такое индикатор в химии
Химические индикаторы
Индика́тор (лат. indicator – указатель ) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
Содержание
Применение индикаторов
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
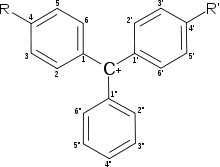
Структура молекул и цвет индикаторов
Трифенилметановые красители-индикаторы
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
| Название \ Положение | 2″ | 2 | 3 | 4 | 5 | 2′ | 3′ | 4′ | 5′ |
|---|---|---|---|---|---|---|---|---|---|
| Бромтимоловый синий | SO3 − | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Бромфеноловый синий | SO3 − | H | Br | OH | Br | H | Br | OH | Br |
| Бромкрезоловый зелёный | SO3 − | Me | Br | OH | Br | Me | Br | OH | Br |
| Крезоловый красный | SO3 − | H | Me | OH | H | H | Me | OH | H |
| Фенолфталеин | CO2 − | H | H | OH | H | H | H | OH | H |
| Тимолфталеин | CO2 − | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Малахитовый зелёный | H | H | H | NMe2 | H | H | H | NMe2 | H |
Производные азобензола
Виды индикаторов
Распространённые кислотно-основные индикаторы
Металлоиндикаторы
Редокс-индикаторы
Редокс- или окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.
Адсорбционные индикаторы
Термоиндикаторы
Химические индикаторы влажности
См. также
Полезное
Смотреть что такое «Химические индикаторы» в других словарях:
Химические реактивы — (реагенты химические) химические препараты, предназначенные для химического анализа научно исследовательских, различных лабораторных работ. В большинстве случаев химические реактивы представляют собой индивидуальные вещества; однако к… … Википедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — ИНДИКАТОРЫ ХИМИЧЕСКИЕ, вещества, используемые для определения водородного показателя pH или установления конечной точки титрования по изменению окраски химического индикатора. Наиболее известные индикаторы химические лакмус, фенолфталеин,… … Современная энциклопедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (напр., фенолфталеин, лакмус), окислительно… … Большой Энциклопедический словарь
ИНДИКАТОРЫ — (1) технические средства отображения информации о количественном и (или) качественном значении параметров технологического процесса либо состояния контролируемой системы (объекта) наблюдения или управления в виде, наиболее удобном для восприятия… … Большая политехническая энциклопедия
Индикаторы химические — вещества, введение которых в анализируемый раствор позволяет установить конец химической реакции или концентрацию водородных ионов по легко заметному признаку. И. х. используют главным образом в титриметрическом анализе (См.… … Большая советская энциклопедия
индикаторы химические — органические и неорганические вещества, используемые для определения водородного показателя рН или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (например, фенолфталеин, лакмус), окислительно… … Энциклопедический словарь
Индикаторы кислотно-основные — рН индикаторы, используемые для установления точки эквивалентности в нейтрализации методах (См. Нейтрализации методы); см. Индикаторы химические … Большая советская энциклопедия
Индикаторы металлохромные — металл индикаторы, используемые для установления точки эквивалентности при комплексонометрическом титровании; см. Индикаторы химические, Комплексонометрия … Большая советская энциклопедия
Индикаторы химические — Индикатор соединение, позволяющее визуализировать изменение концентрации какого либо компонента в растворе (часто при титровании) или быстро определить рН, еН и др. параметры. Виды индикаторов Кислотно основные индикаторы Редокс индикаторы, Ох… … Википедия
Индикаторы химические — этим именем называются такие вещества, которые, будучи введены в круг исследуемых химических превращений, образованием окрашенных соединений различных оттенков или выделением характерных осадков показывают на существование в данной среде или… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Индикаторы в химии
Слово «индикатор» происходит от латинского indicator — «указатель». Действительно, индикаторы — органические вещества сложной природы, с помощью которых можно отслеживать состав среды или протекание химической реакции. Среда любого водного раствора характеризуется содержанием ионов водорода Н+ или гидроксид-ионов. У водных растворов бывают нейтральная, щелочная и кислотная среды. В нейтральной среде число ионов водорода равно числу гидроксид-ионов. В кислотной среде число ионов водорода больше числа гидроксид-ионов. В щелочной среде число ионов водорода меньше числа гидроксид-ионов.
Пожалуй, самыми распространенными являются кислотно-основные индикаторы, изменяющие цвет согласно кислотности раствора. Кислотностью называется показатель активности ионов водорода в растворе. От кислотности зависит строение молекул индикатора. Например, фенолфталеин в слабой и средней кислой среде представляет собой недиссоциированные молекулы, и раствор остается бесцветным. Правда, в концентрированной серной кислоте он дает красную окраску, поскольку в ней присутствует катион фенолфталеина. В щелочной среде раствор приобретает малиновый цвет, потому что там присутствуют однозарядные анионы фенолфталеина. В сильнощелочной среде образуются трехзарядные анионы фенолфталеина, которые обесцвечивают раствор.
Существует множество кислотно-основных индикаторов/ их знают многие века. Это экстракты или отвары окрашенных плодов и цветов. Так, красными в кислой среде становятся отвары черники, малины, ежевики, черной смородины, свеклы, красной капусты, анютиных глазок, тюльпанов, ириса. В щелочной среде они будут синими. Кислый (например, уксус) и щелочной (пищевая или стиральная сода) растворы позволяют делать красные или синие узоры либо надписи на лепестках цветов. Чай тоже индикатор: он светлеет, если в него положить ломтик лимона, и темнеет, если добавить в него пищевую соду.
В химии давно, еще с 1300 г., известен такой кислотно-основной индикатор, как лакмус.
В чистом виде лакмус — темный порошок со слабым запахом аммиака. В нейтральной водной среде он дает фиолетовый цвет, в кислой — красный, в щелочной — синий.
В химической практике применяют несколько форм лакмуса — водный раствори ленты пропитанной лакмусом фильтровальной бумаги. Выражение «лакмусовая бумага» теперь является нарицательным и обозначает мгновенную определенную реакцию на что-либо.
Состоит природный лакмус из смеси 10— 15 разных веществ. Основные его компоненты — это азолитмин, эритролитмин, спанол, итмин, лейкоорцеин и лейказолитмин. Добывают его из растительного сырья в основном из лишайников.
Кроме кислотно-щелочных существуют и другие виды индикаторов, например адсорбционные. Они основаны на явлении адсорбции — увеличении концентрации растворенного вещества на границе раздела двух фаз. Эти вещества адсорбируются на поверхности осадка и меняют его окраску. Примеры таких индикаторов — ализариновый красный и эозин. Флуоресцентные индикаторы светятся разным цветом в соответствии с pH раствора. Так, флуоресценция акридина при pH = 4,5 зеленая, при pH = 5,5 синяя. При этом свечение индикатора никак не связано с собственной окраской раствора и его прозрачностью.
Кислотно-основные индикаторы широко используются в биохимии и аналитической химии, особенно при титровании. Однако их точность не очень высока, а определение цвета достаточно субъективно и зависит от особенностей человеческого зрения. Поэтому для точных исследований обычно используются специальные приборы — рН-метры.
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
[ Н + ] = [ ОН – ]
[ Н + ] > [ ОН – ]
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
Растворы солей
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Fe 3+ + HOH ↔ FeOH 2+ + H +
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.