что такое ин витро и ин виво
In vivo — in vitro — in silico
In vivo — in vitro — in silico
Кремний (Si), химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. Кремний — полупроводник, нашедший широкое применение в электронике для изготовления элементов полупроводниковых схем (от простейших транзисторов до сверхбыстрых современных процессоров).
Автор
Редакторы
Статья является введением к теме «Сухая биология» — в ней раскрывается смысл понятия in silico, а так же обсуждается его взаимосвязь с такими устоявшимися терминами как in vivo и in vitro.
Открывая этот новый раздел, хочется сказать несколько вводных слов, так как у большинства читателей наверняка может возникнуть вопрос: «что такое „in silico“?».
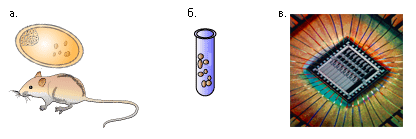
За последние несколько десятилетий развитие компьютерной техники достигло небывалых размахов. И как следствие компьютеризация захватила многие отрасли науки и техники. Биология также не является исключением. Если раньше компьютер рассматривался лишь как средство обработки экспериментальных данных, характер которых мог быть чрезвычайно разнообразным, от статистических исследований численности популяций, до обработки данных рентгеноструктурного анализа, то со временем стала развиваться идея полностью компьютерного эксперимента. Теперь компьютер стал рассматриваться как среда проведения эксперимента, т.е. имея на входе определенные исходные параметры, мы можем получить некие результаты моделирования, описывающие поведение исследуемой нами системы. Для обозначения всего, что связано с компьютерными экспериментами, в 90-е годы XX века даже возник полушутливый латинизм — in silico (от in silicon, т.е. «в кремнии» — подробнее см. 1–2), который дополнил ряд уже имеющихся еще с конца позапрошлого столетия классических определения характера экспериментальной среды — in vivo («вживую» — т.е. непосредственно в биологической системе), in vitro («в стекле», то есть в среде искусственно созданной — в пробирке), см. рис. 1. Термины in vivo и in vitro хорошо прижились среди экспериментаторов, однако смысл их использования достаточно относителен. Так, под in vivo молекулярный биолог, изучающий аспекты синтеза белка, может подразумевать колонию искусственно выращенных клеток, а под in vitro — систему бесклеточного синтеза в пробирке. При этом, для физиолога, изучающего механизмы проведения нервного импульса, in vivo — это целый организм, а in vitro — культура нервной ткани. В свою очередь, подход in silico также многоуровневый и включает в себя задачи по моделированию поведения отдельных молекул, биохимических процессов и даже функционированию отдельных физиологических систем.
Рисунок 1. Многоуровневый подход в изучении биологических систем: in vivo — т.е. в живом объекте (а), in vitro — т.е. в искусственно смоделированной среде (б), in silico — т.е. в полностью смоделированной на компьютере биологической системе (в).
Учитывая тематику нашего сайта, в разделе «Сухая биология» мы будем помещать материалы, в основном посвященные современным методам молекулярного моделирования. Молекулярное моделирование — это один из аспектов понятия in silico, который представляет из себя набор вычислительных методов, позволяющих с разной степенью физичности на атомарном уровне изучать молекулярные системы разной сложности. Методы молекулярного моделирования можно разбить на определенные группы, которые объединяют различные подходы, позволяющие решать задачи разного характера. К первой такой группе можно отнести все методики анализа биологических текстов (аминокислотных и нуклеотидных последовательностей), а также работу с соответствующими базами данных — ныне эта область получила специальное определение — биоинформатика. Следующая группа методов объединяет методики изучения эволюции молекулярных систем с использование эмпирических силовых полей. Набор подходов, позволяющих определять пространственную структуру белковых молекул, учитывая имеющиеся структурные шаблоны белков с гомологичными аминокислотными последовательностями, получил название моделирование на основании гомологии. Наконец, специальные подходы, позволяющие изучать взаимодействия типа лиганд-рецептор или фермент-субстрат, относятся к области молекулярного докинга. Обо всем этом вы узнаете подробнее на страницах раздела «Сухая биология».
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
«In vitro» activity of different antimicrobial agents on Gram-negative nonfermentative bacilli, excluding Pseudomonas aeruginosa and Acinetobacter spp. (Vay C.A., Almuzara M.N., Rodriguez C.H., Pugliese M.L., Lorenzo Barba F., Mattera J.C., Famiglietti A.M. Rev. Argent Microbiol., 2005;37(1):34-45).
Код вставки на сайт
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
КОМПЛЕКСНЫЙ ПОДХОД К ИЗУЧЕНИЮ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ IN VITRO, EX VIVO, IN VIVO
1 Кандидат медицинских наук, старший научный сотрудник, 2 младший научный сотрудник, 3 младший научный сотрудник, ЗАО «Санкт-Петербургский институт фармации»
КОМПЛЕКСНЫЙ ПОДХОД К ИЗУЧЕНИЮ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ IN VITRO, EX VIVO, IN VIVO
Аннотация
В статье рассмотрено – эффективное планирование и варианты проведения экспериментальных исследований с привлечением оптимального спектра методов для установления возможных направлений действия фармакологических веществ in vitro, ex vivo, in vivo. Конечной целью комплексного использования батареи методов является получение достоверных и достаточных по объему экспериментальных данных, сокращение объемов, стоимости и сроков исследования за счет грамотной разработки дизайна исследования и использования данных, полученных на каждом этапе.
Ключевые слова: скрининг, доклинические исследования, лекарственные средства, фармакологическое вещество, эффективность, безопасность, in vitro, ex vivo, in vivo.
1 Kandidat Medical Sciences, Senior Researcher, 2 Junior Researcher, 3 Junior researcher, “Institute of Pharmacy of Saint-Petersburg”
COMPLEX APPROACH TO STUDY PHARMACOLOGICAL AGENTS IN VITRO, EX VIVO, IN VIVO
Abstract
The article considers effective planning and options for experimental studies involving the optimum range of methods to identify possible areas of action of pharmacological agents in vitro, ex vivo, in vivo. The ultimate goal of the integrated use of a battery of methods to provide a reliable and sufficient in terms of experimental data, reducing the volume, cost and timing of the study by a competent study design and the use of data collected at each stage.
Keywords: screening, pre-clinical studies, drugs, pharmacological agent, the efficiency, safety, in vitro, ex vivo, in vivo.
Успешное изучение эффективности и безопасности фармакологических веществ напрямую зависит от грамотного планирования и разработки дизайна исследования. Существует большое количество методов как скрининговой, так и объемной оценки возможной направленности действия и токсических свойств фармакологических веществ. Эти методы можно условно определить в три группы согласно способам их выполнения – методы in vitro, ex vivo, in vivo.
Методы in vitro подразумевают скрининговую или объемную оценку эффективности и безопасности фармакологических веществ в модельных системах с использованием реакционных сред, ферментов, клеточных линий и др. На сегодняшний день в мировом научном сообществе методы in vitro очень популярны, как с точки зрения высокой инновационности, так и с позиции гуманного обращения с животными. Однако ограничение исследований эффективности и безопасности фармакологических веществ методами in vitro не целесообразно, так как экстраполяция полученных результатов на целый организм характеризуется высоким риском.
Методы ex vivo представляют собой, как правило, изолированные органы и ткани живых организмов. Эти методы также широко известны, а данные, полученные в результате исследований ex vivo, как правило, характеризуются большей релевантностью клинике. Однако, также как и методы in vitro, результаты исследований ex vivo, не могут являться основанием для начала клинических испытаний фармакологического вещества.
Методы in vivo являются классическими для экспериментальной фармакологии и представляют собой исследования на различных видах и линиях животных. Методы in vivo позволяют получить достоверные и достаточные по объему результаты, которые могут быть с успехом экстраполированы в клинику. Существует большое количество данных об анатомических, физиологических, биохимических и других особенностях видов и линий экспериментальных животных, которые позволяют установить степень релевантности человеку и прогнозировать результаты клинических исследований фармакологических веществ. Однако, не смотря на высокую информативность исследований in vivo, наиболее успешный подход к разработке дизайна исследований может быть обеспечен результатами исследований in vitro и ex vivo. Эти методы также позволяют существенно сократить количество животных в эксперименте, что имеет ключевое значение с точки зрения биоэтики [1,2].
В данной работе определены возможные варианты комплексной оценки эффективности фармакологических веществ с применением батареи методов in vitro, ex vivo и in vivo. Использование комплексного подхода позволяет сделать экспериментальное исследование максимально информативным и достоверным.
Комплексная оценка эффективности фармакологических веществ in vitro, ex vivo и in vivo
Для исследования эффективности фармакологических веществ особенное значение имеет скрининг фармакологической активности, пилотные исследования и изучение механизмов действия. Так, новые фармакологические вещества могут быть синтезированы или получены из природного сырья с использованием различных методов, может быть выделено большое количество стереоизомеров или веществ, отличающихся по структуре на одну или несколько функциональных групп. Проведение полноценного исследования каждого из кандидатов требует больших временных, экономических затрат и использования большого количества животных. Применение методов in vitro и ex vivo в большинстве случаев позволяет выбрать наиболее перспективные кандидаты и сократить объем исследований [3].
Исследование in vivo позволяет получить объемные данные, оптимальные для экстраполяции в клинику. Применение различных моделей заболеваний на животных, а также использование генетически модифицированных видов способствует установлению механизмов фармакологического действия, эффективных доз, динамики значений маркеров патологии при длительном курсовом применении и др.
В качестве примера приведем комплексное исследование эффективности фармакологического вещества Х, потенциально обладающего антиоксидантными и кардиопротективными свойствами, в системе методов in vitro, ex vivo и in vivo.
Дизайн исследования представлен в таблице 1.
Таблица 1 – Дизайн комплексного исследования эффективности фармакологического вещества X
На первом этапе исследования механизмов действия in vitro было установлено, что фармакологическое вещество Х характеризуется выраженной эффективностью в отношении гидроксильного радикала и перекисного окисления липидов (табл. 2).
Таблица 2 – Эффективность фармакологического вещества Х в исследованиях in vitro
Эффективность фармакологического вещества Х превышала таковую препарата сравнения Y.
Установлено, что наличие антиоксидантных свойств фармакологического вещества обусловливает его цитопротекторные свойства [4]. В многочисленных клинических и экспериментальных исследованиях определено, что оксидативный стресс играет ключевую роль в развитии кардиоваскулярных патологий, таких как ИБС, АГ, атеросклероз, коронарная недостаточность и сердечная недостаточность [5,6].
Результаты исследований in vitro позволили определить основные направления экспериментального дизайна ex vivo и in vivo, а также установить возможные механизмы действия фармакологического вещества.
Вторым этапом исследований было определение кардиопротекторных свойств фармакологического вещества Х в эксперименте ex vivo, проведенном на изолированном сердце по методу Лангендорфа [7]. Исследование проводили при применении фармакологического вещества Х в трех дозах.
В результате второго этапа исследований было установлено, что значения показателей давления (LVP) и скорости сокращения (dP/dt max) левого желудочка на фоне ишемии с последующей реперфузией изолированного сердца статистически значимо увеличиваются, что может свидетельствовать о положительном инотропном действии препарата (рис. 1).
Рис. 1 – Эффективность фармакологического вещества Х в исследовании ex vivo.
Данные, полученные в исследовании in vitro и ex vivo, дают основание предполагать ключевой механизм действия и фармакологический эффект вещества, а, следовательно, планировать эксперименты in vivo.
Таким образом, так как in vitro и ex vivo фармакологическое вещество X характеризовалось выраженной кардиопротекторной активностью, а также влиянием на антиоксидантную систему, то для изучения специфической активности in vivo были выбраны модели сердечно-сосудистых патологий, патогенез которых связан с оксидативным стрессом и нарушением сократимости миокарда: острый инфаркт миокарда и артериальная гипертензия.
В результате исследований эффективности фармакологического вещества Х in vivo на модели острого инфаркта миокарда было установлено влияние на физиологические и биохимические параметры моделируемой патологии (табл. 3).
Таблица 3 – Эффективность фармакологического вещества Х на фоне моделирования острого инфаркта миокарда у крыс, M ± m.
Примечание – * p ‹ 0,05 в сравнении контрольной группой
В результате исследований эффективности фармакологического вещества Х in vivo у спонтанно-гипертензивных крыс наблюдали выраженное снижение систолического (САД) и диастолического (ДАД) артериального давления как до применения фармакологического вещества Х, так и через 1 час после (табл. 4).
Таблица 4 – Изменение АД при курсовом применении фармакологического вещества Х
Примечание – * p ‹ 0,05 в сравнении контрольной группой
Таким образом, в результате использования комплексной оценки in vitro, ex vivo и in vivo была установлена высокая эффективность нового фармакологического вещества Х и определены возможные механизмы действия. На модели изолированного сердца по методу Лангендорфа и при моделировании острого экспериментального инфаркта миокарда in vivo было установлено кардиотоническое и кардиопротективное действие препарата. При применении нового препарата у спонтанно-гипертензивных животных наблюдалось стойкое снижение АД, а также уменьшение цифр исходного давления к концу курса лечения. Было установлено, что ключевую роль в реализации фармакологических эффектов фармакологического вещества Х играет его антиоксидантная активность, что было подтверждено в исследованиях антирадикальной и восстанавливающей способности in vitro.
Использование методов in vitro и ex vivo позволило существенно сократить объем экспериментальных животных, так как на основании их результатов были выбраны эффективные дозы фармакологического вещества Х и наиболее подходящие экспериментальные модели.
In vitro и In vivo: в чем разница
В медицинских статьях, описывающих те или иные исследования, часто употребляются два похожих термина – «in vitro» и «in vivo». Разберемся подробнее, что же они означают.
Термин «in vitro» переводится как « в стекле» и означает, что эксперименты проводятся вне живого организма. Термин «in vivo» в переводе звучит как «в жизни», соответственно, эксперимент проходит в естественных условиях. В целом же обе эти методики помогают ученым больше узнать о болезнях и разнообразных процессах, происходящих в живом организме.
In vitro
Итак, тестирование «in vitro» чаще всего происходит в условиях лаборатории и подразумевает изучение микроорганизмов, клеток животных или человека в определенной культуре. Эта методика помогает оценивать процессы, происходящие в конкретных клетках без целого ряда отвлекающих факторов, присущих живому организму.
Это довольно простая методика, и она позволяет изучать больше субъектов, чем при экспериментах с участием людей и животных. Но самый главный недостаток таких исследований, что среда в чашке петри не может быть полностью схожа со средой живого организма.
Довольно часто тестирование «in vitro» применяют в ходе фармацевтических испытаний. Новые лекарства всегда проверяются таким образом перед началом клинических испытаний с участием добровольцев.
Кроме того, метод «in vitro» лежит в основе наиболее эффективного метода лечения бесплодия – ЭКО. При экстракорпоральном оплодотворении процесс соединения двух клеток проходит не внутри организма, а в специальной среде. И только потом получившийся эмбрион подсаживают в матку женщины.
In vivo
Исследования «in vivo» также популярны в фармакологической промышленности. В целом такие тесты – крайне важный аспект медицинских исследований. Главными тестами «in vivo» являются тесты на животных и клинические испытания.
В ходе экспериментов с участием животных ученые имеют возможность выявлять процессы, лежащие в основе разных болезней и патологий. Можно сказать, что такие тесты – промежуточный этап между тестированием «in vitro» и испытаниями на людях.
Клинические испытания на людях – чаще всего завершающий этап любого крупного исследования. Обычно они применяются в фармакологии при выводе на рынок нового препарата или вакцины.
Что такое ин витро и ин виво
Во второй части обзора in vitro — in vivo корреляции мы рассмотрим такие вопросы как: среды растворения и методология, значение исследований биодоступности для разработки IVIVC, что такое расчет предсказуемости и с чем его едят и, наконец, применение IVIVC.
Среды растворения и методология
Абсорбция лекарственного вещества из твердой лекарственной формы после перорального приема зависит от высвобождения субстанции из препарата, его растворимости (солюбилизации) в физиологических условиях и проницаемости через стенку желудочнокишечного тракта. Растворимость лекарственного средства определяется путем растворения его самой высокой дозы в 250 мл буфера, откорректированного в пределах pH 1–8. Если вещество растворяется в данном или меньшем объеме, то его считают сильнорастворимым, кроме того, если степень абсорбции составляет больше чем 90 %, можно утверждать, что вещество устойчиво в желудочно-кишечной среде и высокопроницаемо [22, 23].
In vitro исследования, в процессе разработки лекарственного средства, используются для оценки, в процессе производства, качества изготавливаемых препаратов разных партий, разработки руководств для новых технологических прописей, и предоставления гарантии того, что производство находится на должном уровне, а также позволяют предсказывать эффективность препарата после проведения изменений (таких как состав прописи, технологический процесс, место производства, масштабирование производства) [23].
 |
В тестах на растворение обычно используют 4 основных типа аппаратов, которые указаны в USP [2] и рекомендованы руководствами FDA:
Предпочтительными и рекомендованными к использованию считаются первые два аппарата [22, 23]. Метод возвратно-поступательного цилиндра был специально разработан для круглых с модифицированным высвобождением лекарственных форм. Аппарат 4 особо эффективно можно использовать для модифицированных форм, которые содержат активную субстанцию с весьма ограниченной растворимостью. Аппараты 2 и 3, как было показано, полезно использовать для оценки и испытания трансдермальных дозированных форм [2].
В качестве среды, как правило, предпочитается водная среда растворения. [2, 3, 13]. Однако в различных руководствах ее pH незначительно отличается [2, 3, 13]. Например, руководствами FDA и некоторыми другими для проведения начальных исследований IVIVC рекомендуется использовать воду или буферный раствор с pH не более 6,8. USP для модифицированных форм рекомендует использовать такие среды:
Для моделирования кишечного или желудочного сока, соответственно, необходимо использовать среду с pH 6,8 или 1,2 [20]. Так как растворимость лекарственного средства зависит от состава среды, pH и буферной емкости, все эти факторы играют весомую роль в его растворении в пищеварительном тракте (22). Для плохо растворимых препаратов может быть оправданным добавление сурфактантов, например, 1 %-ого натрия лаурилсульфата [3, 24, 25]. Вообще, по зарегистрированным данным, неводные и водно-спиртовые системы мешают разработке IVIVC [2, 3, 24–26]. В то же время использование более экстремальных условий (например, pH > 8), должно быть обязательно обосновано [3, 13, 23]. Также не рекомендуется строго симулировать физиологическую среду пищеварительного тракта, а добавление ферментов, солей и дополнительных сурфактантов опять-таки должно быть обоснованным [13, 23].
В рамках IVIVC от каждой партии необходимо использовать как минимум 12 индивидуальных дозированных единиц для проведения исследований и построения профилей растворения. При этом коэффициент вариации для средних профилей растворения, для одной партии, должен составлять менее 10 % [3].
Для сравнения профилей растворения используется коэффициент различия ( f 1 ) и коэффициента подобия ( f 2 ) [23, 28, 29].
Исследования биодоступности для разработки IVIVC
Для того, чтобы охарактеризовать плазменную концентрацию каждой прописи относительно профиля времени, должны быть проведены исследования биодоступности [30]. Для разработки IVIVC эти исследования должны быть выполнены с достаточным количеством субъектов, для того, чтобы адекватно отразить эффективность лекарственного средства во время исследований. По представленным данным литературы, количество субъектов варьировало от 6 до 36. Предпочтительнее проводить перекрестные исследования, однако также допускаются параллельные или кросс-анализ. В качестве стандарта валидации в разработке IVIVC может использоваться внутривенный раствор, оральный водный раствор, или препарат с немедленным высвобождением. Как до, так и во время исследования, во внимание должен приниматься контроль над такими переменными как возраст, пол, физическое состояние субъектов и т. п., прием кофе, алкоголя, нерегулярное питание, курение.
Как указывалось ранее, для расчета степени корреляции А (для оценки in vivo абсорбции или динамики растворения) можно использовать только один метод деконволюции. Как правило, это метод Вагнер-Нельсона, Лу-Ригельмана или численной деконволюции, причем он применяется для каждой прописи и субъекта.
Оба метода, как Вагнер-Нельсона, так и Лу-Ригельмана, зависят от того, к какой разработке применяются, первый используется для однокамерных, а второй для многокамерных систем.
Расчет предсказуемости IVIVC
Чтобы продемонстрировать, что предсказуемость in vivo действия лекарственного средства в зависимости от его in vitro характеристик растворения, сохраняется сверх диапазона скорости in vitro растворения и производственных изменений, необходимо провести оценку IVIVC.
 |
На сегодняшний день методология оценки предсказуемости IVIVC является активной областью исследования и потенциально применимыми являются множество методов. В соответствии с ними, выводится положение, что корреляция должна прогнозировать in vivo действие препарата точно и последовательно [3]. В зависимости от намеченного применения IVIVC и терапевтического индекса лекарственного средства, оценка ошибки прогнозирования внутренне и / или внешне должна быть адекватной.
К внутренней предсказуемости относится IVIVC, разрабатываемая по технологическим прописям с тремя или более скоростями высвобождения, с широким терапевтическим индексом и достоверной ошибкой прогнозирования. Если же используются две прописи с различными скоростями высвобождения, то применение IVIVC должно быть ограничено по определенным категориями. В таком случае, для окончательной оценки и последующего полного использования IVIVC, рекомендуется проведение прогнозирования внешней ошибки [3]. Средняя абсолютная ошибка прогнозирования (в процентах) ( % PE) равная 10 % или меньше для C max и AUC указывает на предсказуемость IVIVC. Кроме того, % PE для каждой прописи не должна превышать 15 %. Если эти критерии не выполняются, то есть, если внутренняя предсказуемость IVIVC является недостоверной, то заключительным шагом для подтверждения возможности использования IVIVC вместо биоэквивалентности, должна быть оценка внешней предсказуемости IVIVC [3].
Внешняя оценка предсказуемости для разработки IVIVC не требуется, если препарат имеет широкий терапевтический индекс, или учитываются только две скорости высвобождения, или если внутренние критерии предсказуемости не выполняются, то есть внутренняя ошибка прогнозирования является недостоверной [3, 30]. Процент ошибки прогнозирования равный 10 % или меньше для Cmax и AUC является контрольным пределом внешней предсказуемости IVIVC. Если %PE равен в пределах 10–20 %, то это указывает на недостоверную предсказуемость и потребность в дальнейшем исследовании с использованием дополнительных наборов данных. Результаты оценки ошибки прогнозирования для всех таких данных должны быть обязательно оценены на логичность и непротиворечивость прогнозируемости. Если % PE больше чем 20 %, то это указывает на неадекватную прогнозируемость, при условии того, что обосновать такие результаты нельзя любым другим способом [3].
Применение IVIVC
Биовейверы
Согласно руководству FDA [3] выделяют пять категорий биовейверов:
Биовейверы можно использовать в сочетании с прогнозируемой и достоверной IVIVC для изменений:
Производимые изменения могут быть незначительными, несущественными для препарата, или же наоборот достаточно весомыми, для которых использовать IVIVC в качестве аргумента нельзя [30].
Создание спецификаций растворения
 |
Для лекарственных форм с модифицированным высвобождением можно относительно легко установить многоточечную спецификацию растворения [2]. Для этого определяется количество высвобожденной субстанции в каждой точке времени с использованием биосерий. При этом самые быстрые и самые медленные скорости высвобождения устанавливаются по верхними и нижними спецификациям растворения, с максимальной разницей — 20 % для прогнозируемых C max и AUC. Предсказанная плазменная концентрация и следующие из нее AUC и C max могут быть рассчитаны с использованием конволюции или любого другого адекватного метода моделирования [3, 30]. В случае многоуровневой степени С, последней точкой времени должна быть точка, в которой растворено не менее 80 % лекарственного средства [3]. Для степени корреляции C допустимым является отклонение ±10 %, при условии, что пределы измерения в любой точке времени не превышают 25 % [3]. При вариабельности высвобождения в каждой точке времени рекомендуется, чтобы общее отклонение было меньше 10 % или не более ±10 % (в общей сложности 20 %). В определенных случаях отклонения от этого показателя могут быть допустимыми до 25 %. Сверх этого диапазона спецификация должна быть обязательно дополнена исследованиями по биоэквивалентности [3, 30].
Нелинейная корреляция
Заключение
Таким образом, IVIVC представляет собой инструмент, позволяющий устанавливать, оценивать и предсказывать зависимость in vivo действия препарата относительно его in vitro спецификаций растворения. Данный метод представляет огромный интерес в плане использования вместо испытаний на биоэквивалентность, а также в качестве дополнения к биовейверам. IVIVC позволяет разрабатывать и валидировать селективные методы и спецификации растворения. Неоспорима его ценность в использовании при контроле качества, масштабировании производства и проведения пострегистрационных изменений. В связи с успехами в области разработки IVIVC для пролонгированных оральных лекарственных форм, резко увеличилась активность и в области трансдермальных, но несмотря на это, открытыми остаются исследования корреляции для других типов лекарственных форм. Признание и принятие IVIVC как регулирующими органами, так и фармацевтической промышленностью в качестве метода, позволяющего снизить затраты производства и сохранить на должном уровне контроль, является важным шагом на пути становления современных методов разработки препаратов.