что такое иммуносупрессоры иммуносупрессор это
Иммуносупрессивные препараты
Содержание
Ингибирование иммунных реакций [ править | править код ]
Ингибирование иммунных реакций целесообразно при пересадке органов для предотвращения отторжения трансплантата и при аутоиммунных заболеваниях. Иммуносупрессия в свою очередь подразумевает ослабление защиты от инфекций, а также риск возникновения злокачественных новообразований.
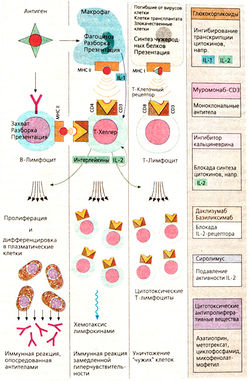
Специфическая иммунная реакция начинается с присоединения антигена к лимфоциту. В-Лимфоциты «узнают» поверхностную структуру с помощью мембранных рецепторов, которые похожи на образующиеся затем антитела. Т-Лимфоциты узнают антигены, представленные на поверхности макрофагов, с помощью молекул главного комплекса гистосовместимости (МНС, от англ, major histocompatibility complex). T-Клетки имеют на поверхности молекулы CD3 и CD4 (Т-хелперы) или CD8 (цитотоксические Т-лимфоциты), которые взаимодействуют с МНС. Помимо узнавания антигена для активации лимфоцита необходима стимуляция с помощью медиаторов типа цитокинов. Интерлейкин 1 образуется макрофагами, другие интерлейкины, в том числе интелейкин 2, — Т-хелперами. Антигенспецифичные лимфоциты пролиферируют, и возникает иммунный ответ.
I. Воздействие на механизм узнавания антигена. Муромонаб-СРЗ является мышиным моноклональным антителом против CD3, который участвует в узнавании антигена и взаимодействует с Т-лимфоцитами (применяют при реакции отторжения трансплантата) при лечении рассеянного склероза. Этому заболеванию приписывают аутоагрессию, обусловленную действием Т-лимфоцитов против олигодендроцитов, которые образуют миелиновую оболочку нейронов в ЦНр. Миелиновый белок действует, очевидно, как антиген. Ему подобен глатирамер; он ингибирует антигенные рецепторы, что усиливает узнавание антигена лимфоцитами.
II. Ингибирование образования цитокинов и их активности. Глюкокортикоиды модулируют экспрессию множества генов. Так, например, они блокируют образование интерлейкинов 1 и 2, что в свою очередь тормозит иммунный ответ Т-хелперов. Глюкокортикоиды взаимодействуют с другими цитокинами и медиаторами воспаления. Их назначают при реакции отторжения трансплантата, аутоиммунных заболеваниях и аллергических реакциях. Системное применение опасно развитием синдрома Кушинга.
Анакинра — генно-инженерный препарат, антагонист рецепторов интерлейкина 1. Анакинра применяется при лечении ревматоидного артрита (с. 340).
Даклизумаб и базиликсимаб представляют собой моноклональные антитела против рецептора интерлейкина 2. Они состоят из мышиных РаЬ-фрагментов и человеческого Fc-фрагмента. Применяют при реакции отторжения трансплантата.
Глатирамерацетат состоит из синтетических пептидов с различной длиной цепи, составленной из аминокислот в случайной последовательности: глутаминовой кислоты, лизина, аланина и тирозина (название глатирамер возникло из первых букв аминокислот — они выделены). Этот препарат может применяться наряду с р-интерфероном
III. Нарушение метаболизма клетки ингибированием пролиферации. Некоторые цитостатики также применяются в качестве иммунодепрессантов, но в более низких дозах, чем для лечения опухолей. К ним относятся азатоприн, метотрексат и циклофосфамцц. Они оказывают неспецифическое антипролифератив-ное действие как на В-, так и на Т-клетки. Мофетилмикофенолат действует специфически на пролиферацию лимфоцитов, блокирует инозинмонофосфатдегидрогена-зу, которая необходима лимфоцитам для синтеза пуринов. Препарат применяют при острых реакциях отторжения трансплантата.
IV. Иммунная сыворотка против Т-клеток получается при иммунизации лабораторных животных человеческими Т-лим-фоцитами. Препарат повреждает Т-лим-фоциты и применяется для ослабления реакции отторжения трансплантата.
Ингибиторы кальциневрина, сиролимус [ править | править код ]
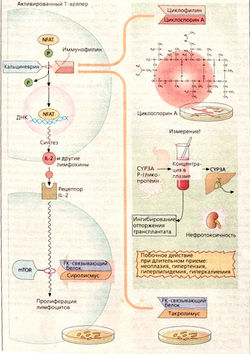
Циклоспорин А получают из грибов. Это циклический полипептид, состоящий из 11 аминокислот, в том числе атипичных. Поэтому при пероральном приеме он не разрушается протеазами желудочно-кишечного тракта. В Т-хелперах циклоспорин А ингибирует образование интерлейкина 2, участвуя в регуляции транскрипции этого белка.
В норме «ядерный фактор активации Т-клеток» (NFAT) может вызвать экспрессию интерлейкина 2. Для этого необходима стадия дефосфорилирования NFAT при катализе фосфатазой кальциневрином, что д елает возможным поступление NFAT из цитозоля в клеточное ядро. Циклоспорин А внутри клетки связывается с белком циклофилином. Этот комплекс ингибирует кальциневрин и тем самым останавливает образование интерлейкина 2.
Успехи современной трансплантационной медицины в значительной мере обязаны внедрению в практику циклоспорина А. В настоящее время его применяют и при определенных аутоиммунных заболеваниях, атопическом дерматите и других болезнях.
В качестве нежелательного эффекта можно назвать нефротоксичность препарата. Дозы должны выбираться с учетом того, чтобы концентрация в крови была не слишком высокой (возрастание риска нарушения работы почек) и не слишком низкой (риск реакции отторжения трансплантатов). К тому же терапия циклоспорином А трудно управляема. При пероральном приеме биодоступность неполная. Р-Гликопротеин в стенках кишечника транспортирует вещество обратно в просвет кишечника, или оно разрушается цитохромоксидазой типа ЗА. Ферменты печени CYP-3A метаболизируют циклоспорин и отвечают за его пресистемную элиминацию. Лекарства, действующие на CYP-3A и Р-гликопротеины, могут взаимодействовать между собой. Для оптимального назначения лекарства необходимо провести полный анализ крови пациента.
Медикаментозное ингибирование отторжения трансплантатов должно проводиться продолжительное время. Повышенный риск развития злокачественных опухолей является ответом на подавление иммунной системы организма. Для долгосрочных прогнозов существенно то, что повышается риск возникновения сердечно-сосудистых заболеваний.
Такролимус — макролидный антибиотик; вырабатывается стрептомицетами. Действует аналогично циклоспорину А. На молекулярном уровне также может рассматриваться как рецептор, но не циклофилина, а так называемого FK-связывающего белка. Такролимус используется для предотвращения отторжения трансплантатов. Лучше проникает через эпителий, чем циклоспорин А, и может применяться локально при атопическом дерматите.
Иммуносупрессивные препараты [ править | править код ]
Иммуносупрессивные препараты — это лекарственные препараты разных фармакологических химических групп, которые подавляют реакции иммунитета через опосредованное угнетение функции клеток иммунокомпетентной системы. Такие средства применяют для лечения тяжелых гипериммунных заболеваний и угнетения реакции отторжения трансплантата, а также для ослабления воспалительных процессов неопределенной этиологии.
Известные сегодня иммуносупрессивные препараты характеризуются разной активностью: мягкое иммуносупрессивное действие оказывают НПВС, гепарин, препараты золота, пенициллин, производные 4-аминохинолина и др., в связи с чем их называют «малыми» иммуносупрессантами, умеренный иммуносупрессивный эффект проявляют средние дозы глюкокортикостероидов.
Наиболее мощными иммуносупрессивными препаратами являются цитостатики — препараты, применяемые как противоопухолевые, в частности, антиметаболиты и алкилирующие соединения, антилимфоцитарные и моноклональные антитела (AT), антибиотики и др., которые называют «большими» иммуносупрессантами.
Классификация иммуносупрессивных лекарственных средств
а) алкилирующие — миелосан, циклофосфан;
б) антиметаболиты — азатиоприн, меркантопурин;
в) некоторые антибиотики — например актиномицин;
г) препараты ферментов — L-аспарагиназа.
4. Производные 4-аминохинолина — хингамин, гидроксихлорохин.
5. Препараты золота — кризанол, солганал, ауротиоглюкоза, ауронофин.
6. Производные кислоты микофолевой — целсепт и др.
Глюкокортикостероиды, как уже отмечалось, это уникальная группа препаратов, которая сочетает мощное противовоспалительное и иммунное воздействие, их иммуносупрессивное действие связано с влиянием на клетки лимфоидного ряда.
Глюкортикоиды подавляют реакцию клеток на лимфокины (фактор, активирующий макрофаги, фактор переноса и пр.), ограничивая этим клон сенсибилизированных клеток. Они нарушают инфильтрирование тканей клетками крови, в том числе моноцитами, предупреждая превращение их в макрофаги тканей. Имеет значение их способность стабилизировать мембраны лизосом, снижать в крови число циркулирующих в крови Т-лимфоцитов, особенно Т-хелперов, препятствуя этим их активности, кооперации с В-лимфоцитами и образованию иммуноглобулинов, угнетать активность макрофлагов, в частности продукцию ими ИЛ-1, увеличивать синтез белков, тормозящих латентные протеазы и фосфолипазу А,. Применяют их при лечении диффузных заболеваний соединительной ткани (ревматоидный артрит), обычно в сочетании с другими препаратами, и при других заболеваниях, в основе патогенеза которых лежит гиперчувствительность замедленного типа: красная волчанка, склеродермия, аутоиммунная гемолитическая анемия, неспецифический язвенный колит, аутоиммунный гломерулонефрит и др.
(Правила, согласно которым осуществляется лечение этими препаратами, их побочные эффекты освещены ранее.)
Цитостатические лекарственные препараты для достижения цитостатического или иммуносупрессивного эффекта применяют в соответствии с определенными клинико-фармакологическими принципами, а именно:
Алкилирующие иммуносупрессивные препараты — одна из наиболее распространенных групп цитостатиков, в основе механизма их действия лежит способность замещать атомы водорода в важных биологических структурах клеток на алкильную группу. При этом происходит необратимое угнетение жизнедеятельности клеток. Наиболее чувствительны к алкилирующим соединениям нуклеиновые кислоты. Препараты — миелосан, хлорбутин, циклофосфан действуют в любой фазе клеточного цикла и на клетку в состоянии покоя, проявляют преимущественное влияние на В-клетки, угнетают продукцию IgM.
Циклофосфан назначают в начальной дозе 200—400 мг, в случаях длительного применения — 75—100 мг в сутки. Иммуносупрессивный эффект развивается на 10-е сутки лечения. Хлорбутин применяют по 0,2 мг-кг»1 в сутки, в случае длительного лечения дозу уменьшают; иммуносупрессивный эффект развивается на 10—14-е сутки лечения.
Миелосан — цитотоксическое средство, действие которого проявляется преимущественно относительно клеток миелинового ряда, применяется при хроническом миелоцитарном лейкозе, настоящей полицитемии; в случае значительной тромбоцитемии при миелофиброзе. Относительная избирательность действия обусловливает беспечность его назначения в течение длительного времени. Препарат не следует применять при остром и подостром лейкозах, при обострении хронического лейкоза, при значительной тромбоцитопении.
Антиметаболиты. Меркаптопурин — антиметаболит пуринов, по химическому строению близок к этим соединениям, в связи с чем нарушает синтез нуклеотидов, нуклеиновых кислот, оказывает цитотоксическое действие, угнетает рост пролиферирующих тканей. По структуре и свойствам к меркаптопурину близок азатиоприн (имуран), у него больше проявляется иммуносупрессивное действие и меньше — цитоксичность. Применяют при аутоиммунных заболеваниях (ревматоидный полиартрит, системная красная волчанка), изредка — для предупреждения отторжения трансплантата при пересадке органов.
Меркаптопурин и азатиоприн проявляют наибольшую активность в индуктивной фазе иммунной реакции, их иммуносупрессивное действие приблизительно одинаково относительно как клеточного, так и гуморального иммунитета. Оба препарата вызывают лейкотромбоцитопению, диспепсические расстройства (тошноту, рвоту, анорексию), токсический гепатит. Азатиоприн больные переносят лучше, он реже, чем меркаптопурин, вызывает эрозии слизистой пищеварительного тракта и гипоплазию головного мозга. Обычная начальная суточная доза меркаптопурина — 2 мг/кг/1, в случае длительного лечения — 0,5—1 мг/кг/1, эффект повышается применением дозы 4 мг/кг в сутки, иммунодепрессивное действие обоих препаратов развивается через 20—60 сут от начала лечения.
Метотрексат, антагонист кислоты фолиевой, угнетает активность дигидрофолатредуктазы (РН,-редуктаза), образование кислоты тетрагидрофолиевой, необходимой для ресинтеза тиминметиловых групп и кислоты дезоксиуридиловой в пределах синтеза тимидилата. При этом нарушается удвоение ДНК. Применяют внутрь 2,5—5 мг в сутки; общая доза в неделю — от 10 до 20 мг. Иммуносупрессивный эффект развивается после введения 10—20 мл на 10—40-й день после начала лечения.
Важнейший представитель иммуносупрессивных препаратов среди противоопухолевых антибиотиков — актиномицин, угнетающий деление клеток, а также синтез РНК. Препарату свойственно значительное побочное действие, поэтому его не применяют для длительного лечения, однако он довольно эффективен для предупреждения отторжения почек или других органов после трансплантации. Вводят парентерально, суточная доза — 0,01— 0,02 мл/кг/1.
Циклоспорин (сандимун) — продукт обмена грибов группы Trichocterma polysporum, обладает значительным иммуносупрессивным эффектом, замедляет раннюю стадию диффенцирования Т-лимфоцитов, вызываемую антигеном, особенно сильно влияет на Т-хелперы, в результате чего угнетаются преимущественно реакции отторжения. Уменьшает образование интерлейкинов и интерферона. Применяют внутрь и внутривенно при реакциях гиперчувствительности замедленного типа: отторжения трансплантата при пересадке органов (почек, печени, сердца, легких, костного мозга), при некоторых аутоиммунных заболеваниях. В отличие от цитостатических средств, сандимун не оказывает отрицательного влияния на кроветворение. Проявляет нефро- и гепатотоксическое действие. Больные, получающие циклоспорин А, менее чувствительны к инфекционным агентам, чем те, которые применяют другие иммуносупрессоры. Иммуносупрессивные препараты оказывают на клетки иммунокомпетентной системы неспецифическое действие. Их влияние направлено на фундаментальные механизмы клеточного деления и ключевые этапы биосинтеза белка в разных клетках, в т. ч. иммунокомпетентных. Несмотря на универсальные цитостатистические свойства, иммунодепрессанты отличаются по направленности действия на определенные этапы иммуногенеза, что важно учитывать при выборе препарата, адекватного конкретной клинической ситуации. Практическое значение имеет деление иммуносупрессантов на три группы в зависимости от того, в какие сроки их необходимо вводить (относительно действия антигена) для иммуносупрессивного ответа.
Первая группа объединяет соединения, которые проявляют иммуносупрессивный эффект при введении перед антигенной стимуляцией или одновременно с ней. Они влияют на механизмы узнавания, переработки антигена и информации. К этой группе принадлежат глюкокортикостероиды, актиномицин С, некоторые алкилирующие соединения.
Вторая группа препаратов осуществляет иммуносупрессивное воздействие при введении через 1—2 дня после действия антигена, угнетая пролиферативную фазу иммунного ответа. При их введении в организм до антигена или больше чем через неделю после него иммуносупрессивный эффект не развивается. В эту группу входят антиметаболиты, алкалоиды барвинка (винкристин, винбластин), актинолицин, большинство алкилирующих соединений.
Третья группа содержит соединения, эффективные как до, так и после антигенного влияния, они имеют несколько точек приложения в цепи иммунного ответа. К этой группе относятся антилимфоцитарный глобулин (АЛГ), антитимоцитарный глобулин (АТГ), ионизирующее излучение, L-аспарагиназа и др.
Исходя из изложенного препараты первой группы следует применять в случае трансплантации органов, когда иммуносупрессия необходима для предупреждения реакции отторжения трансплантата. При аутоиммунных заболеваниях для угнетения процессов пролиферации, при длительном действии антигенов по типу цепной реакции лучше назначать препараты второй или третьей группы.
Учитывая большое количество осложнений, «большие» имуносупрессивные препараты не применяют в начале лечения аутоиммунной патологии. Как правило, при этом используют «малые» иммуносупрессанты. Поскольку большинство «больших» иммуносупрессантов незначительно влияет на эффекторные механизмы иммунного ответа, их часто комбинируют с НПВС или с глюкортикостероидами.
Определенное значение имеют производные 4-аминохинолина (хингамин, гидроксихлорохин), которые блокируют синтез нуклеиновых кислот. Препараты золота (кризанол, солганал, ауротиоглюкоза, ауронофин) стимулируют клеточные иммунные реакции и угнетают гуморальный иммунитет, их применяют для лечения ревматоидного артрита. Производные кислоты микофолевой (селлсепт) оказывают большее цитостатическое влияние на лимфоциты, чем на другие клетки, их назначают для профилактики отторжения тканей при пересадке почек.
Практически все препараты, проявляющие иммуносупрессивную активность, имеют широкий спектр действия, угнетая не только иммунокомпетентные клетки, но и другие пролиферирующие клетки, системы и отдельные органы (почки, печень). При их применении ослабляется противомикробный и противоопухолевый иммунитет, возрастает риск развития инфекционных осложнений и онкологических заболеваний. За последние годы проводят исследования по созданию с помощью генноинженерной технологии человеческих антител, которые имели бы узкий спектр действия на строго определенные клеточные популяции, на молекулы главного комплекса гистосовместимости, на антигенные рецепторы Т-клеток, на интерлейкины и их рецепторы и др. Применение подобных препаратов поможет целенаправленно влиять на необходимое звено иммунной системы.
Поскольку на данном этапе селективную иммунотерапию проводить невозможно, наилучшего терапевтического эффекта можно достичь при комбинированном использовании иммуносупрессивных средств. Применять иммуносупрессивные препараты следует только тогда, когда возможности другой терапии исчерпаны, а шансы на успех превышают риск иммуносупрессии.
Учитывая, что иммунные заболевания очень часто имеют неблагоприятный прогноз, противопоказания для проведения иммуносупрессивной терапии относительны. Особую осторожность следует проявлять при таких ситуациях: наличие инфекции, недостаточная функция костного мозга, снижение функции почек (угроза кумуляции), беременность, нарушение функций печени, глубокие нарушения иммунной системы, онкозаболевания.
Иммунодепрессант: понятие, виды, особенности
Иммуномодулирующие препараты и иммунодепрессанты имеют еще и другое название – иммуносупрессоры. Они используются для замедления работы и размножения клеток иммунной системы. Их нужно принимать тогда, когда нужно остановить иммунные реакции, например, при пересадке органов, аутоиммунных патологиях, костно-мышечной системы и прочих серьезных заболеваниях.
Особенности иммунодепрессантов
Применять иммуносупрессивные средства нужно тогда, когда другие методы лечения испробованы и не достигнуты желаемые результаты, а шансы на положительный исход намного выше рисков от их использования. Из перечня лекарств-иммунодепрессантов практически все имеют иммуносупрессивную активность, оказывают широкое действие. Их применение понижает антибактериальный и противоопухолевый иммунитет, повышает риск появления инфекционных заражений, онкопатологии.
Поскольку заболевания и осложнения состояния здоровья во многих случаях имеют неблагоприятный исход, то противопоказания для лечения иммуносупрессорами несущественны.
Ученые работают над тем, чтобы придать лекарству узкую сферу действия, то есть, чтобы оно действовало на одну конкретную проблему, не затрагивая другие клетки.
С учетом действия препарата на иммунитет человека, их относят к нескольким группам:
Полностью подавляющие иммунную систему;
Для облегчения проявлений аутоиммунных заболеваний;
Противовоспалительное действие – необходимы при нарушении работы мозга.
Есть и другая классификация препаратов:
Также есть несколько поколений этих средств:
Принцип действия
Иммуноспрессоры имеют определенный механизм работы:
«Азатиоприн» и «Метотрексат» препятствуют разделению клеток, приостанавливают образование белковых элементов. Результат происходит медленно и с момента использования будет заметен только через пол года. Эти препараты имеют противоопухолевое действие. Также если принимать его в небольшом количестве, то будет достигнут противовоспалительный результат. Первый препарат содержит меньшее количество токсичных веществ.
«Циклоспорин». Достигается селективное и обратимое воздействие на клеточный иммунный ответ. Повышается продолжительность функционирования аллогенных трансплантатов разных органов.
Глюкокортикоиды. Отличаются сильным иммунодепрессивным эффектом. Останавливают работу макрофагов, лимфоцитов, не позволяя им попадать в кровь. Если принимать в большом количестве, то будет приостановлена работа иммуноглобулина. Отличаются выраженным и быстрым противовоспалительным действием.
Препараты золота, собираясь в зараженных суставных тканях, уменьшают фагоцитарную работу макрофагов, снижают содержание иммуноглобулина в плазме, что приводит к уменьшению его разрушительного воздействия на суставы. Результат будет заметен спустя 6 месяцев.
Даклизумаб. Это очень сильный препарат, от которого достигается более мощный цитостатический эффект.
Клинико-фармакологические принципы
Чтобы достигнуть желаемого результата от применения лекарственных препаратов, нужно учитывать некоторые клинико-фармакологические принципы:
Большие дозы – маленькие дозы;
Маленькое противовоспалительное действие – большое противовоспалительное действие;
Быстрое лечение – продолжительное лечение;
Разное время достижения результата – эффект будет заметен через конкретный промежуток времени (день, неделя, месяц, полгода);
Подавление производства ДНК – подавление разделения РНК.
Особенности применения
При приеме этих лекарственных препаратов нужно учитывать меры предосторожности. Во-первых, их нужно с осторожностью принимать при беременности, грудном вскармливании, проблемах работы почек и печени, инфекционных заражениях, нарушенной функции костного мозга. Их прописывают при следующих заболеваниях и хирургических вмешательствах:
пересадка органов и тканей;
миокард в хронической форме.
Средства с избирательным воздействием не мешают появлению защитных клеток при инфекционных заболеваниях и практически никак не сказываются на противоопухолевом иммунитете.
Разница между иммунодепрессантов и иммуностимуляторов
Иммунитет человека иногда нуждается в коррекции. В таком случае стоит прибегать к помощи особых лекарственных препаратов – иммунодепрессантов и иммуностимуляторов. Стоит понимать разницу между ними:
при продолжительном хроническом заболевании защитная функция организма нарушается и отмечаются аутоиммунные сбои, то есть происходит самоатака клеток. В этом случае необходима коррекция иммуносупрессорами. Их прописывают при разных аллергиях, чрезмерной работе лимфоцитных клеток, после пересадки тканей и органов;
при заражении вредными микроорганизмами запускается производство особых клеток. Если же их количества недостаточно, то человек заболевает. Для повышения выработки защитных клеток стоит использовать иммуностимуляторы. Как правило их нужно принимать при таких серьезных проблемах, как: хронические медленно протекающие заболевания с регулярными рецидивами, которые спровоцированы микробной и вирусной инфекцией.
Как видно, оба этих средства направлены на улучшение иммунитета индивида.
Можно сделать вывод, что эти препараты обладают широким действием и используются при различных заболеваниях и показаны при пересадке тканей и органов. К тому же у них нет побочных реакций, которые могли бы нанести вред здоровью и жизни человека. Вы также можете приобрести препараты для улучшения кровообращения через наш каталог.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Иммуносупрессоры из группы тиопуринов в лечении воспалительных заболеваний кишечника
Врачи
Иммуносупрессоры представляют собой важную группу препаратов, использующихся в лечении воспалительных заболеваний кишечника (ВЗК). К ним относятся так называемые тиопурины (препараты азатиоприн, 6-меркаптопурин и тиогуанин) и метотрексат. При тяжелом язвенном колите, не отвечающим на стероидные гормоны, используется также циклоспорин А.
Как ясно из названия, иммуносупрессоры оказывают супрессию (подавление) отдельных звеньев иммунитета, который при ВЗК избыточен, и тем самым снижают активность заболевания, а также поддерживают ремиссию язвенного колита (ЯК) и болезни Крона (БК). В этой статье рассмотрим часто используемую группу иммуносупрессоров – тиопурины.
Тиопурины (азатиоприн и 6-меркаптопурин) в лечении ВЗК
По механизму действия тиопурины относятся к антиметаболитам. Основное действие эти препараты оказывают на определенную подгруппу лейкоцитов, так называемые Т-лимфоциты, что приводит к снижению избыточного иммунного воспаления.
Согласно существующим международным и российским рекомендациям тиопурины не используются для достижения ремиссии ВЗК, поскольку их действие развивается медленно, достигая максимального эффекта через 3-4 месяца от начала лечения. Таким образом, основная «ниша» для этих препаратов – поддержание ремиссии БК и ЯК.
Показаниями для применения тиопуринов при БК являются:
1) поддержание ремиссии, которая достигнута на фоне терапии системными стероидами или биологическими препаратами при среднетяжелой и тяжелой БК различной локализации: терминальный илеит, илеоколит, колит, поражение верхних отделов ЖКТ, перианальная БК;
2) для профилактики послеоперационного рецидива БК.
Показаниями для применения тиопуринов при ЯК являются:
1) легкий или среднетяжелый ЯК, если у пациентов отмечаются ранние или частые рецидивы, несмотря на прием адекватных доз препаратов сульфасалазина или месалазина (или имеется их непереносимость);
2) поддержание ремиссии при гормонозависимом ЯК;
3) поддержание ремиссии в случае индукции ремиссии ЯК циклоспорином (или такролимусом);
4) у пациентов с ЯК, ответивших на препараты биологической терапии из группы антагонистов фактора некроза опухоли альфа (инфликсимаб), возможно использование тиопуринов для поддержания ремиссии в сочетании с этими препаратами.
Эффективность тиопуринов при ВЗК подтверждена клиническими исследованиями. Было показано, что эффективность тиопуринов в поддержании ремиссии БК составляет в среднем 73 %, а при ЯК – около 60%.
Ввиду того, что ни азатиоприн, ни 6-меркаптопурин не используются для индукции (достижения) ремиссии ВЗК, в случае обострения болезни их практически всегда назначают со стероидными гормональными препаратами. Такой подход позволяет снизить активность болезни и ее симптомы в результате действия стероидных гормонов. К моменту отмены этих препаратов тиопурины достигают своего максимального эффекта и далее используются для поддержания ремиссии ВЗК. Отдельное применение стероидных гормонов очень часто приводит к обострению БК при снижении дозы или отмене гормональных препаратов.
Применение тиуопуринов совместно с некоторыми препаратами генно-инженерной биологической терапии (например, с инфликсимабом) позволяет увеличить эффективность лечения путем снижения образования нейтрализующих антител к лекарственному средству.
1. Общие вопросы применения тиопуринов
Тиопурины, к которым относятся азатиоприн, 6-меркаптопурин и тиогуанин, при ВЗК применяются в таблетированном виде под различными коммерческими названиями уже более 30 лет. В России зарегистрированы таблетки азатиоприна и меркаптопурина по 50 мг, однако в Европе можно встретить азатиоприн с дозой 75 мг и 100 мг в одной таблетке.
Перед назначением какого-либо из этих препаратов врач оценивает характер течения болезни, эффективность и переносимость предшествующей терапии. Выбор препарата (азатиоприн или 6-меркаптопурин) остается на усмотрение врача, эффективность обоих лекарственных средств сопоставима. Иногда пациенты, не очень хорошо переносящие азатиоприн, могут себя лучше чувствовать при приеме 6-меркаптопурина. Выбор также определяется доступностью препаратов в аптечной сети.
Тиопурины, несмотря на название «иммуносупрессоры», не эквивалентны химиотерапии, которая используется для лечения онкологических больных. Препараты обычно хорошо переносятся, а возможные побочные эффекты подробно описаны, зависят от дозы препарата и нередко быстро исчезают после его отмены.
Пациентам с ВЗК тиопурины назначаются на длительное время при условии их эффективности и хорошей переносимости.
Что значит на длительное время? Как долго следует принимать тиопурины при ВЗК? Точная длительность лечения для болезни Крона и язвенного колита до сих пор не определена. Заболевания являются хроническими, поддерживающая терапия тиопуринами позволяет удержать ремиссию, а отмена препарата часто приводит к обострению.
Клинические исследования показали, что вероятность обострения БК в течение 6 месяцев после отмены тиопуринов варьирует от 8 до 25%, через 12 месяцев этот показатель достигает уже 17-53%, через 2 года – 31%, а через пять лет – 63%.
При ЯК одно контролируемое и три ретроспективных исследования показали высокую частоту рецидива заболевания после отмены тиопуринов: 35-77% в первый год и 65-75% по истечении 5 лет.
Отмена тиопуринов обсуждается индивидуально с пациентом с учетом клинической картины заболевания, частоты обострений, наличия осложнений и желания больного.
2. Нежелательные явления на фоне терапии тиопуринами.
Несмотря на ожидаемую пользу от назначения тиопуринов при ВЗК, их применение может ограничиваться развитием побочных эффектов. Нежелательные явления, связанные с приемом азатиоприна и 6-меркаптопурина, встречаются в 5-20% случаев. Ниже будут представлены некоторые наиболее значимые нежелательные явления при применении тиопуринов.
1) Идиосинкразия. Под термином “идиосинкразия” понимают генетически обусловленную патологическую реакцию на определенный лекарственный препарат. Идиосинкразическая реакция при приеме тиопуринов проявляется по разному: в виде лихорадки, болей в суставах, мышцах, озноба, желтухи, кожной сыпи и редко шока. Такие реакции редки и не являются характерными только для тиопуринов, они могут встречаться при приеме любого лекарственного препарата, порой, даже самого «безобидного» на первый взгляд. Этот тип непереносимости – очень редкий, развитие идиосинкразии невозможно предсказать никакими тестами.
2) Тошнота – встречается до 8% случаев при приеме тиопуринов. В отсутствии болей в животе и изменений со стороны таких показателей как липаза и панкреатическая амилаза крови, тошноту следует рассматривать как проявление индивидуальной непереносимости препарата. Ряд авторов рассматривают тошноту при лечении тиопуринами как частный вид идиосинкразии (см.выше). В случае появления тошноты пациенту могут быть даны рекомендации по изменению времени и кратности приема тиопуринов, а также замене азатиоприна на меркаптопурин. Выраженная стойкая тошнота может привести к отмене препарата.
3) Миелосупрессия. Одним из наиболее частых побочных эффектов, возникающих при лечении тиопуринами, является миелосупрессия, т.е. подавление роста клеток костного мозга. Она характеризуется развитием лейкопении (снижение лейкоцитов в крови) и/или тромбоцитопении (снижение тромбоцитов в крови) и отмечается в среднем в 7% случаев.
Уровень миелосупрессии всегда индивидуален и колеблется от незначимого понижения показателей на доли единиц (часто) до серьезного угнетения функций костного мозга (редко). Незначительное снижение уровня лейкоцитов/тромбоцитов обычно не имеет никаких проявлений и не угрожает здоровью и жизни пациента, если не прогрессирует. Это лишь «сигнал» для врача о том, что препарат потенциально может переноситься плохо при дальнейшем приеме в данной дозе. Если не предпринимать никаких действий, последующее снижение уровня лейкоцитов до очень низких значений может привести к развитию инфекционных осложнений. Очень низкий уровень тромбоцитов повышает риск кровотечений.
Известно, что назначение тиопуринов одновременно с месалазином (салофальк, пентаса, мезавант, месакол), сульфасалазином и некоторыми антибиотиками может увеличить риск развития лейкопении.
Единственным надежным методом диагностики этого состояния является регулярный контроль клинического анализа крови на протяжении всего времени приема тиопуринов. Известны случаи, когда снижение уровня лейкоцитов наблюдалось через год и более после начала приема препаратов, несмотря на то, что ранее все показатели были в норме.
Очень важно, чтобы пациент, длительно принимающий тиопурины (азатиоприн или 6-меркаптопурин) регулярно выполнял клинический анализ крови. Ведь низкий уровень лейкоцитов часто не вызывает никаких симптомов («лейкоциты не болят»), а узнать о нем поможет только анализ крови. Снижение дозы тиопуринов или отмена обычно ведет к восстановлению всех измененных показателей крови до нормы.
4) Острый лекарственный панкреатит и гепатит – достаточно редкие нежелательные явления при приеме тиопуринов, возникающие в 3-5% случаев. Острый лекарственный панкреатит и гепатит являются следствием индивидуального метаболизма лекарственного препарата.
При развитии острого лекарственного панкреатита отмечаются следующие симптомы: боли в верхних отделах живота и/или в левом подреберье, снижение аппетита, тошнота, редко – рвота. Лекарственное поражение печени в большинстве случаев не имеет специфических клинических проявлений, однако в ряде случаев возможно развитие желтухи, появление выраженной общей слабости и других симптомов.
Что нужно делать? Обычно определение некоторых показателей биохимического анализа крови (АЛТ, АСТ, панкреатическая амилаза, липаза) позволяет уточнить причину симптомов и выявить признаки лекарственного панкреатита/гепатита. При необходимости проводится УЗИ исследование печени или поджелудочной железы, реже компьютерная и магнитно-резонансная томография органов брюшной полости. При нетяжелом панкреатите симптомы обычно проходят быстро после отмены препарата или на фоне вспомогательной терапии.
В отличие от миелосупрессии (см.выше) лекарственный панкреатит и/или гепатит возникают в самом начале лечения. При хорошей переносимости препарата начиная с начала лечения описанные симптомы в дальнейшем не отмечаются, если доза препарата не была увеличена.
5) Инфекционные осложнения. Пациенты, принимающие азатиоприн или меркаптопурин, имеют больший риск развития инфекций по сравнению с лицами без терапии (в 2-3 раза), хотя общая частота инфекционных осложнений при приеме препаратов этой группы редко достигает 7%. Серьезные инфекции встречаются еще реже – до 2,5% случаев.
Обычно повышается частота вирусных инфекций (ОРВИ, но также и инфекция, обусловленная цитомегаловирусом, вирусом Эпштейн-Барра и т.д.), бактериальных и грибковых поражений. В целом, относительный риск инфекционных осложнений следует считать умеренным, при этом многие пациенты отмечают, что болеют ОРВИ и другими инфекционными заболеваниями не чаще, чем обычно.
Риск развития инфекций значительно возрастает при одновременном применении с азатиоприном/меркаптопурином стероидных гормонов и генно-инженерных биологических препаратов (биологической терапии).
Именно поэтому одной из рекомендаций перед плановым началом применения иммуносупрессоров является вакцинация от гриппа и пневмококковой инфекции, которая проводится только неживыми вакцинами. Пациента следует обследовать на вирусы гепатита В и С, ВИЧ-инфекцию до начала терапии.
6) Малигнизация. Малигнизацией называют процесс образования злокачественных опухолей. Известно, что прием тиопуринов повышает риск развития риск лимфопролиферативных заболеваний (лимфом) и рака кожи (кроме меланомы).
6.1. Тиопурины и риск развития лимфомы. Мета-анализ нескольких клинических исследований сообщает об увеличении относительного риска лимфом при применении тиопуринов в 5,7 раза [13]. Более наглядно выглядят расчеты A. Kandiel и соавторов: для того, чтобы развился один случай лимфомы в течение года, необходимо пролечить тиопуринами 4357 пациентов в возрасте 20-29 лет. А вот среди лиц старше 70 лет этот показатель сокращается до 1 случая лимфомы на 355 человек.
Одно из наиболее крупных исследований во Франции оценило риск развития лимфомы у 189 тысяч пациентов с ВЗК в течение 6 лет. Для пациентов, получающих тиопурины, риск был повышен в 2,6 раза по сравнению с лицами, не принимавших эти препараты. Однако в абсолютных цифрах это выглядит следующим: из 189 тысяч пациентов около 65 тысяч больных получали терапию тиопуринами, лимфома развилась у 84 человек (0,13%). Риск развития лимфомы значительно увеличивался (в 6 раз) при комбинации тиопуринов и антагонистов фактора некроза опухоли альфа (инфликсимаб, адалимумаб и т.д.).
Кроме того, установлено, что риск выше у молодых лиц (моложе 30 лет) и лиц старшей возрастной группы (особенно старше 60 лет), а также у мужчин по сравнению с женщинами.
Наконец, крупное исследование CESAME подтвердило увеличение риска развития лимфом при применении тиопуринов – он был выше в 5,28 раз (23 случая лимфомы у 19486 пациентов с ВЗК). Авторы установили, что после прекращения приема тиопуринов риск развития лимфом не отличался от среднестатистического. Более того, по данным Khan N. с соавторами наибольший риск наблюдался после терапии тиопуринами более 4 лет.
В данной статье не случайно уделено много внимания риску развития опухолевых заболеваний при приеме тиопуринов, поскольку именно этот раздел возможных нежелательных явлений вызывает наибольшее опасение пациентов.
6.2. Тиопурины и риск развития немеланомного рака кожи. К немеланомным ракам кожи относятся плоскоклеточный и базальноклеточный рак кожи. Данные клинических исследований свидетельствуют, что риск немеланомного рака кожи увеличивается при приеме тиопуринов в среднем в 2,3 раза. Согласно современным представлениям, наибольший риск развития немеланомного рака кожи у пациентов, принимающих азатиоприн или 6-меркаптопурин, отмечается в старшей возрастной группе (возраст > 60 лет), среди тех, кто не использует солнцезащитные кремы и часто загорает. Перечисленные факторы также актуальны и для лиц с ВЗК, не принимающих тиопурины. Большое значение имеет длительность приема препарата и суммарная доза принятого лекарства в период лечения.
Интересен факт, что применение тиопуринов при ВЗК имеет тенденцию к снижению риска развития колоректального рака, который высок у пациентов с длительным течением язвенного колита и (в меньшей степени) болезни Крона.
Примечание: Несмотря на большое количество информации о нежелательных явлениях азатиоприна и меркаптопурина (особенно в инструкции к лекарственному препарату) в целом эти лекарства переносятся неплохо, а при отсутствии указанных нежелательных явлений их польза значительно превышает потенциальный вред.
3. Тиопурины, беременность и грудное вскармливание
Известно, что активность ВЗК негативно влияет на течение беременности. Статистический анализ результатов исходов 2000 беременностей (1300 при язвенном колите, 700 при болезни Крона) показал, что в среднем 83% процента женщин с болезнью Крона и 85% женщин с язвенным колитом в ремиссии имели нормальное течение беременности. Частота пороков развития у детей составила 1%, что соответствует частоте среди здоровых лиц. Однако исследования показали, что эти значения меняются в худшую сторону у лиц с активным ВЗК в фазе обострения. Более того, у женщин с обострением заболевания во время беременности средняя продолжительность беременности была ниже, а дети имели меньший вес при рождении и меньшие значения баллов по шкале Апгар [21].
Таким образом, беременность с ВЗК в фазу ремиссии мало отличается от обычной, в то время как обострение увеличивает риск аномальной беременности.
Вопрос применения азатиоприна и меркаптопурина у беременных женщин с ВЗК в настоящее время активно изучается, а сведения о переносимости препаратов и их влиянии на плод постоянно дополняются.
Препараты этой группы относятся к группе D по шкале потенциальных рисков для плода при применении лекарственных препаратов, предложенной Управлением по контролю за продуктами и лекарствами Министерства здравоохранения США (U. S. Food and Drug Administration или FDA). Авторитет этого управления крайне высок в мире медицины и фармацевтики, FDA является своеобразным цензором качества и безопасности лекарственных препаратов не только в США, но и в мире.
Что означает присвоение препарату категории D?
Категория D — получены доказательства риска неблагоприятного действия лекарственного средства на плод человека, однако потенциальная польза, связанная с применением лекарственного средства у беременных, может оправдывать его использование, несмотря на риск.
То есть препараты этой категории, к которой относятся азатиоприн и меркаптопурин, должны назначаться после тщательной оценки риска и пользы.
Эксперты европейского общества по изучению болезни Крона и язвенного колита (ECCO), проанализировав существующие данные по безопасности применения тиопуринов при ВЗК, рассматривают эти препараты как средства с низким риском для беременной и плода.
Наиболее частые нежелательные явления, наблюдаемые у новорожденных на фоне терапии тиопуринами – анемия после рождения и меньший вес при рождении по сравнению с лицами без терапии. Остается неясным, вызваны ли эти изменения приемом матерью препаратов из группы тиопуринов, или обусловлены самим заболеванием. Эта неясность обусловлена запетом на клинические исследования препаратов в отношении беременных женщин, поэтому вся информация собирается и анализируется вне исследований.
Мета-анализ кинических исследований не выявил разницы между частотой нежелательных явлений у новорожденных при сравнении групп беременных с ВЗК, получавших и не получавших тиопурины. Описанные несколько случаев хромосомных мутаций и заболеваний крови единичны, и частота их возникновения сопоставима с популяционной (т.е. с частотой выявления у детей от здоровых матерей).
Таким образом, резюмируя имеющиеся сведения, можно сделать вывод о возможности применения азатиоприна и меркаптопурина у беременных женщин после тщательно оценки всех факторов риска, а также соотношения польза/риск.
Матери, принимающие тиопурины могут проводить грудное вскармливание детей, поскольку метаболиты азатиоприна и меркаптопурина практически не проникают в грудное молоко (выявляются лишь небольшие их следы), т.е. препараты в этот период малоопасны для ребенка.
Следует помнить, что несмотря на в целом неплохой профиль безопасности тиопуринов, беременность при этими препаратами должна быть планируемой, а не спонтанной.
4. Подготовка к началу приема тиопуринов
Тиопурины – не стероидные гормоны, их назначение не требует принятия неотложного решения. Поэтому до начала терапии тиопуринами у врача чаще всего есть время для того, чтобы получить всю необходимую информацию о пациенте.
Итак, какие данные необходимо иметь врачу до начала лечения препаратами этой группы?
1) Исходные параметры клинического анализа крови – позволяют оценить уровень лейкоцитов, эритроцитов и тромбоцитов до начала лечения;
2) Исходные значения некоторых показателей биохимического анализа крови (прежде всего, АЛТ, АСТ, билирубина, панкреатической амилазы и/или липазы).
3) Сведения о хронических инфекциях, включая вирусные гепатиты В, С, ВИЧ-инфекцию, цитомегаловирусную инфекцию и т.д.;
4) Данные рентгенологического исследования легких;
5) Данные ультразвукового исследования органов брюшной полости, а при наличии показаний – протокол компьютерной томографии или магнитно-резонансной томографии органов брюшной полости;
6) Информация о ранее проведенной вакцинации от вирусного гепатита В, пневмококка и вируса гриппа. При отрицательном статусе инфекции вирусного гепатита В пациенту следует рекомендовать провести вакцинацию от этого заболевания до начала терапии тиопуринами (если нет срочности в начале лечения).
5. Оценка переносимости тиопуринов после начала лечения
Обычно тиопурины назначаются в стартовой дозе 50 мг (1 таблетка) для оценки переносимости. При хорошей переносимости доза увеличивается до целевой. Для болезни Крона и язвенного колита целевая доза рассчитывается с учетом массы тела пациента и составляет для азатиоприна 2-2,5 мг/кг/сутки, для 6-меркаптопурина 1,0-1,5 мг/кг/сутки. Доза может изменяться лечащим врачом в случае развития побочных эффектов.
Всю суточную дозу препаратов рекомендуется принимать один раз в сутки независимо от еды. Однако при появлении тошноты нередко бывает эффективной рекомендация разделить суточную дозу на 2-3 приема и принимать препарат после еды. Также уменьшает вероятность развития тошноты прием всей дозы препарата на ночь (перед сном).
Прием тиопуринов в стартовой дозе. В этот период пациент оценивает переносимость препарата, ориентируясь на свое самочувствие. При появлении выраженной тошноты или рвоты, болей в животе (которые отсутствовали до начала терапии) препарат следует отменить, проконсультировавшись при наличии такой возможности с врачом. В ближайшее время следует выполнить клинический анализ крови, биохимический анализ крови (АЛТ, АСТ, билирубин, щелочная фосфатаза, амилаза панкреатическая и/или липаза, а также другие показатели, рекомендованные лечащим врачом) и обратиться за консультацией врача-гастроэнтеролога.
При хорошей переносимости стартовой дозы препарата через 5-7 дней (если не указаны другие сроки) следует также выполнить клинический и биохимический анализы крови, после чего – получить консультацию лечащего врача о возможности продолжения лечения препаратом. В клиническом анализе крови очень важным является уровень лейкоцитов (ввиду возможного развития лейкопении, см.выше), который не должен быть ниже 4,0 х 109/л. В биохимического анализе крови следует обратить внимание на возможное повышение уровня липазы/панкреатической амилазы, а также АЛТ, АСТ и билирубина, что может быть признаком лекарственного поражения поджелудочной железы или печени, соответственно.
Если самочувствие хорошее, анализы крови в пределах нормы через 7-10 дней возможно увеличение дозы доз целевой (полной). Доза рассчитывается исходя из массы тела пациента и определяется на приеме лечащим врачом. Такие же действия, как и при оценке переносимости стартовой дозы, следует предпринять в период приема полной дозы препарата.
При хорошей переносимости полной дозы препарата далее регулярно в течение всего времени приема тиопуринов сдаются анализы крови для контроля переносимости препарата. Кратность выполнения анализов определяется лечащим врачом, постепенно сокращаясь с 1 раза в неделю до 1 раза в 8-12 недель. При выявлении отклонений от нормы в анализах крови (прежде всего в уровне лейкоцитов, а также в значениях АЛТ/АСТ/билирубина/щелочной фосфатазы), необходимо в ближайшее время связаться с лечащим врачом или (в его отсутствие) с другим врачом терапевтом/гастроэнтерологом.
Ежегодно выполняется ультразвуковое исследование органов брюшной полости, почек и рентгенологическое исследование органов грудной клетки, а также осмотр лечащего врача. Женщинам необходим ежегодный осмотр гинеколога.
Памятка для пациентов, принимающих тиопурины.
1. Тиопурины (азатиоприн и меркаптопурин) относятся к препаратам для длительного приема при необходимости поддержания ремиссии болезни Крона и язвенного колита.
2. Тиопурины в целом переносятся довольно хорошо, серьезные побочные явления развиваются редко.
3. Большинство побочных эффектов исчезают после снижения дозы или отмены тиопуринов.
4. Прием тиопуринов требует регулярной оценки некоторых анализов крови даже при хорошем самочувствии на протяжении всего периода лечения
5. В случае появления некоторых симптомов во время лечения тиопуринами (лихорадка, кожная сыпь, насморк, кашель, выраженные боли в горле, выраженные боли в мышцах, сильная тошнота или рвота, боль в животе новой локализации, кровь в стуле, черный стул, носовое или десневое кровотечение) необходимо в ближайшее время связаться с лечащим врачом.
6. Во время применения тиопуринов запрещена вакцинация живыми вакцинами.
7. При применении тиопуринов нельзя загорать на солнце, следует пользоваться кремами для кожи с высокой степенью защиты от ультрафиолетовых лучей.
8. Ежегодно следует выполнять ультразвуковое исследование органов брюшной полости, рентгенологическое исследование органов грудной клетки.
9. Ежегодно должен проводиться осмотр кожных покровов для исключения злокачественных образований.
10. Женщины ежегодно должны осматриваться гинекологом.
11. Женщины, принимающие тиопурины, должны планировать беременность заранее.