что такое идеальный раствор
Идеальный раствор
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Реальные растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Смотреть что такое «Идеальный раствор» в других словарях:
идеальный раствор — Раствор, активности компонентов которого тождественно равны их мольным долям во всем интервале концентрации (от нуля до единицы) и производные от активностей по давлению и температуре при постоянных концентрациях равны нулю. [Сборник… … Справочник технического переводчика
идеальный раствор — – гипотетический раствор, в котором соблюдается равенство всех сил межмолекулярного взаимодействия. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
идеальный раствор — idealusis tirpalas statusas T sritis Standartizacija ir metrologija apibrėžtis Tirpalas, kurio sandų dalelės tarpusavyje nesąveikauja. atitikmenys: angl. ideal solution; perfect solution vok. ideale Lösung, f; vollkommene Lösung, f rus. идеальный … Penkiakalbis aiškinamasis metrologijos terminų žodynas
идеальный раствор — idealusis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, kurio komponentų dalelės tarpusavyje nesąveikauja. atitikmenys: angl. ideal solution; perfect solution rus. идеальный раствор … Chemijos terminų aiškinamasis žodynas
идеальный раствор — idealusis tirpalas statusas T sritis fizika atitikmenys: angl. ideal solution; perfect solution vok. ideale Lösung, f; vollkommene Lösung, f rus. идеальный раствор, m pranc. solution idéale, f; solution parfaite, f … Fizikos terminų žodynas
идеальный раствор — Раствор, активности компонентов которого совпадают с их мольными долями (за стандартное состояние принимается состояние чистого компонента) … Политехнический терминологический толковый словарь
раствор — РАСТВОР, а, муж. 1. Угол, образуемый раздвинутыми концами какого н. инструмента (лезвиями ножниц, ножками циркуля). Широкий р. 2. Отверстие между двумя открытыми створками окна, дверей, ворот. Стоять в растворе дверей. II. РАСТВОР, а ( у), муж. 1 … Толковый словарь Ожегова
индифферентный раствор — – идеальный электропроводный раствор, электрохимические свойства которого не влияют на результирующий диффузионный ток ячейки в заданном диапазоне потенциалов. Словарь по аналитической химии [3] … Химические термины
ОСМОС — (от греч. osmos толчок … Физическая энциклопедия
ИДЕАЛИЗИРОВАННЫЙ ОБЪЕКТ — (от греч. idea образ, идея) объект, мыслимый в понятии, образованном посредством идеализации. Напр., в науке такими объектами выступают материальная точка, идеальная жидкость, абсолютно твердое тело, идеальный газ, абсолютно черное тело и др.,… … Философская энциклопедия
идеальные растворы
Полезное
Смотреть что такое «идеальные растворы» в других словарях:
Растворы — [solutions] макроскопические однородное смеси > 2 веществ (компонентов), состав которых при данных внешних условиях может непрерывно меняться в некоторых пределах. Количественное соотношение компонентов в растворах определяет их концентрацией.… … Энциклопедический словарь по металлургии
растворы полимеров — [polymer solutions] термодинамически устойчивые однородные молекулярно дисперсные смеси полимеров и низко молекулярных жидкостей. В разбавленном растворе полимеров молекулы разделены. Усиление межмолекулярного взаимодействия с повышением… … Энциклопедический словарь по металлургии
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ — бинарные или многокомпонентные мол. системы, состав к рых может изменяться непрерывным образом (по крайней мере, в нек рых пределах). В отличие от растворов электролитов, в Р. н. (мол. р рах) заряженные частицы в сколько нибудь заметных… … Химическая энциклопедия
Растворы (химич.) — Растворы, макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В Р. все компоненты находятся в молекулярно дисперсном состоянии; они равномерно распределены в виде… … Большая советская энциклопедия
РАСТВОРЫ — РАСТВОРЫ, оптически и химически однородные жидкости, состоящие из двух (или большего числа) различного рода молекул. Если каждый из компонентов является жидкостью и оба они находятся в приблизительно одинаковом количестве, так что нет оснований… … Большая медицинская энциклопедия
Растворы — I Растворы макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В Р. все компоненты находятся в молекулярно дисперсном состоянии; они равномерно распределены в… … Большая советская энциклопедия
неидеальные (реальные) растворы — [actual (non ideal) solutions] растворы, не обладающие свойствами идеальных растворов. Для них выполняется соотношение: αi = γixi), где αi активность компонента A; γi коэффициент активности, зависящий от концентрации как данного, так и остальных… … Энциклопедический словарь по металлургии
твердые упорядоченные растворы — [ordered solid solutions] твердые растворы замещения с правильным чередованием компонентов в узлах кристаллической решетки или неполным статистическим распределением атомов по ее узлам. Для твердых упорядоченных растворов характерно появление… … Энциклопедический словарь по металлургии
твердые растворы — [solid solutions] однородные твердые однофазные вещества, состоящие из нескольких компонентов, концентрация которых может быть изменена без нарушения однородности. Понятие твердый раствор было введено в 1890 г. голландским химиком Вант Гоффом для … Энциклопедический словарь по металлургии
твердые пересыщенные растворы — [supersaturated solid solution] твердые растворы с концентрацией растворенного элемента выше, чем у насыщенного твердого раствора при данной температуре. Степень пересыщенности оценивают по разности или соотношению концентраций компонента в… … Энциклопедический словарь по металлургии
Идеальный раствор. Законы разбавленных растворов





Идеальный раствор. Законы разбавленных растворов
Оно дается определенными химическими взаимодействиями. Людмила Фирмаль
Существует большая теорема для этой концепции Практическая и практическая значимость. Я не владею большинством решений Сто сорок восемь Это совершенно идеальное свойство, но много их поведения достаточно Используя эту модель, например То, что называется разбавленным раствором, то есть содержимое растворяется По сравнению с содержанием растворителя, это вещество очень мало.
Рассмотрим разбавленный раствор нелетучего (твердого) вещества а в летучих веществах Жидкий растворитель в, например, водный раствор sugar. In в этом случае общее давление Насыщенный пар на растворе определяется парциальным давлением пара Поскольку давление паров растворенного вещества незначительно, растворитель Брить. Raul A886) — давление насыщенного пара растворителя решение ТС над чистым растворителем Р «.Разница p» — B = меньше Ap Называется абсолютный упадок!
Давление пара на раствор. Это количество Ссылаясь на давление паров чистого растворителя, te (p° — p) / p°= D»/» ° в Это называется относительным снижением давления пара. Согласно закону Рауля, относительное снижение давления насыщенного пара Растворителя над раствором равно молярной доле растворенного нелетучего вещества Вещество: Где xd = » A / («A 4-pv); xd-молярная доля растворенного вещества, а число Моль растворенного вещества; n ^ — молярное число растворителя.
Снижение давления паров на раствор нелетучих веществ, например Воду можно объяснить, используя принцип смещения равновесия ле Шато Body. In дело в том, что концентрация нелетучих компонентов возрастает. Раствор, равновесие воды в системе-насыщенный пар сдвинется в сторону Конденсации части пара(реакция системы на снижение концентрации влаги) Когда вещество растворяется), давление пара уменьшается. Снижение давления пара на раствор влияет на температуру замерзания、 Кипеть.
На рисунке 79 показана температурная зависимость вышеуказанного давления пара 2 раствора чистого растворителя и различных концентраций. Синяя кривая Yugupa Диаграмма 79.Температурная зависимость давления пара твердого тела и пара Различные концентрации жидких растворителей и растворов Температурная зависимость давления насыщенного пара Твердый растворитель, а кривая-аналогичная зависимость в чистом случае Жидкий растворитель. Кривые o’b ’и o’b’ отражают температурную зависимость Давление паров растворителя на раствор, вторая концентрация Вор превышает начальную концентрацию.
Точка о Для пропаривания над твердыми и жидкими растворителями、 Эти давления равны и температура плавления (замерзания) чистого Золя Тело. Таким образом, точки o ’и o’ являются точками замерзания растворителя в растворе I. И II, если чистый растворитель кристаллизуется из раствора. Пункты 6, 0.6′, b » Соответствует температуре кипения растворителя, раствора I и раствора II、
При этих температурах давление паров растворителя составляет Внешнее (атмосферное) давление.79, раствор замораживают следующим образом из рисунка Отверждается при более низкой температуре (T ’ 3, T^’) и более высокой температуре(T ^、 TQ чем чистые растворители(T°3 и T^, соответственно).Это p-кривая T решения проходит под аналогичной кривой решения Донора (согласно закону Рауля, p°> p ’> p») и p — Людмила Фирмаль
Метод испытания на замораживание и Показано, что ebrioscopies дают удовлетворительного результата не диссоциативного характера. Растворитель и низкая концентрация вещества Объем частиц незначителен. Очевидно, что концепция идеального решения является Определяется его концентрация, отсутствие взаимодействия является достаточным Комплектующие. Однако на практике большинство систем таковыми не являются Широкий диапазон концентраций соответствует идеальным условиям.
Не столько. Система включает в себя, в частности, низкое давление и некоторые газовые смеси Раствор неэлектролита и металла melts. At то же самое время там Категории решений, в которых могут быть использованы законы идеальных решений Он используется с достаточной точностью. Это так называемые разведения. Ры с низкой концентрацией растворенного вещества, тем самым Игнорируйте взаимодействие растворенных частиц.
Термодинамика не установлена Приводятся количественные критерии разбавления раствора. Единственный критерий Применимость идеального Закона этого диапазона Решение. Помимо явлений связанных с зависимостью давления пара от раствора、 Концентрация раствора, общие характеристики раствора также включают в себя penetration. In При изучении феномена проникновения широко используется полупроницаемая мембрана перегородки- Ки (мембрана и диафрагма).
Их характеристики Молекулы растворителя проходят через него, но растворенные частицы удерживаются Вещество. Полупроницаемые перегородки играют очень важную роль Важный процесс организма. Рассмотрим закрытый цилиндр, который разделен поршнем на 2 части. Это полупроницаемая перегородка, которая позволяет только Витор (рис. 80).Растворитель расположен на дне и верхней части Решение. Для различий в концентрации растворителя с обеих сторон дистилляции Он рожает добровольно(по принципу Ле-Шателье) Поместите его в раствор через полупроницаемую мембрану и разбавьте.
Движущая сила Основной диффузией растворителя в раствор является、 Энергия чистого растворителя и растворителя в растворе. При разведении Раствор со спонтанной диффузией растворителя Объем раствора увеличивается, и поршень С позиции I на позицию II. Явление селективной диффузии некоторых разновидностей Частицы в растворе через полупроницаемую мембрану Это называется осмос. И сила, которая вызывает проникновение.
За счет единичной поверхности полупроницаемого мема-и-Т Мозг называется осмотическим давлением. Ван Гоф Показано, что осмотическое давление в растворе неэлектрическое. Литий, пропорциональный молярной концентрации растворенного вещества Вещество: p = ЭЛТ、 Рис. 80.Концепции Vii. 1) проникновение Сто пятьдесят один Где c = n / V-молярная концентрация, моль / л. представление вида (VII. One) Уравнение идеального газа Клапейрона-Менделеева (II.1), а также、
Однако, эти формулы объясняют различные процессы. Осмотическое давление Когда дополнительное количество раствора проникает внутрь, он прилипает к раствору Рецидивист через полупроницаемую перегородку. Это давление、 Дальнейшее равновесие концентрации. По формальной аналогии, Want-Toff A887) смог сформулировать закон Осмотическое давление: осмотическое давление равно этому давлению Когда недо-сообщенный в форме идеального газа, он производит растворенное вещество Объем, который занимает раствор при той же температуре, практически отсутствует. Все описанные законы связаны с идеалом бесконечного разрежения Ворье. Охват применения к фактическому решению значительно ограничен、 Чем выше концентрация раствора.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
22. Идеальные растворы. Закон Рауля и следствия из него. Фазовые диаграммы воды и водного раствора. Понятие об осмосе, уравнение Вант-Гоффа.
Существует несколько классификаций растворов. С точки зрения термодинамики целесообразно различать растворы идеальные и неидеальные или реальные. В идеальных растворах внутренняя энергия каждого компонента не зависит от концентрации, и молярный объем не изменяется при растворении. Компоненты при этом смешиваются как идеальные газы, и увеличение энтропии можно рассчитать по уравнениям, характерным для идеальных газов. Здесь сил взаимодействия между частицами нет, и вещества смешиваются без выделения или поглощения теплоты.
При исследовании растворов широко пользуются методом моделей. Простейшей моделью является идеальный раствор. Идеальные растворы делят обычно на две группы: разбавленные (более точно бесконечно разбавленные) и совершенные.
Образование идеального раствора не сопровождается изменением объема, тепловым эффектом, химическим взаимодействием. Такие растворы образуются в результате простого физического смешения
(ΔНсм = 0; ΔVсм = 0). Такие растворы получаются смешиванием неполярных жидкостей, характеризующихся близкими по силе молекулярными полями. В таких смесях отсутствуют явления сольватации, а отсюда нет и теплового эффекта растворения, нет и концентрации системы. Объем раствора равен сумме объемов смешиваемых компонентов. Это и есть идеальные или совершенные растворы.
Роль их в теории растворов аналогична роли идеальных газов (потому их и называют идеальными растворами).
Идеальные растворы довольно распространены. Пример: смешивание изомеров углеводорода (октаны и др.). Бензин, керосин, смесь бензола и толуола –идеальные растворы, представляют собой смесь различных углеводородов (жидких). Идеальные растворы имеют характер простых молекулярных смесей. К ним подходит «физическая» теория растворов. Физическая теория растворов предложена Вант-Гоффом и Аррениусом в 19 в. Согласно этой теории растворитель рассматривается как среда, в которой при растворении вещества его молекулы равномерно размещаются по всему объему раствора, межмолекулярные взаимодействия отсутствуют.
Законы Рауля. Важнейшей характеристикой вещества, находящегося в жидком состоянии или твердом является давление насыщенного пара, это давление – константа вещества, определяющая равновесие жидкость пар, твердое вещество пар. Само равновесие достигается, когда процессы испарения компенсируется процессами конденсации. При нагревании давление пара возрастает.
Для разбавленных растворов относительное понижение давления пара растворителя (А) численно равно мольной доле растворенного вещества (В) (первый закон Рауля).
Так как для любого раствора сумма мольных долей Х А + Х В = 1, то формула будет
Таким образом, для разбавленных растворов давление пара растворителя пропорционально его мольной доле в растворе.
Из закона Рауля возникает два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышение температуры кипения ΔТкип пропорционально моляльности раствора: сm. ΔТкип= Кэ сm где Кэ – эбулиоскопическая постоянная растворителя
Диаграмма состояния представляет собой графическое изображение зависимости между различными величинами, характеризующими состояние системы. Для однокомпонентных систем обычно используют диаграммы состояния, показывающие зависимость между давлением и температурой. Они называются фазовыми диаграммами состояния. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару. Все три кривые пересекаются одной точке О. координаты этой точки – это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки.
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом.
Растворы
4.1. Идеальные и реальные растворы
Истинными растворами называются однофазные гомогенные системы, состав которых может непрерывно меняться в определенных пределах. Истинные растворы образуются из молекул или ионов двух или более веществ.
Рассмотрим термодинамические закономерности образования жидких растворов в двухкомпонентной системе.
Все растворы, которые не подчиняются термодинамическим закономерностям идеальных растворов, называются реальными.
4.2. Давление насыщенного пара компонентов над раствором. Закон Рауля
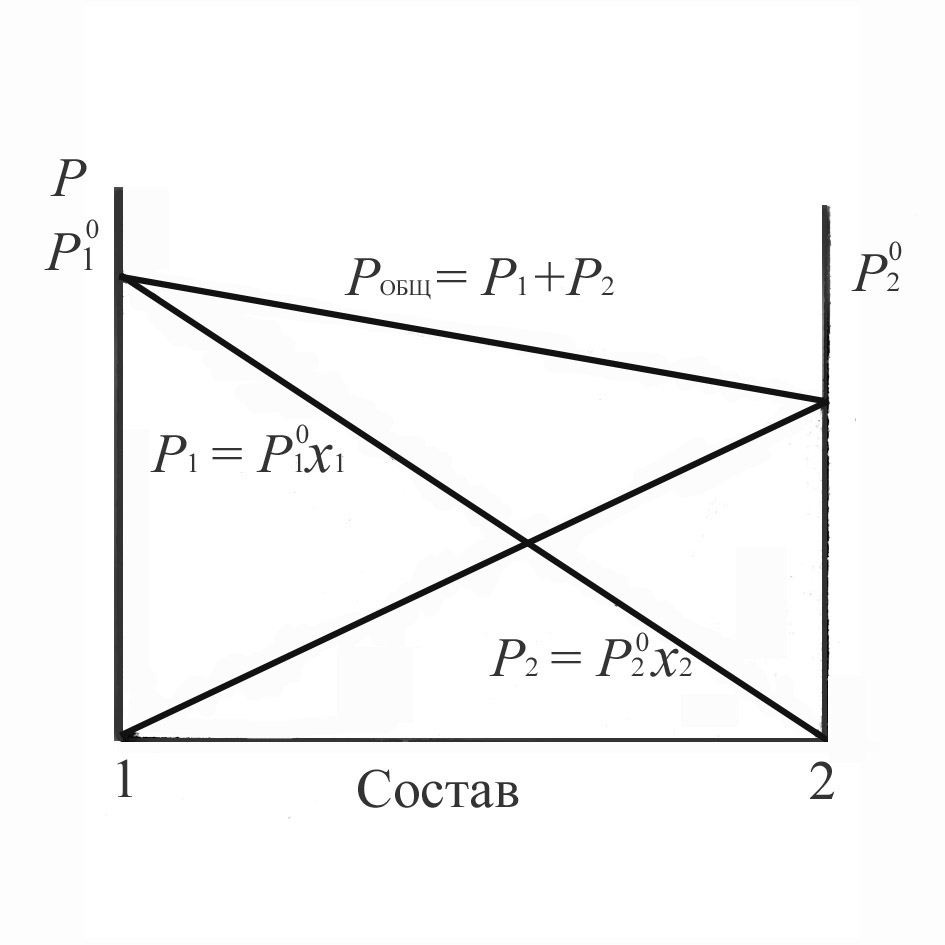
Из закона Рауля следует, что парциальное давление пара компонента над раствором увеличивается прямо пропорционально его концентрации в жидком растворе. Графически эта зависимость представлена на рис. 4.1.
Рис.4.1. Парциальные (p1 и p2) и общее давления пара идеальной смеси двух летучих жидкостей.
Закон Рауля можно записать в другой форме:


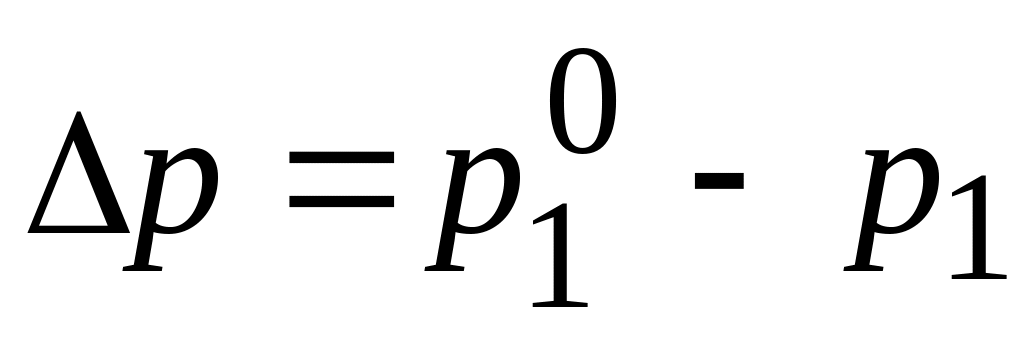
Это уравнение показывает, что относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества.
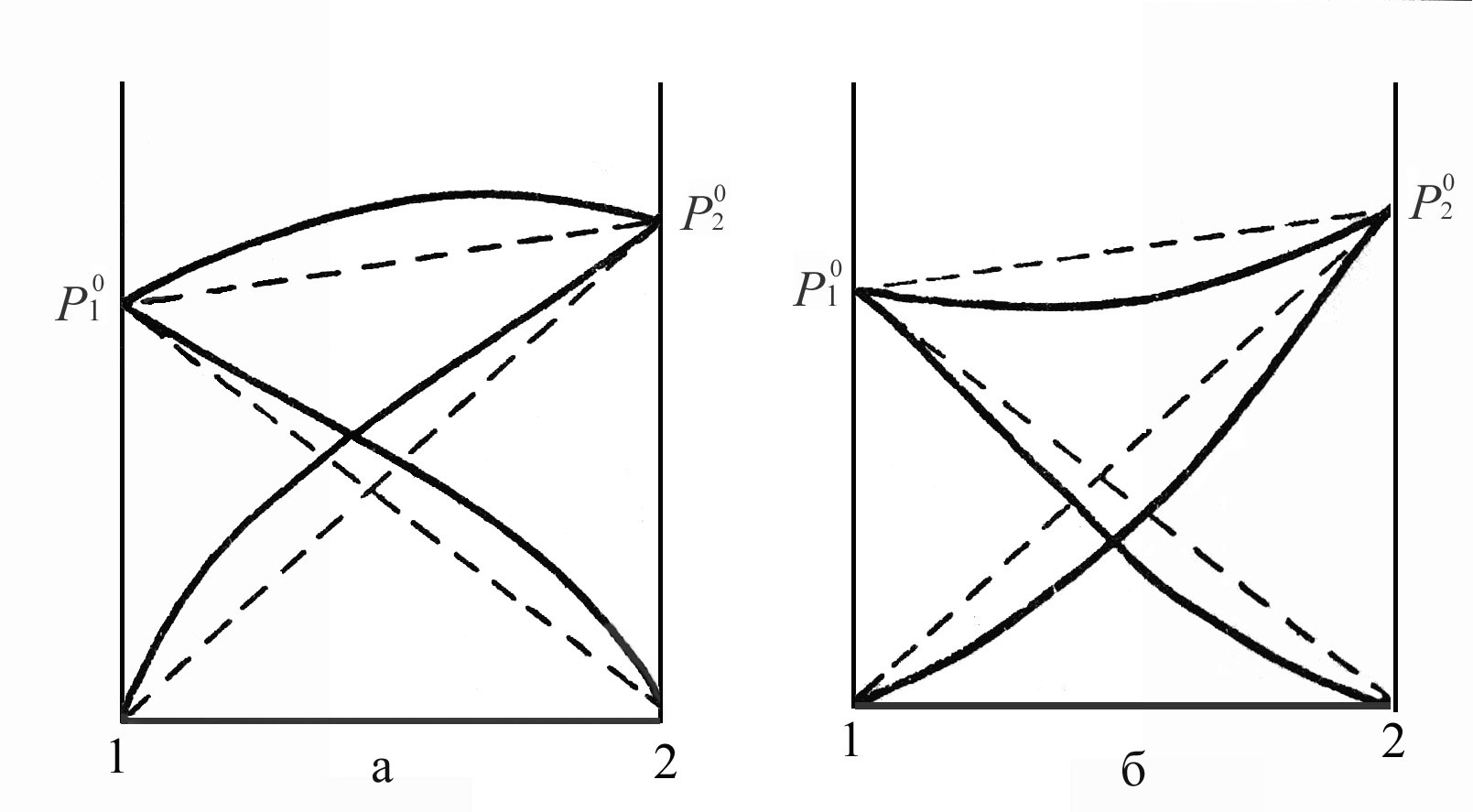
Для реальных растворов закон Рауля не выполняется. Отклонения от закона Рауля наблюдаются в растворах веществ, сильно отличающихся своими свойствами. В таких растворах силы межмолекулярного взаимодействия между однородными и разнородными молекулами могут существенно различаться. При этом, если разнородные молекулы взаимодействуют слабее однородных, то смешение компонентов ослабляет общие молекулярные взаимодействия и облегчает выход молекул из раствора в пар. Давление пара в этом случае будет больше, чем следует из закона Рауля (положительные отклонения от закона Рауля). При образовании такого раствора смешение компонентов сопровождается поглощением тепла ( 

Если разнородные молекулы взаимодействуют сильнее однородных, то смешение компонентов усиливает межмолекулярное взаимодействие, выход молекул в пар затрудняется, и результатом являются отрицательные отклонения от закона Рауля (Рис.4.2.) Они характеризуются выделением тепла ( 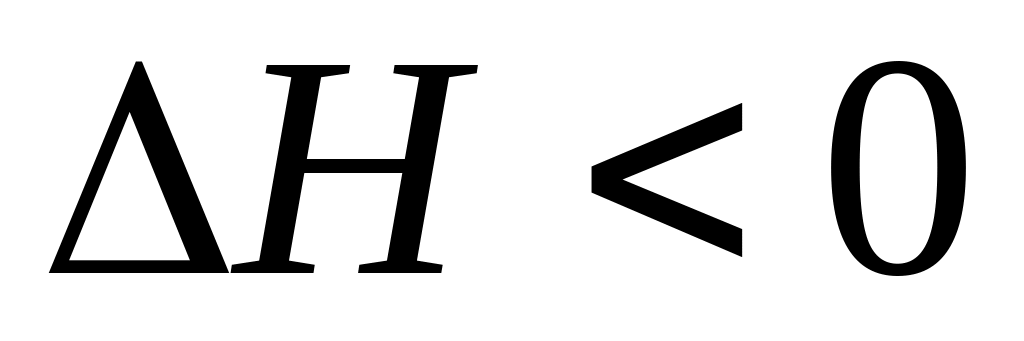

Рис.4.2. Парциальные и общее давления пара растворов с положительными (а) и отрицательными (б) отклонениями от закона Рауля.
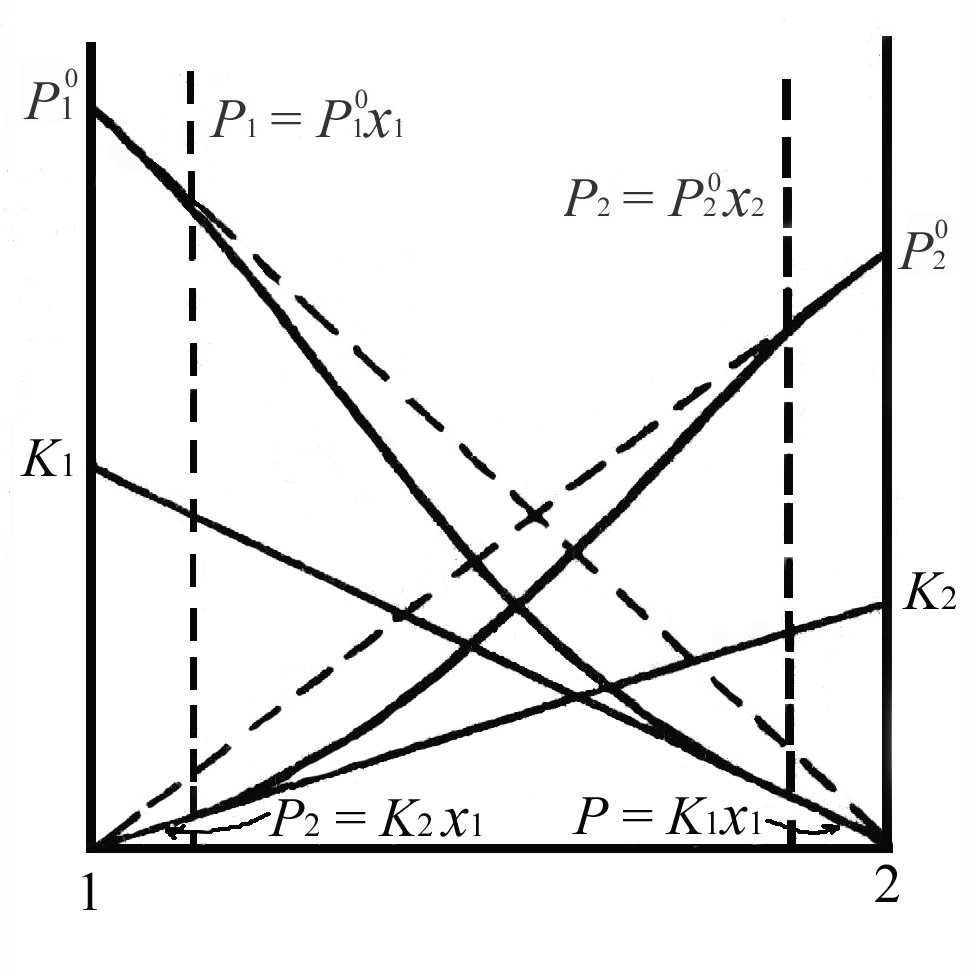
Рис.4.3. Диаграмма, иллюстрирующая выполнение законов Рауля и Генри для предельно разбавленных растворов.