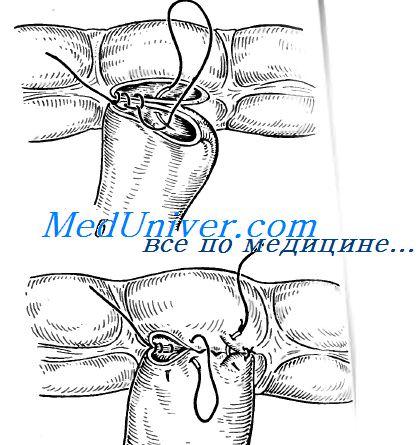
что такое грануляция анастомоза
Грануляция вокруг стом: как лечить?
Время чтения: 3 мин.
Грануляция — это разрастание ткани вокруг стомы. Как только в стому вставляют трубку или катетер, организм старается зарастить пространство вокруг инородного объекта. Из-за этого вокруг стомы образуется грануляционная ткань, красного или розового цвета. Она может болеть, воспаляться и подкравливать.
Грануляция вокруг гастростомы
Грануляция вокруг гастростомического отверстия — одно из осложнений установки, периода заживления раны, длительного стояния трубки. Она не опасна и не указывает на инфекционные процессы, но за ней нужно внимательно следить.
Будет ли расти грануляция вокруг гастростомы, зависит от ухода и обработки: держите трубку и кожу в чистоте и сухом состоянии, мойте водой с мылом, промывайте чистой водой, хорошо просушивайте на воздухе, следите, чтобы не сдавливались края стомы. Держать кожу в сухом состоянии и без сдавления (расстояние от наружного фиксатора до кожи 0,3-0,5 см) принципиально важно, чтобы грануляция не росла.
Если вовремя не лечить грануляцию, то она разрастается, превращается в сочащееся объемное образование, которое не дает коже плотно обхватить трубку. Поэтому содержимое желудка начинает подтекать, раздражает кожу, она краснеет и болит. Иногда может присоединяться инфекция и развиваться целлюлит подкожно-жировой клетчатки вокруг гастростомы.
Из-за чего вокруг стомы появляются грануляции?
Грануляция может развиться, если обрабатывать место вокруг стомы перекисью водорода, спиртовыми антисептиками, подкладывать салфетки, которые сдавливают и нарушают воздухообмен, способствуют росту анаэробной и грибковой флоры. Также этому способствует плотное прижатие наружного фиксатора к коже, подтекание.
Необходимо насторожиться, если ткань меняет текстуру или цвет, подкравливает.
Как лечить грануляцию вокруг гастростомы?
Чем раньше вы выявите грануляцию, тем эффективнее и легче будет ее лечить.
Грануляция вокруг трахеостомы
Грануляции в области трахеостомы образуются как снаружи, так и под ней, в подсвязочном пространстве. Они могут появиться, если есть хроническая инфекция, постоянно подтекает мокрота, кожа травмируется во время операции и от хронического ношения трубки, если края стомы сдавливаются салфетками и шейным ремешком, жесткой трахеостомической трубкой.
Как лечить наружную грануляцию вокруг трахеостомы?
Серебряные салфетки. Фото: market.yandex.ru
Как лечить внутреннюю грануляцию в области трахеостомы?
Если происходит обтурация (закупоривания просвета трахеи на 50-75%) или подкравливание, трудности с заменой трубки, нужно пройти эндоскопическое обследование трахеи, чтобы найти внутреннюю грануляцию. Если она есть, хирург ее удаляет, потому что грануляция может начать кровить, мешать разговаривать (продуцировать голос), может вызвать респираторный дистресс (дыхательную недостаточность).
Если внутренняя грануляция маленькая и не закупоривает просвет трахеи, ее не удаляют, потому что высок риск рецидива. Наиболее эффективный метод лечения внутренней грануляции и ее удаления порекомендует ЛОР-врач.
Если этих симптомов нет, проходите обследование ежегодно.
Создано с использованием гранта Благотворительного фонда «Абсолют-Помощь»
Использовано стоковое изображение от Depositphotos.
Что такое грануляция анастомоза
Послеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы).
Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%).
а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита).
б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение.
в) Обследование несостоятельности анастамоза кишечника
Необходимый минимальный стандарт:
• Оценка общего состояния больного: тахикардия (изначально может быть единственным симптомом), сепсис с дисфункцией органов, нестабильность гемодинамики, нутритивный статус и т.д.
• Обследование живота: перитонеальные симптомы без четкой локализации, кишечные свищи, состояние раны.
• Несостоятельность заподозрена, но не подтверждена: ирригоскопия с водорастворимым контрастом, КТ.
Сопутствующие факторы, влияющие на принятие решения:
• Ретроспективный анализ интраоперационных трудностей.
• Текущее состояние больного (общее, местное)?
• Несостоятельность: отграниченный или разлитой перитонит?
• Шансы на успех при формировании повторного анастомоза?
• Время, прошедшее после последней лапаротомии?
г) Ведение пациента с несостоятельностью анастамоза кишечника
Консервативное ведение:
• Отграниченная несостоятельность => дренирование абсцесса под контролем КТ => отграниченный свищ.
• Несостоятельность при отключенной кишке => повторное обследование через 6-12 недель.
• Несостоятельность с сепсисом => поддерживающие меры в дополнение к операции: НГЗ, антибиотикотерапия, оптимизация сердечной деятельности и функции дыхания.
• Ранняя симптоматическая несостоятельность ( релапаротомия для поиска дефекта:
— Отключение и дренирование.
— Разобщение анастомоза, формирование стомы (по типу операции Гартссмана).
— Повторное формирование анастомоза (с/без отключения).
— Ригидность стенки кишки в результате воспаления => ни резекция, ни формирование стомы не выполнимы => ушивание дефекта/дренирование или установка дренажа в зоне несостоятельности с целью формирования хорошо отграниченного свищевого хода.
• Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии:
— Проксимальная стома (если возможно).
— Попытка воздействия на сепсис => установка дренажей (открытая или под контролем КТ) => попытка формирования хорошо отграниченного свищевого хода.
— Разлитой перитонит/сепсис => санационная лапаротомия с широким дренированием.
Видео промывания желудка через назогастральный зонд у взрослого
(оставленный зонд может использоваться для трансназального питания)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое грануляция анастомоза
Лучшее — враг хорошего, а первое впечатление наилучшее, зачем же его портить?
Идеальный анастомоз
Идеален тот кишечный анастомоз, который герметичен, а утечки (относительно редкие) представляют собой смертельно опасную беду. Кроме того, анастомоз не должен быть сужен, он обеспечивает нормальное функционирование ЖКТ даже в первые дни после его сформирования.
Каждый опытный хирург полагает, что именно его техника наложения анастомозов, которую он усвоил от своих учителей и закрепил собственным опытом, — «наилучшая». В практике применяют много методов: конец в конец, конец в бок или бок в бок; одно- или двухрядный шов, узловой или непрерывный, с применением плетеных или монофиламентных, рассасывающихся или нерассасывающихся нитей; а также мы даже знаем хирургов зараженных навязчивой идеей наложения анастомоза трехрядным узловым швом. Ко всему перечисленному добавим степлеры. Чему же отдать предпочтение?
За и против анастомоза
Большое количество экспериментальных и клинических исследований позволяет сделать следующие заключения.
Утечки (несостоятельности) анастомоза. Расхождение анастомозов встречается независимо от методов их формирования, даже если они наложены без натяжения и при хорошем кровоснабжении анастомозируемой кишки.
Стриктуры (сужения) анастомоза. Однорядные анастомозы менее подвержены рубцовым сужениям, чем многорядные. Стриктуры чаще также осложняют анастомозы конец в конец, наложенные циркулярным степлером.
Неудачи наложения анастомоза. В целом степлеры более склонны к интраоперационным «осечкам»
Скорость наложения анастомоза. Механические анастомозы степлерами в среднем выполняются быстрее, чем ручным швом. Чем меньше слоев, тем быстрее накладывается анастомоз, а непрерывный шов занимает меньше времени, чем узловой. В целом на наложение двух кисетных швов для степлерного анастомоза нужно столько же времени, как для однорядного ручного непрерывного шва.
Шовный материал для анастомоза. Плетеные нити (шелк или викрил) пропиливают ткани и (по крайней мере в эксперименте) чаще вызывают воспаление и активацию коллагеназ, чем монофиламентный материал (полидеоксанон — ПДС или пролен). Хромированный кетгут слишком быстро рассасывается, чтобы обеспечить прочность анастомоза. Монофиламентная нить легче проскальзывает сквозь ткани и при непрерывном шве лучше распределяет натяжение вдоль всей окружности анастомоза.
Стоимость наложения анастомоза. Степлеры значительно дороже обычного шовного материала таким образом, материально более затратны. Вообще говоря, чем меньше используется шовного материала, тем дешевле обходится анастомоз, а наиболее экономичен однорядный непрерывный шов.
Что такое грануляция анастомоза
Введение. Острая кишечная непроходимость стабильно занимает ведущее место в структуре хирургической летальности, являясь одним из наиболее тяжелых осложнений заболеваний и повреждений органов брюшной полости, имеющая клиническую картину самостоятельного заболевания и представляющая собой комплекс нарушений со стороны всех органов и систем организма из-за развития энтеральной недостаточности [2, 4, 5].
Заживление кишечного анастомоза, формированного в условиях острой кишечной непроходимости, безусловно, протекает в отягощенных условиях из-за факторов, препятствующих нормальному течению процесса регенерации [1].
В настоящее время важное значение в замедлении заживления тканей кишечного анастомоза отводится энтеральной недостаточности, при которой пролонгируется эндогенная интоксикация, происходит транслокация микроорганизмов в крово- и лимфоток, а также в свободную брюшную полость [6].
В последние годы особый интерес представляют сведения о значимости процесса перекисного окисления липидов в заживлении кишечного анастомоза в отягощенных условиях, в частности при перитоните [3]. Показано, что этот патологический процесс может быть одним из значимых в срыве репаративной регенерации, а активность его зависит от многих факторов, в том числе от конструкционных особенностей соустья [1, 4].
Целью исследования явилось изучение процесса заживления тканей толстокишечного анастомоза в условиях острой кишечной непроходимости; установление сопряженности течения репаративного процесса с изменениями метаболизма регенерирующих тканевых структур.
Материалы и методы исследования. В основу работы положены результаты хронических опытов на 25 взрослых беспородных собаках, которые разделены на 2 группы. В первой группе (n=10) изучалось заживление толстокишечного анастомоза после резекции толстой кишки в неосложненных условиях. Во второй группе (n=15) исследовалось заживление толстокишечного анастомоза после резекции толстой кишки в условиях острой кишечной непроходимости.
Экспериментальные опыты проводились в соответствии с нравственными требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., приказ МЗ РФ от 19.06.2003 г. № 267 «Об утверждении правил лабораторной практики»), одобрены локальным этическим комитетом.
Эксперименты проведены по следующей схеме. Животным первой группы под наркозом выполняли срединный разрез вентральной стенки брюшной полости. В рану выводили толстую кишку, производили резекцию на протяжении 6–8 см, а затем восстанавливали непрерывность желудочно-кишечного тракта путем наложения кишечного анастомоза «конец в конец». Брюшную полость ушивали наглухо.
Во второй (контрольной) группе животным под наркозом выполняли срединный разрез вентральной стенки брюшной полости. В рану выводили толстую кишку, на расстоянии 8–10 см от ануса ее перевязывали толстой лигатурой, создавая кишечную непроходимость. Брюшную полость ушивали наглухо. Через 2-е суток выполняли релапаротомию, резекцию кишки на протяжении 6–8 см, наложение первичного анастомоза «конец в конец», ушивали наглухо брюшную полость.
При формировании анастомоза во всех группах опытов был использован классический двухрядный шов Ламбера – Альберта. Оба ряда соустья образовывали узловым викриловым (3/0 – 4/0) швом: внутренний ряд – через все слои кишечной стенки; наружный ряд – серозно-мышечный. Брюшную полость промывали изотоническим раствором хлорида натрия (0,89 %) и ушивали наглухо.
Во время операции после резекции толстой кишки и формирования кишечного соустья, а также на контрольных этапах периода наблюдения оценено функционально-метаболическое состояние тканей кишки в зоне анастомоза. С этой целью изучен их электрогенез путем измерения окислительно-восстановительного потенциала (редокс-метрия) и оценена диффузионная способность тканей для кислорода путем определения коэффициента диффузии кислорода. Для этого электрод (платиновый) помещали в ткани области анастомоза по его периметру в пяти точках. Полученные данные позволяли оценить трофику тканей соустья сразу же после его формирования и в динамике раннего послеоперационного периода.
В послеоперационном периоде животным указанных групп проводили антибактериальную и инфузионную терапию: внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки 5 % раствор глюкозы и 0,89 % раствор хлорида натрия из расчета 50 мл/кг.
В раннем послеоперационном периоде наблюдали за общим состоянием животного, его поведением, аппетитом, характером и частотой стула, измеряли температуру тела, пальпировали брюшную полость. Этапы периода наблюдения за животными: 1, 3, 5, 7-е сутки. В контрольные этапы наблюдения животным под наркозом производили релапаротомию.
В работе использовали следующие методы исследования.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием критерия t Стьюдента. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение. Отметим, что выбранный способ воспроизведения острой кишечной непроходимости полно и адекватно моделирует исследованную патологию. Наложение лигатуры на толстую кишку через двое суток приводило к формированию выраженной острой обтурационной толстокишечной непроходимости. Клинически отмечались основные признаки илеуса. В раннем послеоперационном периоде у животных отсутствовал стул, отмечалось увеличение живота, в ряде случаев была рвота. Подопытные животные отказывались от пищи, но воду охотно принимали. Они постоянно лежали, с трудом передвигались по вольеру.
Под внутривенным тиопентал-натриевым наркозом (0,04 г/кг веса) животным выполнялась операция: устранение острой кишечной непроходимости путем резекции толстой кишки с последующим восстановлением непрерывности желудочно-кишечного тракта посредством анастомозирования. При релапоротомии в брюшной полости выявлялось незначительное количество серозного экссудата. Толстая кишка выше препятствия была увеличена в диаметре за счет скопления в ней большого количества содержимого твердого характера.
Толстую кишку мобилизовывали в зависимости от массы животного на протяжении от 10 до 15 см: 2–3 см ниже зоны препятствия и 6–10 см – выше обтурации. В указанном объеме производили резекцию толстой кишки, а затем восстанавливали непрерывность пищеварительной трубки путем формирования толстокишечного анастомоза по типу «конец в конец». Брюшную полость промывали изотоническим раствором хлорида натрия (0,89 %) и ушивали наглухо.
При исследовании резецированного отдела толстой кишки выявлено, что в зоне наложения лигатуры в стенке органа возникали достаточно выраженные воспалительные явления как со стороны серозной, так и слизистой оболочек.
Отметим, что в приводящем отделе толстой кишки (выше зоны обтурации) видимые макроскопические изменения были особенно выраженными, причем как со стороны серозной, так и слизистой оболочек.
Хирургическую операцию животные перенесли удовлетворительно. Через 2–3 ч после вмешательства собаки просыпались. Они лежали в клетке, мало реагировали на попытку контакта с ними, не пытались встать. Через 12–18 ч начинали лакать воду.
Через одни-двое суток после хирургического вмешательства собаки поднималась, у них была одышка, повышалась температура тела до субфебрильных или фебрильных цифр (реже).
В первые двое-трое суток у собак отмечалось увеличение живота из-за вздутия, задержка стула и газов – признаки послеоперационного пареза кишечника. В последующие сроки состояние подопытных животных заметно улучшалось, регистрировались признаки активизации кишечной деятельности. Они начинали принимать пищу, передвигаться по вольеру, появлялся стул, который был полуоформлен с незначительным количеством крови и слизи.
Нами, как указано выше, изучен процесс заживления тканей по линии толстокишечного анастомоза в динамике. Оказалось, что заживление толстокишечного соустья протекало по типу вторичного натяжения или приближалось к этому типу.
При релапаротомии через сутки после операции резекции толстой кишки и формирования анастомоза установлено, что в брюшной полости имелся выраженный спаечный процесс. К области анастомоза были припаяны пряди большого сальника, которые легко отделялись от толстой кишки. В брюшной полости имелось незначительное количество экссудата серозного характера, который располагался в области анастомоза и малом тазу.
В области анастомоза после отделения спаек от толстой кишки выявлялись обширные кровоизлияния и гиперемия тканей. Видимых дефектов по линии швов не определялось.
На аутопсии во время исследования толстой кишки со стороны слизистой оболочки выявлено, что по линии швов вершины шовного валика, который был ориентирован в просвет органа, имелись участки некроза тканей с образованием обширного тканевого (язвенного) дефекта. Эти явления особенно четко определялись в области наложения внутреннего ряда швов.
Через трое суток после операции при оценке морфологического состояния брюшной полости выявлено, что в ней регистрировался достаточно выраженный спаечный процесс, особенно в области толстокишечного соустья. При отделении спаек от толстой кишки выявлено, что по линии швов анастомоза конец в конец со стороны серозной оболочки воспалительные явления сохранялись. Эта область кишечника была гиперемирована, с участками кровоизлияний, покрыта фибрином, особенно по линии швов.
При исследовании зоны толстокишечного анастомоза со стороны слизистой оболочки по линии швов определялся выраженный язвенный дефект, воспалительные явления в тканях, прилежащих к области соустья, уменьшались.
Через 5–7 суток после операции воспалительные явления в брюшной полости и толстой кишке, несущей анастомоз, существенно уменьшались. При релапаротомии установлено, что спаечный процесс регистрировался во всех случаях. К этому сроку раннего послеоперационного периода в брюшной полости экссудата не обнаруживалось. При разделении спаек по линии швов наружного ряда отмечались явления гиперемии, кровоизлияний.
Следует подчеркнуть, что толстокишечный анастомоз конец в конец, формированный по способу Ламбера – Альберта в условиях толстокишечной непроходимости, не всегда оказывался надежным. В трех наблюдениях отмечена несостоятельность швов с развитием местного или общего перитонита.
На аутопсии двух животных при разделении спаек по линии швов выявлен некроз тканей с развитием дефекта в стенке толстой кишки. Отметим, что в начальные сроки после операции дефект в стенке ограничивался спаечным перипроцессом. Поэтому общего перитонита у этих животных не возникало.
Таким образом, в условиях острой толстокишечной непроходимости после резекции толстой кишки и формирования первичного двухрядного анастомоза по способу Ламбера –Альберта заживление соустья протекало по типу вторичного натяжения и с развитием в ряде случаев несостоятельности швов.
Перед нами стояла задача исследовать причины такого неблагоприятного течения репаративного процесса в отягощенных острой кишечной непроходимостью условиях. Для решения этой задачи применены биофизические исследования, оценивающие трофику тканей по линии соустья. Такого рода исследования позволили достаточно углубленно определить сопряженность репаративного процесса с трофикой тканей регенерирующих структур.
Уже во время операции после резекции толстой кишки и формирования кишечного соустья выявлены существенные нарушения трофики тканей анастомоза. Установлено, что окислительно-восстановительный потенциал в области соустья после его формирования существенно падал и составил –48,14 ± 1,24 мВ, что было ниже нормы на 27,2 % (р
Что такое грануляция анастомоза
НИИ онкологии им. Н.Н. Петрова Минздравсоцразвития России; Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург
ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург, Россия
ГБОУ ВПО «Первый Санкт-Петербургский медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
Влияние несостоятельности швов анастомозов на отдаленные результаты лечения больных колоректальным раком
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(8): 42-46
Карачун А. М., Петров А. С., Панайотти Л. Л., Олькина А. Ю. Влияние несостоятельности швов анастомозов на отдаленные результаты лечения больных колоректальным раком. Хирургия. Журнал им. Н.И. Пирогова. 2018;(8):42-46.
Karachun A M, Petrov A S, Panayotti L L, Ol’kina A Yu. Influence of anastomotic leakage on the long-term outcomes in patients with colorectal cancer. Khirurgiya. 2018;(8):42-46.
https://doi.org/10.17116/hirurgia201808242
НИИ онкологии им. Н.Н. Петрова Минздравсоцразвития России; Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург
Несостоятельность швов анастомоза после хирургических вмешательств по поводу колоректального рака — широко известный фактор, который ухудшает непосредственные результаты лечения. При этом ухудшению онкологических результатов лечения уделяется значительно меньше внимания. В настоящем обзоре представлены данные литературы об отдаленных последствиях несостоятельности швов анастомоза, а также предложена гипотеза о механизме реализации негативного эффекта этого осложнения на отдаленные результаты
НИИ онкологии им. Н.Н. Петрова Минздравсоцразвития России; Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург
ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург, Россия
ГБОУ ВПО «Первый Санкт-Петербургский медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
Несостоятельность швов анастомоза является грозным осложнением и основной проблемой хирургии колоректального рака. Большое внимание уделяется непосредственным последствиям этого осложнения, сопряженного с увеличением внутрибольничной летальности, сроков госпитализации и стоимости лечения таких пациентов, в то время как данных об отдаленных результатах после развития несостоятельности анастомоза представлено гораздо меньше.
Несостоятельность швов анастомоза может приводить к ухудшению качества жизни пациентов даже в отдаленном периоде. При анализе результатов лечения 614 пациентов из CLASSIC trial выявлено отрицательное влияние развития послеоперационных осложнений на отдаленные параметры качества жизни, в особенности физическое и социальное функционирование, образ тела, мобильность, возможность ухода за собой, боль и дискомфорт [1].
Значимый вклад в ухудшение качества жизни вносит перманентный характер стомы вследствие несостоятельности швов анастомоза. Риск формирования постоянной стомы у 297 пациентов, перенесших низкие передние резекции прямой кишки, составил 11% через 1 год и 22% через 10 лет. При анализе установлено, что хирургические осложнения в 3 раза увеличивали риск перманентной стомы [2].
При изучении результатов 341 интерсфинктерной резекции у больных раком нижнеампулярного отдела прямой кишки отмечено, что вероятность закрытия временной стомы уменьшалась в случае несостоятельности швов анастомоза до 78,6% по сравнению с 88,7% в группе контроля. При полной диссоциации анастомоза вероятность закрытия стомы составляла лишь 61,5%. Стриктура анастомоза, встречающаяся в 1,8% случаев при неосложненном течении послеоперационного периода, наблюдалась у 16,7% пациентов с несостоятельностью швов и у 38,5% больных с полной диссоциацией анастомоза. Обращало внимание то, что функция удержания через 2 года была схожей в группе контроля и группе больных с несостоятельностью швов анастомоза, в то время как после полной диссоциации анастомоза даже через 2 года запирательная функция была хуже [3].
Проанализировав результаты лечения 864 пациентов после резекций прямой кишки, J. Ashburn и соавт. [4] пришли к выводу, что несостоятельность швов анастомоза приводит к ранним нежелательным последствиям для функции кишки и качества жизни даже в случае, если анастомоз не был разобщен.
Отрицательное влияние несостоятельности швов анастомоза на качество жизни пациентов практически не вызывает сомнений. Взаимосвязь развития этого послеоперационного осложнения с отдаленными онкологическими результатами не столь однозначна. Имеются данные об отсутствии влияния развития несостоятельности швов анастомоза на онкологические результаты. Так, при анализе отдаленных результатов лечения 584 пациентов после резекции прямой кишки не выявлено связи несостоятельности швов анастомоза и опухолеспецифической выживаемости за 10 лет наблюдения [5]. При анализе результатов лечения 3623 пациентов из регистра PROCARE абдоминальная или тазовая инфекция не приводила к изменению общей выживаемости, встречаемости метастазов или местных рецидивов [6]. Не выявлено изменения частоты рецидивов и общей выживаемости при несостоятельности швов анастомоза после резекций прямой кишки, если проводилась предоперационная химиолучевая терапия [7].
Существуют и противоположные данные об ассоциации несостоятельности швов анастомоза с худшими отдаленными результатами лечения. Первое сообщение о связи несостоятельности швов анастомоза и отдаленных результатов было опубликовано в 1991 г. После 25 мес наблюдения за 135 пациентами без несостоятельности швов анастомоза и 25 пациентами с наличием этого осложнения рецидив у последних выявлен в 46,9% случаев (против 18,5% в группе сравнения; p 10 мг/л и 77% — в группе Dukes C, СРБ 10 мг/л. Таким образом, повышение уровня маркера воспаления ассоциировано с худшей выживаемостью. При изучении группы пациентов с несостоятельностью швов анастомозов выявлено негативное влияние уровня нейтрофилов менее 80% (HR 2,6) и комплексного показателя, получаемого математически из уровня альбумина и лимфоцитов (HR 3,5) на безрецидивную выживаемость [33].
Таким образом, влияние системного воспаления на отдаленные онкологические результаты путем потенцирования опухолевого роста представляется убедительно доказанным. Тем не менее остается не вполне объяснимой причина наличия опухолевых клеток после радикальных резекций с морфологически негативными границами. Кроме того, установлена выраженная связь раневых инфекций и системных рецидивов (HR 2,87) при раке молочной железы, когда такие данные не могут быть объяснены попаданием клеток из просвета органа [34].
Попробуем разобрать этот вопрос более подробно. Имеются данные, подтверждающие наличие клеток в просвете кишки даже после удаления пораженного опухолью участка. Так, при первом промывании культи прямой кишки после удаления препарата 50 мл раствора антисептика наличие опухолевых клеток в смывах установлено у 11 из 14 пациентов, после 10-го промывания опухолевые клетки сохранялись в смывах 4 из 14 пациентов [35]. При исследовании циркулярных краев резекции прямой кишки, остающихся в препарате («бубликов»), в 9 из 10 случаев у пациентов с гистологически негативными границами резекции опухолевые клетки обнаружены при цитологическои исследовании [36].
Опухолевые клетки также могут выделяться из крови пациентов. Имеются данные о наличии циркулирующих опухолевых клеток у 10% больных с Dukes A/B и у 54% пациентов с Dukes С через 12 нед после радикальной операции [37]. В метаанализе [38] показано, что при использовании полимеразной цепной реакции циркулирующие опухолевые клетки могут быть выявлены у 21—71% пациентов с неметастатическим колоректальным раком. Эффективность адъювантной химиотерапии при колоректальном раке даже II стадии после радикальных резекций подразумевает наличие точки приложения для лечения, т. е. наличие опухолевых клеток в органах-мишенях, на которые и нацелено действие адъювантной химиотерапии [39].
Имеющиеся данные свидетельствуют о наличии опухолевых клеток после радикальных резекций в просвете кишки, крае резекции, крови и органах-мишенях. Обеспечением негативных хирургических краев резекции далеко не всегда удается добиться удаления всех опухолевых клеток. Иными словами, с биологической точки зрения R0-резекции хирургическим способом реализовать не удается в большинстве случаев.
Умозрительно возможно предположить наличие некоторого равновесия между остающимися опухолевыми клетками и иммунной системой, которое клинически проявляется как ремиссия. При этом проведение химиотерапии или эффективный противоопухолевый иммунитет способствуют сохранению ремиссии, в то время как иные системные факторы могут сдвигать равновесие не в пользу иммунной системы. Весьма вероятно, что в числе таких факторов присутствует и несостоятельность швов кишечного анастомоза.
Исходя из сказанного, можно объяснить наличие рецидивов после радикальных хирургических вмешательств. Опираясь на данные о наличии опухолевых клеток после радикального лечения и сведения о стимулирующем действии на опухоль провоспалительных цитокинов, можно сформулировать патогенетическую последовательность влияния несостоятельности швов анастомоза на равновесие между опухолевыми клетками и иммунной системой. По-видимому, оно реализуется посредством повышения уровня активности провоспалительных цитокинов, стимулирующих пролиферацию опухолевых клеток.
При таком подходе меняется взгляд на роль хирургического вмешательства в лечении колоректального рака. Задача хирурга в свете подобной концепции состоит не только в том, чтобы любой ценой добиться негативных хирургических краев резекции, но и в том, чтобы, обеспечив «радикализм» вмешательства, способствовать сохранению равновесия между опухолевыми клетками и иммунной системой, в том числе путем снижения числа септических осложнений.
Наше предположение является теоретическим и не может быть подкреплено доказательными данными, так как невозможно организовать и провести исследования, в которых необходимо рандомизировать пациентов на тех, кто будет иметь несостоятельность швов анастомоза, и тех, у кого послеоперационый период будет протекать без осложнений, тех, кому нарочито будет нанесена большая травма, и тех, кому хирургическое вмешательство будет выполняться максимально прецизионно.
Тем не менее у нас есть возможность взглянуть по-новому на результаты уже имеющихся хорошо известных рандомизированных многоцентровых исследований, сравнивающих, по сути, операции с нанесением пациентам травмы разной степени — открытые и лапароскопические вмешательства. В исследовании CLASSIC при изучении результатов резекций прямой кишки получены очень высокие показатели положительного циркулярного края резекции не в пользу лапароскопических вмешательств — 12% в группе с лапароскопическим доступом против 6% в группе с открытым доступом (p>0,05). Несмотря на недостоверность различий, полученные результаты вызвали озабоченность среди хирургов и исследователей лапароскопического доступа при лечении рака прямой кишки [40]. Однако при анализе отдаленных результатов этого исследования через 10 лет медиана выживаемости составила 82,7 мес в группе с лапароскопическим доступом и 65,8 мес в группе открытой хирургии. Данные различия имели тренд к статистической достоверности [41].
При сопоставлении непосредственных и отдаленных результатов лучшая медиана выживаемости выявлена в группе, где наблюдалась меньшая частота негативных хирургических границ и при этом выполнялся менее инвазивный доступ. Одним из теоретических объяснений данных различий может стать именно представление об отсутствии биологических границ опухоли и наличии равновесия между опухолью и иммунной системой на клеточном уровне. Меньшая травматичность доступа, возможно, реализует свой положительный эффект на отдаленные результаты благодаря сохранению этого равновесия и продлению клинической ремиссии.
Таким образом, несостоятельность швов анастомоза не только негативно влияет на непосредственные результаты лечения, но и является важным фактором, ухудшающим качество жизни и онкологические отдаленные результаты. При этом дальнейшее изучение механизма реализации негативного эффекта несостоятельности швов анастомоза может привести к значительному изменению взгляда на требования к хирургической операции как к этапу лечения пациентов с колоректальным раком.
Авторы заявляют об отсутствии конфликта интересов.