что такое градуировочный график
Градуировочный график
16. Градуировочный график
Графическое выражение зависимости аналитического сигнала от концентрации (или количества) вредного вещества
Графическое изображение зависимости между значениями концентраций определяемого компонента и аналитического сигнала
Полезное
Смотреть что такое «Градуировочный график» в других словарях:
определение — 2.7 определение: Процесс выполнения серии операций, регламентированных в документе на метод испытаний, в результате выполнения которых получают единичное значение. Источник … Словарь-справочник терминов нормативно-технической документации
Обработка — 7. Обработка* Математический и (или) логический анализ результатов измерения Источник … Словарь-справочник терминов нормативно-технической документации
Обработка результатов — 3.5. Обработка результатов По результатам просеивания вычисляют: частный остаток на каждом сите (ai) в процентах по формуле (3) где mi масса остатка на данном сите, г; m масса… … Словарь-справочник терминов нормативно-технической документации
Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии — 4.2. Спектральный метод определения никеля, алюминия, магния, марганца, кобальта, олова, меди и циркония в ниобии Спектральному методу предшествует перевод анализируемой пробы в пятиокись ниобия. Метод основан на измерении интенсивности линий… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 22898-78: Коксы нефтяные малосернистые. Технические условия — Терминология ГОСТ 22898 78: Коксы нефтяные малосернистые. Технические условия оригинал документа: 4.4.2.2. Определение водного числа пикнометра Перед определением водного числа пикнометры должны быть тщательно промыты хромовой смесью,… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 26252-84: Порошок ниобиевый. Технические условия — Терминология ГОСТ 26252 84: Порошок ниобиевый. Технические условия оригинал документа: 4.4. Определение удельной поверхности 4.4.1. Удельная поверхность ниобиевого порошка определяется на приборе АДП 1 или Т 3 методом воздухопроницаемости, при… … Словарь-справочник терминов нормативно-технической документации
Спектральный анализ — I Спектральный анализ физический метод качественного и количественного определения атомного и молекулярного состава вещества, основанный на исследовании его спектров. Физическая основа С. а. Спектроскопия атомов и молекул, его… … Большая советская энциклопедия
Научная электронная библиотека
Дорогова В Б, Игнатьева Л П,
3.2. Метод градуировочного графика
Для определения содержания вещества методом градуировочного графика готовят серию из 5–8 стандартных растворов разных концентраций и измеряют оптическую плотность каждого из растворов, делая не менее 3-х параллельных определений для каждой точки.
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
1) он должен охватывать область возможных изменений концентраций исследуемого раствора. Желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
Полученная кривая (рис. 3.1) называется градуировочной кривой или градуировочным графиком.
Периодически 1 раз в месяц или в квартал, при замене новой партии реактивов, либо после ремонта фотоколориметра градуировочную кривую проверяют по 2–3 свежеприготовленным стандартным растворам и реагентам.
В общем случае, когда свет поглощается не только определяемым соединением, но и реагентом, экспериментальные данные измерений оптической плотности могут быть представлены следующими вариантами:
3. Оптическую плотность растворов измеряют относительно растворителя. Результат холостой пробы и его погрешность рассчитывают методом линейного регрессионного анализа.
Определив оптическую плотность исследуемого раствора АХ, находят ее значение на оси координат, а затем на оси абсцисс – соответствующее ей значение концентрации СХ.
Этот метод применяют при выполнении серийных фотометрических анализов, он дает хорошие результаты при соблюдении основного закона светопоглощения.
угловой коэффициент линейного градуировочного графика и он равен
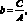
В дальнейшем, при расчете искомой концентрации СХ пользуются только градуировочным коэффициентом:
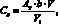
оптическая плотность анализируемого раствора;
Метод градуировочного графика



Метод градуировочного графика – это графический приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы (Iх).
Для проведения анализа готовят серию стандартных растворов, измеряют величины АС этих растворов и строят градуировочный график I = f(C) (рис.6).
Рис. 6. Определение неизвестной концентрации методом градуировочного графика.
Затем в точно таких же условиях измеряют аналитический сигнал пробы Iх и по графику определяют концентрацию анализируемого вещества в пробе Сх.
Метод стандартов (метод молярного свойства)
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности (рис. 5).
1. Метододного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст, затем измеряют величины АС этого раствора (Iст) и пробы (Iх) в одинаковых условиях.
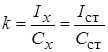
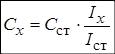
2. Метод двух стандартов (ограничивающих растворов). Для проведения анализа готовят серию стандартных растворов и измеряют величины АС этих растворов и пробы в одинаковых условиях. Затем выбирают два стандартных раствора – «ограничивающие растворы» – так, чтобы С1
Метод градуированного графика
Для определения содержания вещества методом градуи-ровочного графика готовят серию из 5-8 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
• он должен охватывать область возможных изменений концентраций исследуемого раствора, желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
• желательно, чтобы в этом интервале концентраций при выбранных толщины кюветы I и аналитической длины волны лсоблюдался основной закон светопоглощения, т. е. график D = /(С) был линейным;
• интервал рабочих значений D, соответствующий интервалу стандартных растворов, должен обеспечивать максимальную воспроизводимость результатов измерений.
При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости D = /(С).
Полученная кривая называется градуировочной (градуи-ровочным графиком).
Определив оптическую плотность раствора Dx, находят ее значения на оси ординат, а затем на оси абсцисс — соответствующее ей значение концентрации Сх. Этот метод применяют при выполнении серийных фотометрических анализов.
Метод добавок
Метод добавок представляет собой разновидность метода сравнения. Определение концентрации раствора этим методом основано на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества. Метод добавок обычно применяют для упрощения работы, для устранения мешающего влияния посторонних примесей, в ряде случаев для оценки правильности методики фотометрического определения. Метод добавок требует обязательного соблюдения основного закона светопоглощения.
Неизвестную концентрацию находят расчетным или графическим способами.
При соблюдении основного закона светопоглощения и постоянной толщине слоя отношение оптических плоскостей исследуемого раствора и исследуемого раствора с добавкой будет равно отношению их концентраций:
где Dx — оптическая плотность исследуемого раствора;
Dx + a — оптическая плотность исследуемого раствора с добавкой;
Сх — неизвестная концентрация исследуемого вещества в исследуемом окрашенном растворе;
Са — концентрация добавки в исследуемом растворе.
Источник:http://www.znaytovar.ru/new117.html
Метод градуировочного графика. Для определения содержания вещества методом градуировочного графика при выбранных оптимальных условиях обычно готовят серию не менее чем из 5 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
1) интервал должен охватывать область возможных изменений концентраций исследуемого раствора; желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
2) желательно, чтобы в этом интервале концентраций при выбранных толщине кюветы (l) и аналитической длине волны l * (в большинстве случаев l = l макссветопоглощающего соединения) соблюдался основной закон светопоглощения, т. е. график А = f(c) был прямолинейным;
При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости А = f(с). Полученная кривая (рис. 14.4.18) называется градуировочной (градуировочным графиком). Периодически (раз в неделю или реже) ее проверяют по двум-трем свежеприготовленным стандартным растворам.
Рис. 14.4.18. Градуировочный график
Вопрос № 9 условия ф.о
Для достижения высокой воспроизводимости и правильности результатов фотометрического анализа важное значение имеют селективность выбранного реагента и условия проведения фотометрических определений.
Выбор реагента
Для оценки специфических реагентов используют критерии, сформулированные А.К. Бабко [19]. Лучшим реагентом при прочих равных условиях считают такой, который при образовании окрашенного соединения обеспечивает:
1. Наибольшее смещение максимума поглощения D l = l к – l R (где l к и l R — длины волн максимального поглощения комплекса и реагента), характеризующее контрастность реакции. Контрастность фотометрической реакции считается достаточно высокой, если обеспечивается D l = l к – l R ³ 100 нм.
2. Наибольшие абсолютное и относительное изменения молярного коэффициента светопоглощения: D e = e к – e R и 
В тех случаях, когда молярные коэффициенты светопоглощения комплекса и реагента неизвестны, реагенты выбирают по наибольшей разности между суммарной оптической плотностью раствора Асм и оптической плотностью реагента: D А = Асм – АR.
3. Наибольшую разность в значениях рН при образовании окрашенных форм комплекса и реагента: D рН = рНк – рНR.
4. Наибольший интервал значений рН, в котором соблюдается постоянство оптической плотности раствора.
Практическим критерием чувствительности реагента служит угол наклона прямой, характеризующей зависимость оптической плотности (или разности оптических плотностей) от концентрации окрашенного вещества. Графическая, зависимость определяется при длине волны, где значение А (или D А) является максимальным. Чем больше угол наклона (или тангенс угла наклона) этой прямой, тем чувствительнее реагент.
Аналогично по тем же критериям можно оценивать селективные и групповые фотометрические реагенты, но их практическое применение для определения отдельных элементов возможно только в отсутствие мешающих компонентов либо в специальных условиях, при которых мешающее влияние сопутствующих элементов проявляется в незначительной степени.
В тех случаях, когда фотометрическая реакция характеризуется невысокой контрастностью и при выбранной длине волны наблюдается светопоглощение не только анализируемого комплекса, но и фотометрического реагента, находят разность оптических плотностей анализируемого комплекса и чистого реагента при той же концентрации, что и в анализируемом растворе.
Однако эту разность оптической плотности можно отождествлять с оптической плотностью раствора светопоглощающего комплекса только в тех случаях, когда светопоглощение комплекса и реагента обусловлено разными хромофорными группами, что на практике встречается сравнительно редко. Если светопоглощение комплекса и реагента обусловлено одной и той же функциональной группой, то этот прием можно использовать только в условиях большого избытка реагента, когда концентрацией реагента, затраченной на комплексообразование, можно пренебречь.
Техническая гальванопластика
Гальванопластика — направление прикладной электрохимии, направленное на создание изделий путем электрохимического осаждения металлов и сплавов на различные носители формы (формообразующие элементы) в жидких средах.
Принцип формирования металлического осадка на поверхности модели, такой же как и при гальваническом нанесении покрытий, но в отличии от классической гальваники (гальваностегии) – толщина формируемых металлических осадков может достигать нескольких сантиметров.
В первой половине 20 века применение гальванопластики с целью получения технических изделий превратилось в полноценную промышленную технологию получения сложных и точных изделий.
Правила построения градуировочного графика при фотометрическом анализе
Фотометрический анализ при контроле гальванических электролитов применяется для определения малых концентраций добавок и примесей, титриметрический анализ которых затруднён или нецелесообразен.
Распространёнными фотометрическими измерениями являются определения:
• солей хрома III в электролите хромирования и растворе хромитирования,
• общего кобальта и никеля в электролитах твёрдого золочения, серебрения и нанесения сплава «Никель-Кобальт»,
• висмута в электролите нанесения сплава «Олово-Висмут»,
• определение палладия в активаторе для металлизации диэлектриков,
• определение примесей меди, железа и никеля в различных электролитах,
• а также турбидиметрическое определение сульфатов в электролите хромирования и в сульфаматных электролитах для определения степени гидролиза сульфаматов и пр.
Физико-химические методы анализа основаны на взаимосвязи между составом системы и ее физическими и физико-химическими свойствами. Функциональная зависимость между численным значением данного физического или физико-химического свойства и содержанием анализируемого вещества может быть выражена графиком или формулой.
Основой для построения градуировочного графика является приготовление стандартных растворов.
Стандартные растворы необходимо готовить из аттестованных государственных образцов (ГСО). Если таковых не имеется, необходимо четко придерживаться основных требований к точности приготовления стандартных растворов:
• следует применять соединения квалификации не ниже ч.д.а;
• использование реактивов с просроченным сроком годности недопустимо;
• для приготовления стандартных растворов использовать только гостированную мерную посуду.
Особое внимание обратить на условия и сроки хранения растворов с содержанием вещества 1 мг/см3 хранят 1 год, 0,1 мг/см3 – 3 месяца (если нет других указаний, а также если нет помутнения, хлопьев, осадка), растворы с меньшим содержанием применяются свежеприготовленными. Стандартные растворы фильтровать не допускается.
Для определения содержания вещества методом градуировочного графика готовят 3 серии шкал стандартов. Указания по приготовлению шкалы стандартов конкретно оговорены в каждой методике.
При приготовлении параллельных шкал рабочие растворы готовят соответствующим разбавлением основного стандартного раствора, который готовится из одной взятой навески или ГСО.
Градуировочный график строят на миллиметровой бумаге или в электронной форме при помощи Excel, откладывая на оси абсцисс, указанную в методике определения концентрацию, а по оси ординат – измеренные значения оптической плотности.
Количественное значение оптической плотности для каждой точки градуировочного графика определяется как среднее арифметическое результатов параллельных измерений 3-х шкал.
С целью уменьшения погрешности графического измерения, необходимо подобрать такой масштаб графика, чтобы угол его наклона приблизительно равнялся 45º.
Градуировочный график должен нести следующую информацию:
• НД на метод проведения исследования;
• марка КФК, его заводской номер;
• длина рабочей грани кюветы;
• раствор сравнения (растворитель, нулевой раствор и т.д.), т.е. относительно чего снимались показания испытуемого раствора;
• на графике должны присутствовать данные 3-х параллельных измерений и среднее арифметическое значение (в виде таблицы).
Градуировочный график строится один раз в год и после ремонта прибора. Поверка графика должна проводиться 1 раз в квартал (если нет других указаний в методике определения), а также после приготовления реактивов из новой партии, поверки прибора. Поверка проводится по 3-м точкам графика наиболее часто встречающихся в работе концентраций. Данные поверки заносятся в журнал поверок градуировочных графиков или наносятся на обратную сторону графика в виде таблицы.
Несмотря на простоту и удобство, практическое использование градуировочных графиков в ряде случаев вносит дополнительную погрешность при определении концентрации растворов как за счет субъективного построения графической зависимости, так и за счет несоответствия графичеких (масштабных) погрешностей и погрешностей измерения оптических плотностей. Поэтому для получения более объективных результатов в фотометрическом анализе целесообразно построение градуировочного графика методом регрессивного анализа (уравнение регрессии).
Описание метода наименьших квадратов и пример построение уточнённого градуировочного графика на примере фотометрического определения железа – здесь.
Дополнение для приборов, имеющих стрелочное регистрирующее устройство:
На многих предприятиях до сих пор в эксплуатации находятся приборы, при работе на которых значение измеренного пропускания отсчитывают по стрелочному прибору. Эти устройства являются обычным источником погрешности именно при отсчитывании показаний. Для правильно сконструированного стрелочного прибора погрешность при отсчёте будет постоянной и, возможно, равной толщине стрелки, которая соответствует определённому отсчёту по шкале прибора. При допущении, что отсчёты пропускания, полученные каждым таким устройством, имеют постоянную недостоверность (обусловленную изменением мощности источника света, характеристиками детектора, электрическими шумами, положением кюветы, и обычно приводящую к суммарной погрешности от 0,2 до 1%), можно рассчитать погрешность, которую вызовет ненадёжность при регистрации концентрации определяемых частиц.
Для расчёта концентрационной погрешности необходимо изучить влияние недостоверности измерения пропускания на вычисленное значение концентрации. Для этого запишем закон Бера в форме, которая показывает, что зависимость от концентрации является экспоненциальной:
T = P/P0 = 10-abC, где (1)
b– толщина поглощающего слоя раствора в кювете,
С – концентрация оптически активного вещества,
а – удельная поглощательная способность, зависящая от природы вещества.
Из графика этой зависимости на рисунке можно определить, какое влияние на рассчитанное значение С окажет постоянная погрешность в пропускании.
Сначала рассмотрим спектрофотометрическое измерение раствора с низкой концентрацией (С1) определяемых частиц. Согласно рисунку этот раствор будет иметь высокое значение пропускание (Т1). Допуская, что недостоверность при отсчёте стрелочного прибора соответствует постоянной абсолютной погрешности в Т, можно определить из рисунка результирующую погрешность в определение С. Из экстраполирования линии видно, что абсолютная погрешность в концентрации (ΔС1) мала, когда раствор имеет высокое пропускание. Однако поскольку сама концентрация (С1) мала, относительная погрешность в концентрации (ΔС1/С1) довольно велика.
Теперь рассмотрим случай, когда имеется высокая концентрация (С2) определяемого вещества. Этот раствор будет иметь относительно низкое значение пропускания (Т2). Если снова допустить наличие постоянной погрешности в Т, то получим большую абсолютную погрешность (ΔС2) в концентрации, и хотя концентрация велика, относительная погрешность (ΔС2/С2) также будет велика.
Эти результаты свидетельствуют, что где-то между экстремальными значениями концентрации в пробах, имеющих высокие и низкие пропускания, должно существовать значение пропускания, для которого относительная погрешность в концентрации (ΔС/С) минимальна. В действительности относительная погрешность минимальна при 36,8%-ном пропускании. К этому выводу можно прийти и расчётным путём, вспомнив определение понятия поглощения:
А = lg (1/T) = 1/2,303 ln(1/T) = 0,434 ln (1/T) (2)
Если это уравнение продифференцировать относительно Т, то получим
Для того чтобы оценить относительную погрешность в значении поглощения и тем самым в концентрации, необходимо разделить каждую часть уравнения (3) на поглощение (А). Тогда
dA/А = (-0,434/TА) dT= (0,434/TlgT) dT (4)
Чтобы найти относительную погрешность в концентрации, заменим в этом уравнении А соответствующей величиной согласно закону Ламберта-Бера (1):
d(abC)/abC = (ab)dC/abC = dC/C = (0,434/T lgT) dT (5)
Уравнение (5) показывает, что относительная погрешность в концентрации (dC/C) непосредственно зависит от абсолютной недостоверности в пропускании (dT), а также от обратной величины произведения (TlgT), включающего значение самого пропускания. Графическая зависимость этого уравнения, показывающая относительную погрешность в концентрации (dC/C) как функцию пропускания (в %) при постоянной погрешности в отсчёте (dT), равной 1%, показана на рисунке:
Из рисунка видно, что относительная погрешность в концентрации достаточно низка при пропусканиях между 20 и 70%, но при переходе к очень низким или высоким значениям пропускания погрешность резко возрастает. Можно найти минимальную относительную погрешность в концентрации путём дифференцирования уравнения (5) и приравнивая выражения к нулю. Как указано ранее, минимальная погрешность имеет месть при 36,8%-ном пропускании или при поглощении, равном 0,434. Поэтому для спектрофотометров, имеющих стрелочное регистрирующее устройство, можно проводить измерение с наименьшей погрешностью, если отсчёты по шкале ограничены пределом от 20% до 70% пропускания (или от 0,7 до 0,2 единиц поглощения), а в оптимальном случае эти расчёты приближаются к значениям 36,8% пропускания или к 0,434 единиц поглощения. Обычно можно соблюдать эти ограничения путём соответствующего выбора толщины поглощающего слоя пробы (b) или путём разбавления раствора пробы, взятого для анализа.
Приведённые выше рассуждения применимы только к измерениям на спектрофотометрах, имеющих постоянную погрешность, связанную с отсчётом пропускания. Современные приборы обладают цифровой регистрацией, погрешность отсчёта не является для них фактором, лимитирующим правильность.
1) Переярченко П.В., Афанасьева О.Л., Замковая Л.А., Махоня Т.В., Гольнева Л.Н. Информационное письмо о правилах построения градуировочных графиков при фотоколориметрических методах исследования.
2) Петерс Д., Хайес Дж., Хифтье Г. Химическое разделение и измерение. Теория и практика аналитической химии. – М.: «Химия», 1978. – 816 с.
3) Булатов М.И., Малинкин И.П. Практическое руководство по фотометрическим методам анализа, Ленинград, Химия, 1986;
4) Справочник по физико-химическим методам исследования объектов окружающей среды под редакцией Арановича Г.И., Ленинград, Судостроение, 1979;
5) Новиков Ю.В., Ласточкина К.О., Болдина З.Н. Методы исследования качества воды водоемов, Москва, Медицина, 1990;
6) ГОСТ 4212–76 «Реактивы. Методика приготовления растворов для колориметрического, нефелометрического и других видов анализа».