что такое гомологический ряд в химии кратко
Гомологический ряд — определение, общая формула и примеры для разных классов соединений
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
пентин — C5H8 и т. д.
Гомологический ряд алканов в таблице
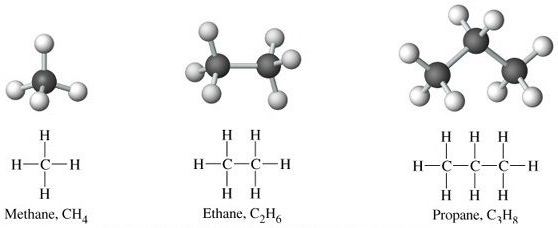
Алканы — ациклические предельные углеводороды:
всеобщая формула алканов — СnH2n+2;

Алканы обладают следующими свойствами:
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
нерастворимы в воде, но могут растворяться в неполярных растворителях;
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Алкены обладают следующими свойствами:
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
имеют очень высокую температуру плавления и кипения;
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
Алкены участвуют в следующих химических реакциях:
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
Гомологический ряд альдегидов
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
низшие представители класса имеют резкий запах;
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Урок №27. Основные классы органических соединений. Гомологические ряды
В основу классификации органических веществ положены различия в строении углеродных цепей. В соответствии с этим все органические вещества делятся на ациклические и циклические.
Ациклические (алифатические) – соединения с открытой (незамкнутой) цепью углеродных атомов.
Ациклические соединения, в свою очередь, подразделяются на
Непредельные (алкены, алкины, диеновые углеводороды)
Циклические – соединения, в молекулах которых углеродные атомы замкнуты в кольцо.
Карбоциклические – если цикл образован только углеродными атомами,
Гетероциклические – если в состав цикла помимо углеродных атомов входят атомы других химических элементов (азота, кислорода, серы)
Карбоциклические соединения, в свою очередь, подразделяются алициклические (циклоалканы) и ароматические (соединения, содержащие в составе молекулы одно или несколько бензольных колец).
Классификация органических соединений по строению углеродной цепи представлена в следующей таблице.
Углерод соединяется друг с другом одинарными и кратными связями (двойными и тройными), образуя прямые, разветвлённые и замкнутые цепи.
А) Прямая (неразветвлённая) цепь:
СH 2 = CH – CH 2 – CH 3
CH 2 = CH – CH = CH 2
Б) Разветвлённая цепь:
К циклическим относятся карбоциклические – содержащие в цикле только атом ы углерода и гетероциклические соединения – содержащие в цикле кроме атомов углерода атомы других элементов – кислорода, азота и др.
Функциональные производные углеводородов
Функциональная группа – структурный фрагмент молекулы, единый для конкретного гомологического ряда и определяющий характерные химические свойства данного класса соединений.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов).
Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности.
Гомологические ряды могут быть построены для всех классов органических соединений. Зная свойства одного из членов гомологического ряда, можно сделать выводы о свойствах других представителей того же ряда. Это обусловливает важность понятия гомологии при изучении органической химии.
Определение и группы
Все вещества имеют разную молярную массу и структуру молекулы, следовательно, их физические свойства, такие как температуры изменения агрегатного состояния, плотность, прочность и т. д. будут различаться. Наиболее похожими будут свойства ближайших друг к другу веществ.
Свойства изменяются от начальных веществ к высшим, это можно увидеть на примере гомологического ряда алканов:
Есть определенные правила, по которым проходит систематизация органических соединений.
Номенклатура углеводородов
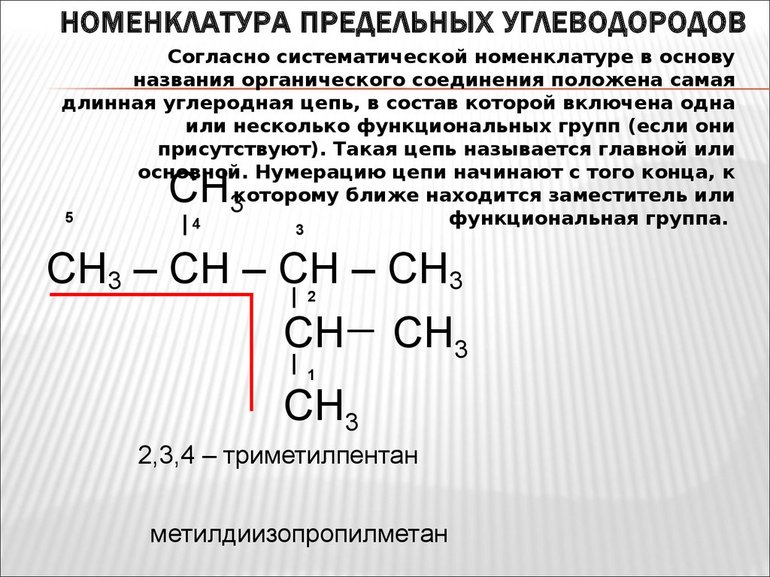
Согласно ИЮПАК (Международного союза теоретической и прикладной химии), первые четыре углеводорода имеют стандартные, сложившиеся с годами приставки: мет-, эт-, проп, — бут-. В зависимости от гомологического ряда (алканы, алкены, алкины и т. д. ), к этой приставке добавляется суффикс. Начиная с пятого наименование основано на греческих цифрах, соответствующих числу атомов углерода. Для углеводородов с разветвлённой структурной формулы существует определенная система наименования:
Называя соединение, для начала нужно перечислить в алфавитном порядке радикалы, перед названием которых ставится цифра, соответствующая номеру главного атома углеродной цепи, где этот заместитель расположен. Далее указывают главный углеводород. Следует помнить, что слова от цифр отделяют дефисом. Например: 3-метилпентанол, 2,3-диметилпентадиол и т. д.
Следует помнить, что существует еще один вид химических соединений, противоположный гомологам.
Изомерия вещества
Изомеры, в отличие от гомологов, имеют одинаковую структурную формулу и молярную массу.
Отличие состоит в строении или расположении самого атома в пространстве, вследствие чего различаются и свойства. Так, различают структурную и стереоизомерию.
Первый вид соединений отличается по химическому строению:
При стереоизомерии различия возникают в пространственной конфигурации молекулы.
Эти соединения составляют очень большой перечень неорганических веществ. У многих из них существует два, или более изомеров. Подсчитать же точное количество подобных веществ в органической химии не представляется возможным, поскольку даже в одном гомологическом ряду может существовать несколько миллионов изомеров без учета стереоизомерии.
Гомологический ряд химических соединений
В данной статье читатель найдет информацию о гомологичных соединениях, узнает, что они собой представляют. Будут рассмотрены общие свойства, формула веществ и их наименования, характеристика. К тому же затронуто будет не только химическое понимание гомологов, но и биологическое.
Что такое гомологический ряд
Гомологический ряд – это химические соединения, имеющие аналогичный структурный тип, но различающиеся по количеству повторения элементарных единиц вещества. Различие структурных компонентов, а именно одинаковых единиц, и называется гомологической разностью. Гомологами называют вещества, которые находятся в одном и том же гомологическом ряду.
Общие представления о структуре и гомологии соединений
Представление о гомологии веществ в органической химии базируется на понимании того, что как физические, так и химические качественные характеристики веществ могут определяться молекулярной структурой. Свойства гомологических соединений могут зависеть от строения углеродного скелета и функциональной группы определенного соединения.
Определить химические свойства и, следовательно, принадлежность гомолога к конкретному классу возможно по его функциональной группе. В качестве примера можно обратить внимание на карбоксильную группу, которая отвечает за проявление кислых свойств и принадлежность вещества к карбоновым кислотам. Однако определить уровень проявления химических или физически качеств можно, изучая не только функциональную группу, но и углеродный молекулярный скелет.
Существуют соединения, в которых углеродные скелеты схожи, иными словами, изомерия в них отсутствует. Такие гомологи записываются следующим образом: X – (CH2)n – Y. Количество метиленовых n-звеньевых единиц является гомологичным и относится к классу соединений одного вида. Подобные виды гомологов являются ближайшими.
Гомологический ряд веществ носит некоторые общие закономерности изменения свойств от младших представителей к старшим. Подобное явление способно нарушаться, что связано с образованием водородной связи при наличии группы, которая может их образовывать.
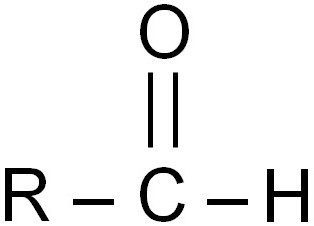
Гомология альдегидов
Альдегиды – ряд соединений органического типа, содержащих в себе альдегидную группу – COH. В веществах данного типа карбоксильная группа взаимосвязана с водородным атомом и одной радикальной группой.
Гомологический ряд альдегидов имеет общую формулу R–COH. Одним из элементарных представителей является формальдегид (H–COH), в нем альдегидная группа связана с H. В других, предельных представителях данного ряда соединений водородный атом заменяется на алкин. Общая формула: CnC2n+1–COH.
Альдегиды рассматриваются в качестве веществ, которые произошли в результате замены в парафиновом углеводородном атоме H на группу альдегидную группу. Для таких химических соединений изомерия и гомология является аналогичной другим производным предельных однозамещенных углеводородов.
Наименование альдегидов составляется в зависимости от названия кислоты с таким же количеством углеродных атомов в молекуле, например: CH3–CHO – уксусный альдегид, CH3CH2–CHO – пропионовый альдегид, (CH3)2CH–CHO – изомасляный альдегид и т. д.
Гомология алкинов
Алкины – это углеводородные химические соединения, несущие в себе тройные связи между атомами C. Они образовывают ряд гомологов с характерной формулой CnH2n-2. Общая особенность положения углеродного атома при тройном количестве связей – состояние sp-гибридизации.
Гомологический ряд алкинов: этин (C2H2), пропин (C3H4), бутин (C4H6), пентин (C5H8), гексин (C6H10), гептин (C7H12), октин (C8H14), нонин (C9H16), децин (C10H18).
Физические свойства алкинов определяются аналогичным образом с алкенами. Например, температура кипения и плавления постепенно возрастает с увеличением длины главенствующей цепи углерода и молекулярной массой. К химическим свойствам можно отнести реакции галогенирования, гидрогалогенирования, гидратацию, полимеризацию. Для алкинов также характерны реакции замещения.
Гомология в биологии
Гомологический ряд используется в биологии, однако носит несколько иной характер. Н. И. Вавилов открыл закон, в соответствии с которым происхождение видов и даже родов растений, сходных между собой, влечет протекание изменчивости по параллельным путям. Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.
Заключение
Гомологический ряд веществ, характеризующихся общей формульной структурой, но отличающихся гомологической разностью, позволил человеку увеличить химический потенциал веществ, открывать и получать множество новых соединений, используемых во всех сферах жизнедеятельности. Лучше понять фундаментальное явление о том, что физические и химические качественные характеристики могут определяться молекулярной структурой соединения.
Теория строения органических соединений
| Органическая химия – это химия углерода и его соединений с другими элементами. |
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
| Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. |
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом | |||
| Например, простейшая формула метана CH4, а вот бензола – СН. |
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
| Например, истинная формула бензола C6H6. |
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
| Например, полная структурная формула бутана: |
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
| Например, сокращенная структурная формула бутана: |
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
Атомы углерода
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
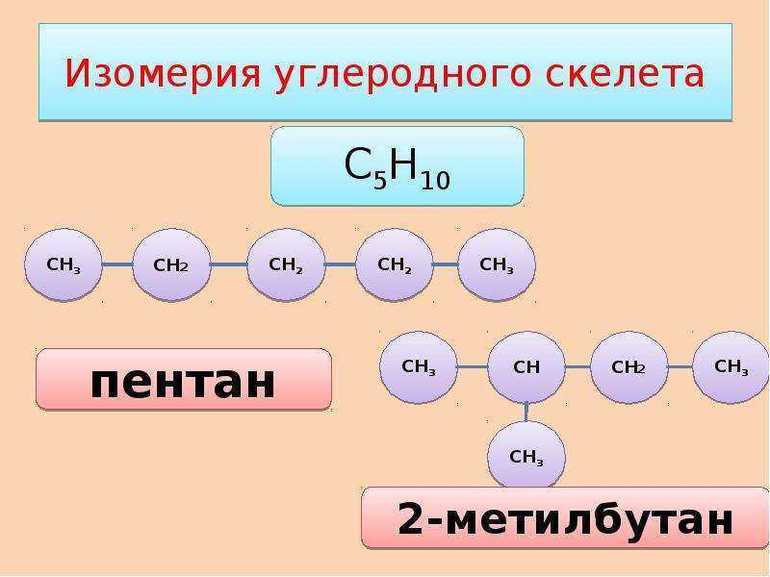
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
Классификация органических веществ по составу
Углеводороды
| Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан CH3-CH3 | Циклобутан | Этилен CH2=CН-СН=СH2 | Ацетилен | ||
| Ациклические углеводороды | ||
| С неразветвленной цепью | С разветвленной углеродной цепью | |
| н-Бутан CH3-CH2-CH2-CH3 | Изобутан | |
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
| Основные функциональные группы, содержащие кислород: Кислородсодержащие органические вещества | Ацетальдегид | Пропанон | Уксусная кислота | Метилацетат |
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
Некоторые органические вещества содержат и азот, и кислород.
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2 CH3-NH2 | Нитрил уксусной кислоты CH3-NO2 | Амид уксусной кислоты CH3-C(NH2)=O | Аминоуксусная кислота | ||
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
| Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. |
| Гомологи – это вещества, которые входят в один и тот же гомологический ряд. |
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
 |  |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.