что такое геномный импринтинг
Что такое геномный импринтинг
При некоторых болезнях экспрессия фенотипа связана с тем, от кого из родителей унаследован мутантный аллель или аномальная хромосома. Различия экспрессии генов между отцовской и материнской аллелью — результат геномного импринтинга.
Импринтинг — нормальный процесс, вызванный изменениями в хроматине в характерных позициях генома, произошедшими в половых клетках только одного из родителей. Изменения включают ковалентные модификации ДНК, например метилирование цитозина с формированием 5-метилцитозина, или изменения и замены в гистоновых белках хроматина, которые могут влиять на экспрессию генов в конкретной хромосомной области.
Примечательно, что импринтинг влияет на экспрессию генов, а не на первичную последовательность ДНК. Это обратимая форма инактивации гена, а не мутация, таким образом, пример эпигенетигеского эффекта. Эпигенетика — раздел генетики человека и медицинской генетики всевозрастающей важности, изучающий влияние на экспрессию генов и фенотип как у здоровых, так и больных при многих патологиях, включая цитогенетические аномалии, моногенные заболевания и онкологию.
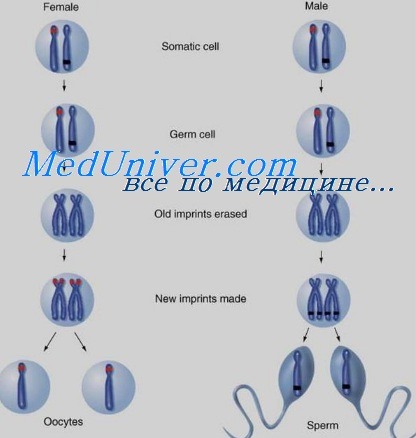
Импринтинг происходит при гаметогенезе, до оплодотворения, и отмечает отдельные гены как исходящие от матери или отца. После зачатия импринтинг регулирует экспрессию генов в пределах импринтируемой области в некоторых или всех соматических тканях эмбриона.
Состояние импринтинга сохраняется и после рождения через сотни клеточных делений, приводя к тому, что в клетке экспрессируется только материнская или отцовская копия гена. В то же время импринтинг обратим: если аллель отцовского происхождения наследуется женщиной, он преобразуется в ее половых клетках, так что она может передать его потомству уже с материнским импринтингом.
Аналогично импринтированный материнский аллель, унаследованный мальчиком, должен преобразоваться в его половых клетках, с тем чтобы стать импринтированным отцовским аллелем у его потомства. Управление данным процессом осуществляют центры импринтинга — специальные элементы ДНК, находящиеся в пределах импринтируемых областей генома. Хотя точный механизм их действия неизвестен, они должны вызывать эпигенетические изменения в хроматине, которые затем распространяются по хромосоме в области импринтинга.
Здесь мы сфокусируемся на влиянии импринтинга в клинической цитогенетике, так как множество его эффектов обнаруживают вследствие хромосомных аномалий.
Подтверждение геномного импринтинга получено для множества хромосом или хромосомных областей всего генома при сравнении фенотипов лиц, несущих ту же цитогенетическую аномалию, затрагивающую материнский или отцовский гомолог. Хотя оценки варьируют, вероятно, что, по крайней мере, несколько десятков, если не сотен генов у человека проявляют эффекты импринтинга.
Некоторые области содержат единственный импринтируемый ген; другие содержат целые группы, в некоторых случаях занимающие более 1 мегабазы вдоль хромосомы, или же множественные гены импринтинга.
Признак импринтированных генов, отличающий их от других аутосомных локусов, — экспресия в тканях только одного аллеля, или материнского, или отцовского. В отличие от этого, в неимпринтируемых локусах всех клеток (т.е. в подавляющем большинстве локусов генома) экспрессируются как материнские, так и отцовские аллели.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Почему некоторые наследственные признаки зависят от возраста родителей?
Геномный импринтинг – широко распространенное у млекопитающих явление, состоящее в том, что некоторые гены в половых клетках родителей особым образом «метятся» (например, путем метилирования цитозиновых оснований). «Помеченный» ген у потомства просто-напросто не работает. Некоторые гены отключаются в сперматозоидах, другие в яйцеклетках. В результате часть признаков потомство наследует только от матери (если соответствующие гены отключены в сперматозоидах), часть – только от отца (если ген отключен в яйцеклетке). В половых клетках потомства старые метки удаляются и заменяются новыми. В результате у внуков могут проявиться признаки деда или бабки, которые не были выражены у родителей. Импринтинг – это пример так называемой «эпигенетической», или надгенетической наследственности, то есть наследственных свойств, не связанных с изменением основной структуры генов – последовательности нуклеотидов в молекулах ДНК.
Зачем нужен геномный импринтинг, почему он появился? Для объяснения этого существует две гипотезы. Первая – общепринятая – состоит в том, что импринтинг развился вследствие различия интересов полов. У млекопитающих между самкой и ее детенышем во время внутриутробного развития складываются отчасти антагонистические отношения. Говоря упрощенно, эмбрион старается высосать из матери побольше соков, а мать старается сохранить силы и здоровье, чтобы в будущем иметь возможность родить и других детенышей. Самец в этом конфликте в общем случае – на стороне детеныша. Других-то детей самка еще неизвестно от кого родит, а этот – свой. Поэтому самцы отключают в своих сперматозоидах те гены, которые способствуют защите матери от чрезмерных притязаний эмбриона, а матери, напротив, отключают в своих яйцеклетках те гены, которые могут эти притязания усилить. Действительно, большинство генов млекопитающих, подвергающихся родительскому импринтингу, так или иначе связаны с внутриутробным развитием, строением плаценты и т.п.
Альтернативная гипотеза, более симпатичная с этической точки зрения, была высказана совсем недавно (Jason B. Wolf, Reinmar Hager. A Maternal–Offspring Coadaptation Theory for the Evolution of Genomic Imprinting // PLoS Biology, 2006. 4(12): e380. DOI: 10.1371/journal.pbio.0040380 ). Согласно этой гипотезе, основной смысл геномного импринтинга – достижение лучшей совместимости между матерью и плодом, то есть на первое место ставятся не антагонистические взаимоотношения матери и эмбриона, а кооперативные. Если часть отцовских генов будет выключена, то у эмбриона будут работать только материнские копии этих генов, и эмбрион, таким образом, будет по своим физиологическим и биохимическим свойствам больше похож на мать, и им легче будет приспособиться друг к другу. Эта гипотеза предполагает, что в ходе родительского импринтинга должно отключаться больше отцовских генов, чем материнских, и факты это подтверждают.
А. И. Кутмин из Сибирского государственного медицинского университета (г. Томск) предположил, что роль импринтинга может быть значительно шире. По его мнению, это явление позволяет объяснить «общеизвестную статистику, свидетельствующую о том, что в человеческом обществе выдающиеся личности являются детьми родителей крайних возрастных категорий, как правило, старых отцов и юных матерей». Вот только очень досадно, что автор не дает ни одной ссылки на литературные источники, из которых читатель мог бы хоть что-то достоверное узнать об этой «общеизвестной статистике»! На мой взгляд, это серьезное упущение в первую очередь со стороны научного редактора.
Гипотеза А. И. Кутмина состоит из трех положений.
1) В геномах млекопитающих существуют гены-супрессоры (т.е. гены, подавляющие активность других генов), в регуляторных областях которых имеется несколько одинаковых копий каких-либо регуляторных элементов, например энхансеров, т.е. мест прикрепления белков-регуляторов, активирующих данный ген.
2) В предшественниках половых клеток одного из родителей (либо отца, либо матери) осуществляется импринтинг этих повторяющихся регуляторных участков. Чем больше таких участков будет «помечено», тем слабее работает ген-супрессор, и тем сильнее будет выражен у потомства тот признак, который этим геном-супрессором подавляется.
3) Импринтинг осуществляется не хаотично, а в строго определенной последовательности по мере старения родителя. Изначально в клетках – предшественниках гамет в одной из двух копий гена (аллель 1) все копии регуляторного участка блокированы, а в другой копии (аллель 2) они все «открыты», активны. С течением времени ситуация меняется. Часть копий у аллеля 1 активируется, и при этом ровно столько же копий у аллеля 2 блокируется. К концу жизни оказывается, что блокированы все копии регулятора у аллеля 2, а у аллеля 1 – все открыты (рис. 1).
Таким образом, свойства половых клеток (гамет) будут меняться в зависимости от возраста родителя (допустим, отца). Очень молодые и очень старые отцы будут производить разные гаметы: в половине сперматозоидов данный ген-супрессор будет полностью активирован, в другой половине – полностью подавлен. У матери данный ген не подвергается импринтингу, поэтому во всех ее яйцеклетках данный ген будет полностью активирован. Потомство, таким образом, получится разнообразным: половина потомства получит две активированные копии гена, другая половина – одну активированную и одну блокированную копии.
Если же отец – среднего возраста, то во всех его сперматозоидах данный ген будет наполвину активирован, наполовину подавлен. Все потомство получит в этом случае от матери – активированный ген, от отца – наполовину активированный. Разброс признаков у потомства поэтому должен быть меньше. Дети очень юных и очень старых родителей, таким образом, должны проявлять крайние значения признаков и быть разнообразными, дети родителей среднего возраста должны проявлять средние значения признаков и быть более однообразными.
Безусловно, гипотеза А. И. Кутмина очень интересна. Но насколько она соответствует действительности? Для ответа на этот вопрос нужны факты, а вот с фактами пока, на мой взгляд, дело обстоит не очень хорошо.
Для подтверждения своей гипотезы А. И. Кутмин приводит всего лишь четыре примера. Это не слишком много, если учесть, что, судя по тексту статьи, данная идея появилась у автора довольно давно, не позднее 1999 года. Геномный импринтинг сейчас очень активно изучается, и если гипотеза Кутмина верна, то можно было бы ожидать, что среди огромного количества постоянно открываемых новых фактов, касающихся импринтинга, автор смог бы найти множество подтверждений своему предположению. Однако в статье, как ни странно, почти нет ссылок на англоязычные публикации последних лет по геномному импринтингу.
Все четыре примера, приводимые автором, к сожалению, страдают тем или иным изъяном. Все они основаны на поиске характерного рисунка в распределении количественных признаков в зависимости от возраста родителей. Это рисунок А. И. Кутмин назвал «эпигенетическим крестом». Если гипотеза верна, то, откладывая по горизонтальной оси «эпигенетический возраст» родителя, а по вертикальной – состояние признака у потомков, мы получим характерное Х-образное распределение точек. У самых молодых и самых старых родителей потомки имеют одно из двух крайних состояний признака, у родителей среднего возраста – среднее состояние.
Первый пример состоит в том, что в выборке из 19 женщин наблюдается положительная корреляция между возрастом отцов этих женщин и значением особого признака – гематокрита (объемный процент осадка цельной крови). Автор предполагает, что ген-супрессор с «копийным регулятором», от которого зависит гематокрит, располагается на половых хромосомах X и Y, «импринтирующим» родителем является отец, и у молодых отцов изначально в предшественниках гамет импринтированы все копии «копийного регулятора» на Y-хромосоме, а на X-хромосоме – все активны. Поэтому, если гипотеза верна, гематокрит у женщин должен расти, у мужчин – снижаться с возрастом отца. У женщин, как показывает этот пример, гематокрит с возрастом отца действительно растет, хотя этот рост и не очень четкий (коэффициент корреляции 0,55). А вот по мужчинам данные не приводятся. Из текста можно понять, что у мужчин, особенно у молодых, этот признак зависит еще и от их собственного возраста, что затрудняет исследование.
Третий пример – это график зависимости «радиочувствительности» (число хромосомных аббераций на 100 клеток) от антиоксидантной активности плазмы крови у мужчин, получивших хроническую дозу облучения 28,7 +/- 1,3 бэр во время работы на Сибирском химическом комбинате (г. Северск Томской области). На графике заметна слабо выраженная крестообразность. Это трактуется автором как «вторичный эпигенетический крест», который должен получаться, если оба сопоставляемых признака (в данном случае антиоксидантный статус и радиочувствительность) регулируются в соответствии с предложенной гипотезой.
Четвертый пример, пожалуй, наиболее убедителен. Рассмотрены семь пар разнополых сибсов (братьев и сестер). Брат и сестра в каждой паре близки по возрасту (это значит, что их отец находился на одной и той же «эпигенетической стадии»). Оказалось, что если расположить мужчин в этой выборке в порядке убывания гематокрита, то у их сестер в этом ряду гематокрит, напротив, возрастает. Если предположить, что по соотношению гематокрита у брата и сестры можно судить об «эпигенетическом возрасте» их отца, и отложить этот вычисленный эпигенетический возраст по горизонтальной оси, а по вертикальной оси отложить значения гематокрита у братьев и сестер, то получается довольно красивый «эпигенетический крест». Вот только сведений о реальном возрасте отцов этих пар автор почему-то не приводит, что существенно портит впечатление от данного примера и снижает его убедительную силу.
В целом гипотезу А. И. Кутмина можно охарактеризовать как весьма интересную, но пока недостаточно обоснованную.
P.S. Автор указывает, что альтернативная гипотеза о том, что в нескольких копиях присутствует не регуляторный участок гена-супрессора, а сам ген, маловероятна, поскольку все гены обычно присутствуют только в одной копии в каждом гаплоидном наборе хромосом. Это не соответствует последним результатам анализа генома человека. Оказалось, что в нашем геноме очень многие крупные участки (длиной более 1000 нуклеотидов) многократно дублируются, причем число копий может сильно различаться у разных индивидуумов (Redon et al., 2006. Global variation in copy number in the human genome // Nature. V. 444, P. 444-454)
Извините коллега, но это не комментарий к статье Александра Маркова и не комментарий к статье Алексея Кутмина. Потому, что Вы традиционно не сказали по существу дела ничего информативного. Зачем Вы соврали? Во-первых, никаких серьезных конструктивных дискуссий на тему гипотезы динамического импринтинга в Институте не было. Во вторых, я никогда ни на кого не обижался и не называл и не обзывал ни публично, ни приватно Ученый Совет НИИ медицинской генетики Томского научного центра сессией ВАСХНИЛ. Хотя, в своем нынешнем послании Вы стиль этой сессии недвусмысленно продемонстрировали. И второй вопрос. Зачем Вы разрушили технологическую базу химического синтеза ДНК в Томске, не Вашими руками созданную? Может быть, пора прибавить серьезности и перестать неугодных Вам и Вашему начальству оппонентов шапками закидывать?
С почтением,
Уважаемый Алексей Иванович,
Я лично бы свидетелем и участником нескольких дискуссий на эту тему. Они были вполне конструктивны. В частности, Вам неоднократно указывали, что гипотезы надо подтверждать фактами, а не рассуждениями.
Лично я ничего не разрушал, более того я, если Вы помните (хотя вряд ли), был против закрытия группы синтеза и сиквенса нуклеиновых кислот. Разрушили базу лично Вы своим халатным отношением к делу. О том, обиделись Вы или нет, можно судить по тону Вашего комментария.
Однако не хочу засорять данное обсуждение разборками.
По существу вопроса могу согласиться с рецензентом: Ваша гипотеза «плавающего импринтинга» была и остается гипотезой. Она может показаться интересной, но фактическое ее обоснование, как и много лет назад, находится на уровне полуфилософских рассуждений. Никаких многокопийных генов-регуляторов не найдено, хотя геном просеквенирован и, вероятно, большая часть генов идентифицирована и картирована. Достаточно посмотреть на Ваш ответ рецензенту, чтобы понять, что никуда Вы в своей гипотезе не продвинулись. Все те же общие рассуждения. Важно также помнить, что сначала Вы получили результат (данные по гематокриту), а потом подогнали под него гипотезу. Лично я не против любых смелых гипотез, но если они не находят подтверждений, то ни к чему ими захламлять окружающую среду.
По поводу коэффициента корреляции. Коэффициент Пирсона, он посчитан Вами без проверки на нормальность распределения, что некорректно, особенно на такой микроскопической выборке. Глядя на графики, которые Вы приводите, можно увидеть и кресты, и другие фигуры. Вы видите то, что хотите видеть. В этом весь фокус.
Уважаемый Алексей Иванович,
Откройте любой номер журнала Nature Genetics, Genomics, Science, Genome Research и т.д. и убедитесь, что геном изучают вполне успешно и без Ваших сногсшибательных идей, которые Вы не в состоянии внятно обосновать уже более 10 лет. На прощание ответный дружеский совет: займитесь чем-то, в чём разбираетесь, а если никак неймется, разберитесь в том, чем занимаетесь. Например, изучете сначала нормальную генетическую азбуку, прежде чем рисовать альтернативную.
Замечание 3. Нет ни одной ссылки на феномен поздних детей.
Ответ. Данный феномен не является доказательством или опровержением справедливости рассматриваемой гипотезы динамического импринтинга. Поэтому ссылки на основополагающую работу авторов из Донецка Игоря Алексахина и Алексея Ткаченко, а также работы их англоязычных последователей, нами не приводились.
Замечание 4. Трудно предположить, что самки полевок по запаху определяют эпигенетический возраст самцов.
Ответ. Для того чтобы это предположить не надо предпринимать никаких дополнительных исследований. Достаточно просто поинтересоваться у женщин способны ли они по запаху отличить старое тело от молодого. А ведь у мышей способность дифференцировать запахи на несколько порядков выше!
Замечание 5. ‘Автор указывает, что альтернативная гипотеза о том, что в нескольких копиях присутствует не регуляторный участок гена-супрессора, а сам ген, маловероятна, поскольку все гены обычно присутствуют только в одной копии в каждом гаплоидном наборе хромосом. Это не соответствует последним результатам анализа генома человека’.
Ответ. Во-первых, это указывает не автор, а Мэри Лайон в своем письме к автору. Во вторых, нет необходимости привлекать данные литературы, чтобы понять, что копировать гены с целью регуляции их активности нерентабельно. Гораздо рентабельнее копировать регуляторные элементы. Природа, как известно, мудра и ленива. Она стремится к минимизации затрат.
Эпигенетика: теоретические аспекты и практическое значение
В данной статье освещаются современные представления о эпигенетике как новой науке, механизмах эпигенетической регуляции и ее нарушениях, приводящих к развитию заболеваний.
This article highlights the modern views on epigenetics as a new science, the mechanisms of epigenetic regulation and their disorders, leading to the development of diseases.
Эпигенетика — сравнительно недавнее направление биологической науки и пока не так широко известно, как генетика. Под ней понимают раздел генетики, который изучает наследуемые изменения активности генов во время развития организма или деления клеток.
Эпигенетические изменения не сопровождаются перестановкой последовательности нуклеотидов в дезоксирибонуклеиновой кислоте (ДНК).
В организме существуют различные регуляторные элементы в самом геноме, которые контролируют работу генов, в том числе в зависимости от внутренних и внешних факторов. Долгое время эпигенетику не признавали, т. к. было мало информации о природе эпигенетических сигналов и механизмах их реализации.
Структура генома человека
В 2002 г. в результате многолетних усилий большого числа ученых разных стран закончена расшифровка строения наследственного аппарата человека, который заключен в главной молекуле ДНК. Это одно из выдающихся достижений биологии начала ХХI века.
ДНК, в которой находится вся наследственная информация о данном организме, называется геномом. Гены — это отдельные участки, занимающие очень небольшую часть генома, но при этом составляют его основу. Каждый ген отвечает за передачу в организме человека данных о строении рибонуклеиновой кислоты (РНК) и белка. Структуры, которые передают наследственную информацию, называют кодирующими последовательностями. В результате проекта «Геном» были получены данные, согласно которым геном человека оценивался в более чем 30 000 генов. В настоящее время, в связи с появлением новых результатов масс-спектрометрии, геном предположительно насчитывает около 19 000 генов [1].
Генетическая информация каждого человека содержится в ядре клетки и расположена в особых структурах, получивших название хромосомы. Каждая соматическая клетка содержит два полных набора (диплоидный) хромосом. В каждом единичном наборе (гаплоидном) присутствует 23 хромосомы — 22 обычные (аутосомы) и по одной половой хромосоме — Х или Y.
Молекулы ДНК, содержащиеся во всех хромосомах каждой клетки человека, представляют собой две полимерные цепи, закрученные в правильную двойную спираль.
Обе цепи удерживают друг друга четырьмя основаниями: аденин (А), цитозин (Ц), гуанин (Г) и тиамин (Т). Причем основание А на одной цепочке может соединиться только с основанием Т на другой цепочке и аналогично основание Г может соединяться с основанием Ц. Это называется принципом спаривания оснований. При других вариантах спаривание нарушает всю целостность ДНК.
ДНК существует в виде тесного комплекса со специализированными белками, и вместе они составляют хроматин.
Гистоны — это нуклеопротеины, основная составляющая хроматина. Им свойственно образование новых веществ путем присоединения двух структурных элементов в комплекс (димер), что является особенностью для последующей эпигенетической модификации и регуляции.
ДНК, хранящая генетическую информацию, при каждом клеточном делении самовоспроизводится (удваивается), т. е. снимает с самой себя точные копии (репликация). Во время клеточного деления связи между двумя цепями двойной спирали ДНК разрушаются и нити спирали разделяются. Затем на каждой из них строится дочерняя цепь ДНК. В результате молекула ДНК удваивается, образуются дочерние клетки.
ДНК служит матрицей, на которой происходит синтез разных РНК (транскрипция). Этот процесс (репликация и транскрипция) осуществляется в ядрах клеток, а начинается он с области гена, называемой промотором, на котором связываются белковые комплексы, копирующие ДНК для формирования матричной РНК (мРНК).
В свою очередь последняя служит не только носителем ДНК-информации, но и переносчиком этой информации для синтеза белковых молекул на рибосомах (процесс трансляции).
В настоящее время известно, что зоны гена человека, кодирующие белки (экзоны), занимают лишь 1,5% генома [2]. Большая часть генома не имеет отношения к генам и инертна в плане передачи информации. Выявленные зоны гена, не кодирующие белки, называются интронами.
Первая копия мРНК, полученная с ДНК, содержит в себе весь набор экзонов и интронов. После этого специализированные белковые комплексы удаляют все последовательности интронов и соединяют друг с другом экзоны. Этот процесс редактирования называется сплайсингом.
Эпигенетика объясняет один из механизмов, с помощью которого клетка способна контролировать синтез производимого ею белка, определяя в первую очередь, сколько копий мРНК можно получить с ДНК.
Итак, геном — это не застывшая часть ДНК, а динамическая структура, хранилище информации, которую нельзя свести к одним генам.
Развитие и функционирование отдельных клеток и организма в целом не запрограммированы автоматически в одном геноме, но зависят от множества различных внутренних и внешних факторов. По мере накопления знаний выясняется, что в самом геноме существуют множественные регуляторные элементы, которые контролируют работу генов. Сейчас это находит подтверждение во множестве экспериментальных исследований на животных [3].
При делении во время митоза дочерние клетки могут наследовать от родительских не только прямую генетическую информацию в виде новой копии всех генов, но и определенный уровень их активности. Такой тип наследования генетической информации получил название эпигенетического наследования.
Эпигенетические механизмы регуляции генов
Предметом эпигенетики является изучение наследования активности генов, не связанной с изменением первичной структуры входящей в их состав ДНК. Эпигенетические изменения направлены на адаптацию организма к изменяющимся условиям его существования.
Впервые термин «эпигенетика» предложил английский генетик Waddington в 1942 г. Разница между генетическими и эпигенетическими механизмами наследования заключается в стабильности и воспроизводимости эффектов [4].
Генетические признаки фиксируются неограниченное число, пока в гене не возникает мутация. Эпигенетические модификации обычно отображаются в клетках в пределах жизни одного поколения организма. Когда данные изменения передаются следующим поколениям, то они могут воспроизводиться в 3–4 генерациях, а затем, если стимулирующий фактор пропадает, эти преобразования исчезают.
Молекулярная основа эпигенетики характеризуется модификацией генетического аппарата, т. е. активации и репрессии генов, не затрагивающих первичную последовательность нуклеотидов ДНК.
Эпигенетическая регуляция генов осуществляется на уровне траскрипции (время и характер транскрипции гена), при отборе зрелых мРНК для транспорта их в цитоплазму, при селекции мРНК в цитоплазме для трансляции на рибосомах, дестабилизации определенных типов мРНК в цитоплазме, избирательной активации, инактивации молекул белков после их синтеза.
Совокупность эпигенетических маркеров представляет собой эпигеном. Эпигенетические преобразования могут влиять на фенотип.
Эпигенетика играет важную роль в функционировании здоровых клеток, обеспечивая активацию и репрессию генов, в контроле транспозонов, т. е. участков ДНК, способных перемещаться внутри генома, а также в обмене генетического материала в хромосомах [5].
Эпигенетические механизмы участвуют в геномном импритинге (отпечаток) — процессе, при котором экспрессия определенных генов осуществляется в зависимости от того, от какого родителя поступили аллели. Импритинг реализуется через процесс метилирования ДНК в промоторах, в результате чего транскрипция гена блокируется.
Эпигенетические механизмы обеспечивают запуск процессов в хроматине через модификации гистонов и метилирование ДНК. За последние два десятилетия существенно изменились представления о механизмах регуляции транскрипции эукариот. Классическая модель предполагала, что уровень экспрессии определяется транскрипционными факторами, связывающимися с регуляторными областями гена, которые инициируют синтез матричной РНК. Гистонам и негистоновым белкам отводилась роль пассивной упаковочной структуры для обеспечения компактной укладки ДНК в ядре.
В последующих исследованиях была показана роль гистонов в регуляции трансляции. Был обнаружен так называемый гистоновый код, т. е. модификация гистонов, неодинаковая в разных районах генома. Видоизмененные гистоновые коды могут приводить к активизации и репрессии генов [6].
Модификациям подвергаются различные части структуры генома. К концевым остаткам могут присоединяться метильные, ацетильные, фосфатные группы и более крупные белковые молекулы.
Все модификации являются обратимыми и для каждой существуют ферменты, которые ее устанавливают или удаляют.
Метилирование ДНК
У млекопитающих метилирование ДНК (эпигенетический механизм) было изучено раньше других. Показано, что он коррелирует с репрессией генов. Экспериментальные данные показывают, что метилирование ДНК является защитным механизмом, подавляющим значительную часть генома чужеродной природы (вирусы и др.).
Метилирование ДНК в клетке контролирует все генетические процессы: репликацию, репарацию, рекомбинацию, транскрипцию, инактивацию Х-хромосомы. Метильные группы нарушают ДНК-белковое взаимодействие, препятствуя связыванию транскрипционных факторов. Метилирование ДНК влияет на структуру хроматина, блокирует транскрипционные репрессоры [7].
Действительно, повышение уровня метилирования ДНК коррелирует с относительным увеличением содержания некодирующей и повторяющейся ДНК в геномах высших эукариот. Экспериментальные данные показывают, что это происходит потому, что метилирование ДНК служит главным образом как защитный механизм, чтобы подавлять значительную часть генома чужеродного происхождения (реплицированные перемещающиеся элементы, вирусные последовательности, другие повторяющиеся последовательности).
Профиль метилирования — активирование или угнетение — меняется в зависимости от средовых факторов. Влияние метилирования ДНК на структуру хроматина имеет большое значение для развития и функционирования здорового организма, чтобы подавлять значительную часть генома чужеродного происхождения, т. е. реплицированные перемещающиеся элементы, вирусные и другие повторяющиеся последовательности.
Метилирование ДНК происходит путем обратимой химической реакции азотистого основания — цитозина, в результате чего метильная группа СН3 присоединяется к углероду с образованием метилцитозина. Этот процесс катализируется ферментами ДНК-метилтрансферазами. Для метилирования цитозина необходим гуанин, в результате образуется два нуклеотида, разделенные фосфатом (СрG).
Скопление неактивных последовательностей СрG называется островками СрG. Последние представлены в геноме неравномерно [8]. Большинство из них выявляются в промоторах генов. Метилирование ДНК происходит в промоторах генов, в транскрибируемых участках, а также в межгенных пространствах.
Гиперметилированные островки вызывают инактивацию гена, что нарушает взаимодействие регуляторных белков с промоторами.
Метилирование ДНК оказывает огромное влияние на экспрессию генов и, в конечном счете, на функцию клеток, тканей и организма в целом. Установлена прямая зависимость между высоким уровнем метилирования ДНК и количеством репрессированных генов.
Удаление метильных групп из ДНК в результате отсутствия метилазной активности (пассивное деметилирование) реализуется после репликации ДНК. При активном деметилировании участвует ферментативная система, превращающая 5-метилцитозин в цитозин независимо от репликации. Профиль метилирования меняется в зависимости от средовых факторов, в которых находится клетка.
Утрата способности поддерживать метилирование ДНК может приводить к иммунодефициту, злокачественным опухолям и другим заболеваниям [9].
Долгое время механизм и ферменты, вовлеченные в процесс активного деметилирования ДНК, оставались неизвестными.
Ацетилирование гистонов
Существует большое число посттрансляционных модификаций гистонов, которые формируют хроматин. В 1960-е годы Винсент Олфри идентифицировал ацетилирование и фосфорилирование гистонов из многих эукариот [8].
Ферменты ацетилирования и деацетилирования (ацетилтрансферазы) гистонов играют роль в ходе транскрипции. Эти ферменты катализируют ацетилирование локальных гистонов. Деацетилазы гистонов репрессируют транскрипцию.
Эффект ацетилирования это ослабление связи между ДНК и гистонами из-за изменения заряда, в результате чего хроматин становится доступным для факторов транскрипции.
Ацетилирование представляет собой присоединение химической ацетил-группы (аминокислоты лизин) на свободный участок гистона. Как и метилирование ДНК, ацетилирование лизина представляет собой эпигенетический механизм для изменения экспрессии генов, не влияющих на исходную последовательность генов. Шаблон, по которому происходят модификации ядерных белков, стали называть гистоновым кодом.
Гистоновые модификации принципиально отличаются от метилирования ДНК. Метилирование ДНК представляет собой очень стабильное эпигенетическое вмешательство, которое чаще закрепляется в большинстве случаев.
Подавляющее большинство гистоновых модификаций более вариативно. Они влияют на регуляцию экспрессии генов, поддержание структуры хроматина, дифференциацию клеток, канцерогенез, развитие генетических заболеваний, старение, репарацию ДНК, репликацию, трансляцию. Если гистоновые модификации идут на пользу клетки, то они могут продолжаться довольно долго [8].
Одним из механизмов взаимодействия между цитоплазмой и ядром является фосфорилирование и/или дефосфорилирование транскрипционных факторов. Гистоны были одними из первых белков, фосфорилирование которых было обнаружено. Это осуществляется с помощью протеинкиназ.
Под контролем фосфорилируемых транскрипционных факторов находятся гены, в том числе гены, регулирующие пролиферацию клеток. При подобных модификациях в молекулах хромосомных белков происходят структурные изменения, которые приводят к функциональным изменениям хроматина.
Помимо описанных выше посттрансляционных модификаций гистонов имеются более крупные белки, такие как убиквитин, SUMO и др., которые могут присоединяться с помощью ковалентной связи к боковым аминогруппам белка-мишени, оказывая воздействие на их активность.
Эпигенетические изменения могут передаваться по наследству (трансгенеративная эпигенетическая наследственность). Однако в отличие от генетической информации, эпигенетические изменения могут воспроизводиться в 3–4 поколениях, а при отсутствии фактора, стимулирующего эти изменения, исчезают. Передача эпигенетической информации происходит в процессе мейоза (деления ядра клетки с уменьшением числа хромосом вдвое) или митоза (деления клеток).
Модификации гистонов играют фундаментальную роль в нормальных процессах и при заболеваниях.
Регуляторные РНК
Молекулы РНК выполняют в клетке множество функций. Одной из них является регуляция экспрессии генов. За эту функцию отвечают регуляторные РНК, к которым относятся антисмысловые РНК (aRNA), микроРНК (miRNA) и малые интерферирующие РНК (siRNA)
Механизм действия разных регуляторных РНК схож и заключается в подавлении экспрессии генов, реализующейся путем комплементарного присоединения регуляторной РНК к мРНК, с образованием двухцепочечной молекулы (дцРНК). Само по себе образование дцРНК приводит к нарушению связывания мРНК с рибосомой или другими регуляторными факторами, подавляя трансляцию. Также после образования дуплекса возможно проявление феномена РНК-интерференции — фермент Dicer, обнаружив в клетке двухцепочечную РНК, «разрезает» ее на фрагменты. Одна из цепей такого фрагмента (siRNA) связывается комплексом белков RISC (RNA-induced silencing complex) [10].
В результате деятельности RISC одноцепочечный фрагмент РНК соединяется с комплементарной последовательностью молекулы мРНК и вызывает разрезание мРНК белком семейства Argonaute. Данные события приводят к подавлению экспрессии соответствующего гена.
Физиологические функции регуляторных РНК разнообразны — они выступают основными небелковыми регуляторами онтогенеза, дополняют «классическую» схему регуляции генов.
Геномный импритинг
Человек обладает двумя копиями каждого гена, один из которых унаследован от матери, другой от отца. Обе копии каждого гена имеют возможность быть активной в любой клетке. Геномный импритинг это эпигенетически избирательная экспрессия только одного из аллельных генов, наследуемых от родителей. Геномный импритинг затрагивает и мужское и женское потомство. Так, импритингованный ген, активный на материнской хромосоме, будет активным на материнской хромосоме и «молчащим» на отцовской у всех детей мужского и женского пола. Гены, подверженные геномному импритингу, в основном кодируют факторы, регулирующие эмбриональный и неонатальный рост [11].
Импритинг представляет сложную систему, которая может ломаться. Импритинг наблюдается у многих больных с хромосомными делециями (утраты части хромосом). Известны заболевания, которые у человека возникают в связи с нарушением функционирования механизма импритинга.
Прионы
В последние десятилетие внимание привлечено к прионам, белкам, которые могут вызывать наследуемые фенотипические изменения, не изменяя нуклеотидной последовательности ДНК. У млекопитающих прионный белок расположен на поверхности клеток. При определенных условиях нормальная форма прионов может изменяться, что модулирует активность этого белка.
Викнер выразил уверенность в том, что этот класс белков является одним из многих, которые составляют новую группу эпигенетических механизмов, требующих дальнейшего изучения. Он может находиться в нормальном состоянии, а в измененном состоянии прионные белки могут распространяться, т. е. стать инфекционными [12].
Первоначально прионы были открыты как инфекционные агенты нового типа, но сейчас считают, что они представляют собой феномен общебиологический и являются носителями информации нового типа, хранимой в конформации белка. Феномен прионов лежит в основе эпигенетической наследственности и регуляции экспрессии генов на посттрансляционном уровне.
Эпигенетика в практической медицине
Эпигенетические модификации контролируют все стадии развития и функциональную активность клеток. Нарушение механизмов эпигенетической регуляции напрямую или косвенно связано с множеством заболеваний.
К заболеваниям с эпигенетической этиологией относят болезни импринтинга, которые в свою очередь делятся на генные и хромосомные, всего в настоящее время насчитывают 24 нозологии.
При болезнях генного импринтинга наблюдается моноаллельная экспрессия в локусах хромосом одного из родителей. Причиной являются точечные мутации в генах, дифференцированно экспрессирующихся в зависимости от материнского и отцовского происхождения и приводящих к специфическому метилированию цитозиновых оснований в молекуле ДНК. К ним относят: синдром Прадера–Вилли (делеция в отцовской хромосоме 15) — проявляется черепно-лицевым дисморфизмом, низким ростом, ожирением, мышечной гипотонией, гипогонадизмом, гипопигментацией и задержкой умственного развития; синдром Ангельмана (делеция критического района, находящегося в 15-й материнской хромосоме), основными признаками которого являются микробрахицефалия, увеличенная нижняя челюсть, выступающий язык, макростомия, редкие зубы, гипопигментация; синдром Беквитта–Видемана (нарушение метилирования в коротком плече 11-й хромосомы), проявляющийся классической триадой, включающей макросомию, омфалоцеле макроглоссию и др. [13].
К числу важнейших факторов, влияющих на эпигеном, относятся питание, физическая активность, токсины, вирусы, ионизирующая радиация и др. Особенно чувствительным периодом к изменению эпигенома является внутриутробный период (особенно охватывающий два месяца после зачатия) и первые три месяца после рождения. В период раннего эмбриогенеза геном удаляет большую часть эпигенетических модификаций, полученных от предыдущих поколений. Но процесс репрограммирования продолжается в течение всей жизни [14].
К заболеваниям, где нарушение генной регуляции является частью патогенеза, можно отнести некоторые виды опухолей, сахарный диабет, ожирение, бронхиальную астму, различные дегенеративные и другие болезни [15, 16].
Эпигоном при раке характеризуется глобальными изменениями в метилировании ДНК, модификации гистонов, а также изменением профиля экспрессии хроматин-модифицирующих ферментов.
Опухолевые процессы характеризуются инактивацией посредством гиперметилирования ключевых генов-супрессоров и посредством гипометилирования активацией целого ряда онкогенов, факторов роста (IGF2, TGF) и мобильных повторяющихся элементов, расположенных в районах гетерохроматина [17].
Так, в 19% случаев гипернефроидные опухоли почки ДНК островков СрG была гиперметилированной, а при раке груди и немелкоклеточной карциноме легких выявлена взаимосвязь между уровнями гистонового ацетилирования и экспрессией супрессора новообразований — чем ниже уровни ацетилирования, тем слабее экспрессия гена.
В настоящее время уже разработаны и внедрены в практику противоопухолевые лекарственные препараты, основанные на подавлении активности ДНК-метилтрансфераз, что приводит к снижению метилирования ДНК, активации генов-супрессоров опухолевого роста и замедлению пролиферации опухолевых клеток. Так, для лечения миелодиспластического синдрома в комплексной терапии применяют препараты децитабин (Decitabine) и азацитидин (Azacitidine) [18]. С 2015 г. для лечения множественной миеломы в сочетании с классической химиотерапией применяют панобиностат (Panibinostat), являющийся ингибитором гистоновой деацитилазы [19]. Данные препараты по данным клинических исследований оказывают выраженный положительный эффект на уровень выживаемости и качество жизни пациентов.
Изменения экспрессии тех или иных генов могут происходить и в результате действия на клетку факторов внешней среды. В развитии сахарного диабета 2-го типа и ожирения играет роль так называемая «гипотеза экономного фенотипа», согласно которой недостаток питательных веществ в процессе эмбрионального развития приводит к развитию патологического фенотипа [20]. На моделях животных был выявлен участок ДНК (локус Pdx1), в котором под влиянием недостаточности питания снижался уровень ацетилирования гистонов, при этом наблюдались замедление деления и нарушения дифференцировки B-клеток островков Лангерганса и развития состояния, схожего с сахарным диабетом 2-го типа [21].
Активно развиваются и диагностические возможности эпигенетики. Появляются новые технологии, способные анализировать эпигенетические изменения (уровень метилирования ДНК, экспрессию микроРНК, посттрансляционные модификации гистонов и др.), такие как иммунопреципитация хроматина (CHIP), проточная цитометрия и лазерное сканирование, что дает основания полагать, что в ближайшее время будут выявлены биомаркеры для изучения нейродегенеративных заболеваний, редких, многофакторных болезней и злокачественных новообразований и внедрены в качестве методов лабораторной диагностики [22].
Итак, в настоящее время эпигенетика бурно развивается. С ней связывают прогресс в биологии и медицине.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва