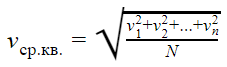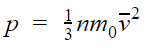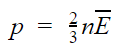что такое газовое число
Большая Энциклопедия Нефти и Газа
Газовое число
Газовое число продавочной газокислотной смеси при обработке как нефтенасыщенных, так и газонасыщенных пластов должно быть максимально возможным, что обеспечит создание значительных депрессий на пласт в момент освоения скважины. [2]
Низкие газовые числа подобных смесей не позволяют получать легкие пеноматериалы, однако благодаря своей доступности, безвредности, прекрасной совместимости с каучуком эти смеси весьма перспективны в технологии производства пеноэластомеров. [3]
Газовым числом мы называем число миллилитров газа ( приведенного к нормальным условиям), выделяемого в единицу времени ( 1 минуту) 1 граммом газообразователя при температуре максимального газовыделения. [4]
С; газовое число 145 см3 / г. Для снижения температуры разложения вводят активаторы. Относится к неокрашивающим поро-образователям. Может применяться в смеси с другими вспенивающими агентами. В продуктах разложения отмечается значительное содержание диоксида углерода. [5]
С; газовое число 84 см3 / г. Продукты разложения менее токсичны, чем продукты разложе ния порофора ЧХЗ-57. [7]
С; газовое число 126 см3 [ г. Нетоксичен. Практически не влияет на вулканизацию. [8]
С; газовое число 150 см3 / г. Более стабилен, чем п-толуолсульфонилгидразид. [10]
С; газовое число 220 см3 / г. Хорошо распределяется в каучуке. [11]
С, газовое число 180 мл / г. Применяется для вспенивания каучуков и ПВХ. [12]
С, газовое число 190 см3 / г. Растворяется в пластификаторах. Устойчив при хранении, индифферентен к ускорителям вулканизации. Чувствителен к влаге и изменениям рН среды. Соли металлов ( Си, Fe, Co, Pb, Al, Sn и др.) активируют разложение. [14]
С; газовое число 113 сма / г. Хорошо растворяется в натуральном и хлоропреновом каучуках. Выкристаллизовывается на поверхность изделий. В кислых средах разлагается при более низких температурах. Относится к числу окрашивающих порообразователей. [15]
п V знак равно п р Т знак равно м р s п е c я ж я c Т <\ displaystyle PV = nRT = mR _ <\ rm
СОДЕРЖАНИЕ
Габаритные размеры
Из закона идеального газа PV = nRT получаем:
Поскольку давление определяется как сила, приходящаяся на область измерения, уравнение газа также можно записать как:
р знак равно ж о р c е а р е а × v о л ты м е а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <<\ dfrac <\ mathrm
Площадь и объем равны (длина) 2 и (длина) 3 соответственно. Следовательно:
р знак равно ж о р c е ( л е п грамм т час ) 2 × ( л е п грамм т час ) 3 а м о ты п т × т е м п е р а т ты р е знак равно ж о р c е × л е п грамм т час а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <<\ dfrac <\ mathrm
Поскольку сила × длина = работа:
р знак равно ш о р k а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <\ mathrm
В противном случае мы также можем сказать, что:
Следовательно, мы можем записать R как:
Связь с постоянной Больцмана
Измерение и замена на определенное значение
Однако после переопределения базовых единиц СИ в 2019 году R теперь имеет точное значение, определенное в терминах других точно определенных физических констант.
Удельная газовая постоянная
р s п е c я ж я c знак равно р M <\ displaystyle R _ <\ rm
Так же, как постоянная идеального газа может быть связана с постоянной Больцмана, то же самое можно сделать и с постоянной газом путем деления постоянной Больцмана на молекулярную массу газа.
р s п е c я ж я c знак равно k B м <\ displaystyle R _ <\ rm
Еще одно важное соотношение исходит из термодинамики. Соотношение Майера связывает удельную газовую постоянную с удельной теплоемкостью для калорийно совершенного газа и термически совершенного газа.
Стандартная атмосфера США
Обратите внимание на использование киломолей, что дает коэффициент 1000 в константе. USSA1976 признает, что это значение не согласуется с приведенными значениями для постоянной Авогадро и постоянной Больцмана. Это несоответствие не является существенным отклонением от точности, и USSA1976 использует это значение R * для всех расчетов стандартной атмосферы. При использовании значения R по ISO расчетное давление увеличивается всего на 0,62 паскаль на 11 км (эквивалент разницы всего в 17,4 сантиметра или 6,8 дюйма) и на 0,292 Па на 20 км (эквивалент разницы всего в 33,8 см или 13,2 дюйма).
Также обратите внимание, что это было задолго до переопределения SI 2019 года, благодаря которому константе было присвоено точное значение.
Универсальная газовая постоянная
Универса́льная га́зовая постоя́нная — термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
Содержание
Общая информация
В 1874 году Д. Менделеев вычислил значение константы в уравнении Менделеева-Клапейрона (уравнении состояния идеального газа) для одного моля газа, используя закон Авогадро, согласно которому 1 моль различных газов при одинаковом давлении и температуре занимает одинаковый объём (
В некоторых научных кругах эту постоянную принято называть постоянной Менделеева. Обозначается латинской буквой 
Входит в уравнение состояния идеального газа 
Удельная газовая постоянная (R/M) для сухого воздуха: 
Связь между газовыми константами
Универсальная газовая постоянная выражается через произведение постоянной Больцмана на число Авогадро, 
Примечания
См. также
Полезное
Смотреть что такое «Универсальная газовая постоянная» в других словарях:
универсальная газовая постоянная — Постоянная (R) в уравнении состояния для моля идеального газа (pv = RT), одинаковая для всех веществ. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики… … Справочник технического переводчика
универсальная газовая постоянная — molinė dujų konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. molar gas constant; universal gas constant vok. allgemeine Gaskonstante, f; ideale… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
универсальная газовая постоянная — universalioji dujų konstanta statusas T sritis chemija apibrėžtis Idealiųjų dujų molinė būsenos lygties konstanta, lygi 8,314 J/K·mol. santrumpa( os) R atitikmenys: angl. gas constante per mole; universal gas constant rus. мольная газовая… … Chemijos terminų aiškinamasis žodynas
универсальная газовая постоянная — molinė dujų konstanta statusas T sritis fizika atitikmenys: angl. gas constant per mole; universal gas constant vok. ideale Gaskonstante, f; molare Gaskonstante, f; universelle Gaskonstante, f rus. универсальная газовая постоянная, f pranc.… … Fizikos terminų žodynas
универсальная газовая постоянная — Постоянная (R), входящая в управление состояния для моля идеального газа (pv = RT), одинаковая для всех идеальных газов … Политехнический терминологический толковый словарь
Газовая постоянная — Универсальная газовая постоянная R0 ≈ 8,314 кДж/(кмоль·K) фундаментальна физическая константа. Индивидуальная газовая постоянная R = R0/M, кДж/(кг·K) константа для газа или газовой смеси конкретной молярной массы … Википедия
универсальная газовая константа — molinė dujų konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. molar gas constant; universal gas constant vok. allgemeine Gaskonstante, f; ideale… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Газовая постоянная — универсальная физическая постоянная R, входящая в уравнение состояния 1 моля идеального газа: pv = RT (см. Клапейрона уравнение), где р давление, v объём, Т абсолютная температура. Г. п. имеет физический смысл работы расширения 1 моля… … Большая советская энциклопедия
ГАЗОВАЯ ПОСТОЯННАЯ — (обозначение R), универсальная постоянная в газовом уравнении (см. ЗАКОН ИДЕАЛЬНОГО ГАЗА), также называемая универсальной молярной газовой постоянной, равна 8,314510 ДжК 1 моль 1 … Научно-технический энциклопедический словарь
ГАЗОВАЯ ПОСТОЯННАЯ — (R), универсальная фнз. постоянная, входящая в ур ние состояния 1 моля идеального газа: pv=RT (см. КЛАПЕЙРОНА УРАВНЕНИЕ), где р давление, v объём моля, Т абс. темп pa. Г. п. по своему физ. смыслу работа расширения 1 моля идеального газа под пост … Физическая энциклопедия
Идеальный газ
Газ: агрегатное состояние
У веществ есть три агрегатных состояния — твердое, жидкое и газообразное.
Их характеристики — в таблице:
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Твердое
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около положения в кристаллической решетке
Жидкое
близко друг к другу
молекулы малоподвижны, при нагревании скорость движения увеличивается
Газообразное
занимает предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем вещества в газообразном состоянии, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (занимает весь предоставленный объем) и состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатных состояний точно три?
На самом деле есть еще четвертое — плазма. Звучит как что-то из научной фантастики, но это просто ионизированный газ — газ, в котором, помимо нейтральных частиц, есть еще и заряженные. Ионизаторы воздуха как раз строятся на принципе перехода из газообразного вещества в плазму.
Модель идеального газа
В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса.
Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической).
В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный.
Свойства идеального газа
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
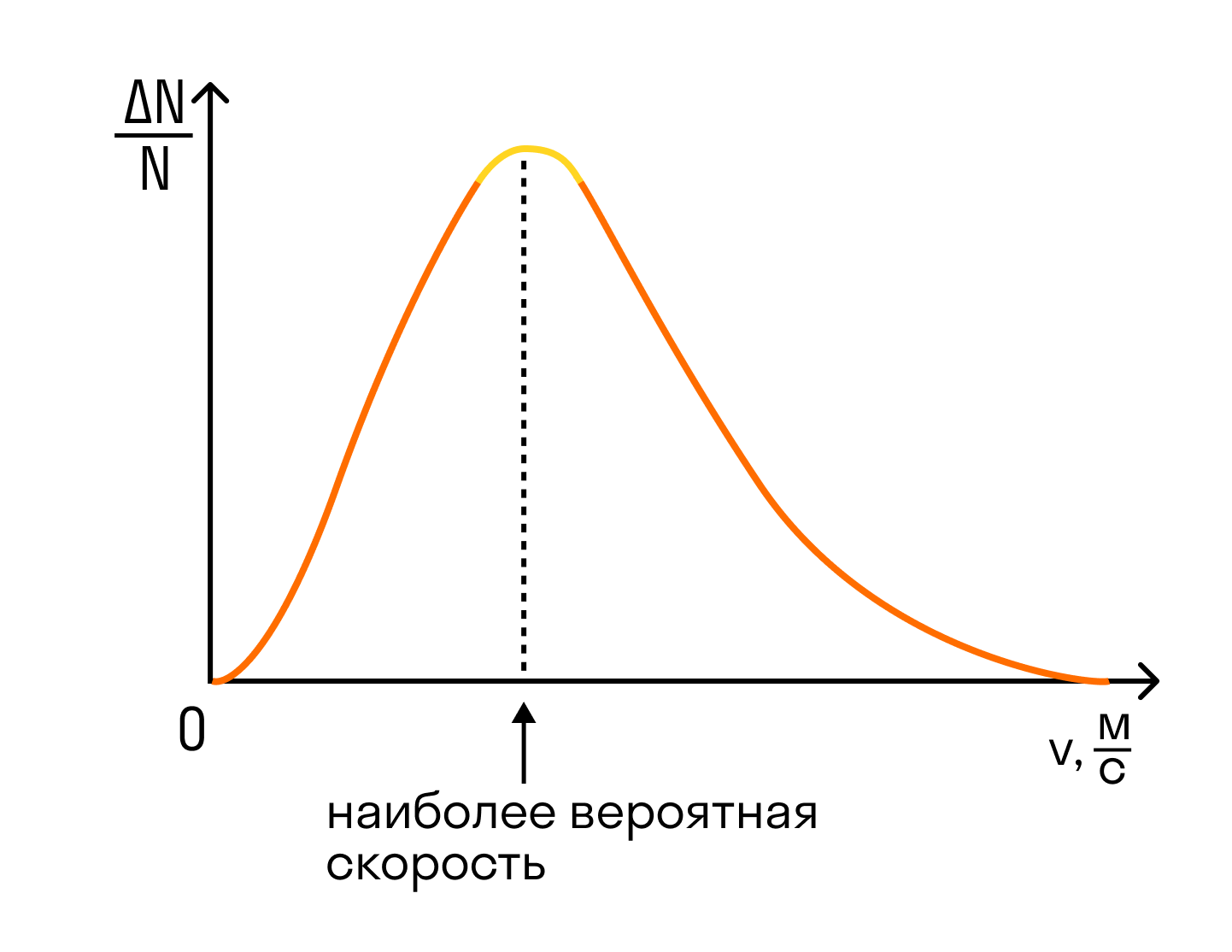
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.
Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
Средняя квадратичная скорость
v1, v2, vn — скорости разных молекул [м/с]
N — количество молекул [-]
Давление идеального газа
Молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, за одну секунду на каждый квадратный сантиметр молекулы воздуха наносят столько ударов, что их количество выражается двадцатитрехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул на стенки сосуда приводит к значительному давлению. Представьте, что комар пытается толкать машину — она не сдвинется с места. Но если за работу возьмется пара сотен миллионов комаров, то машину получится сдвинуть.
Эксперимент
Чтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
F — сила [Н]
S — площадь [м2]
То есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади.
Рассмотрим аналогичный пример с двумя сосудами разной площади.
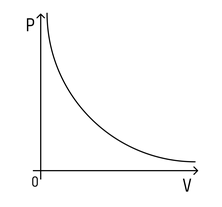
Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
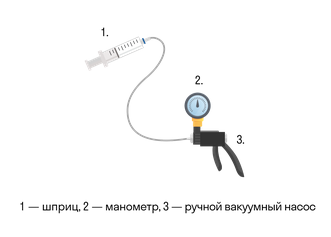
Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
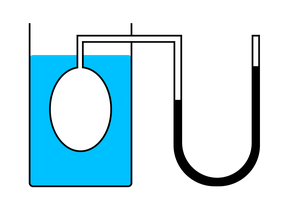
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке.
В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным.
Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.
Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
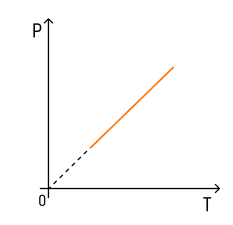
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:
Эта зависимость называется законом Шарля в честь ученого, открывшего ее.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
Основное уравнение МКТ
p = nkT
p — давление газа [Па]
T — температура газа [К]
m 0 — масса одной молекулы [кг]
v — средняя квадратичная скорость [м/с]
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
Кинетическая энергия
Ек = mv 2 /2
Ек — кинетическая энергия [Дж]
m — масса тела [кг]
v — скорость [м/с]
Для молекулы газа формула примет вид:
Средняя кинетическая энергия поступательного движения молекулы
Ек — средняя кинетическая энергия поступательного движения молекулы [Дж]
m0 — масса молекулы [кг]
v — скорость молекулы [м/с]
Из этой формулы можно выразить m0v 2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Основное уравнение МКТ
p — давление газа [Па]
n — концентрация [м-3]
E — средняя кинетическая энергия поступательного движения молекулы [Дж]
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Энергетические единицы вместо кубометров газа: как это работает и зачем введено такое измерение
Для чего регулятор ввел измерение газа в единицах энергии и от чего зависит качество природного газа, поставляемого населению?
Национальная комиссия по регулированию энергетики и коммунальных услуг (НКРЭКУ) 26 января приняла постановление № 84 «Об утверждении Изменений в некоторые постановления НКРЭКУ о введении на рынке природного газа использования единиц энергии».
Документ обязывает операторов локальных газораспределительных сетей (операторов ГРС – облагазов) в платежках, помимо объема, указывать количество потребленной энергии в трех единицах измерения – киловатт-часах (кВт/ч), Гигакалориях (Гкал) и Мегаджоулях (МДж).
Теперь каждый потребитель будет получать платежку с указанием качества газа, который поставляется конкретно ему. Правда, платить бытовые потребители по прежнему будут за объем.
Киловатт-час (кВт/ч, kW/h) – единица энергии, показывающая количество энергии потребляемое/производимое устройством мощностью 1 кВт за 1 час.
Калория (кал) – единица энергии, обозначающая количество тепла, необходимого для нагрева 1 грамма воды на 1 градус Цельсия при давлении в 1 атмосферу. 1 Гкал = 1000 Мкал = 1 000 000 ккал.
Джоуль (Дж, J) – единица энергии, необходимой для перемещения точки приложения силы в один ньютон на расстояние одного метра. 1 Мдж (MJ) = 1 000 000 Дж.
Кроме того, до конца февраля все операторы ГРС должны начать публикацию на сайте физико-химических показателей газа по маршрутам следования.
Укртрансгаз, который сейчас является оператором газотранспортной системы (ГТС), обязан в течении месяца начать публикацию средневзвешенной теплоты сгорания газа по каждому маршруту следования.
Другими словами, теперь каждый потребитель должен видеть все физико-химические показатели (ФХП) газа, который он потребляет, и его энергетическую ценность в трех единицах измерения.
БизнесЦензор подготовил ответы на вопросы о качестве газа для украинских потребителей.
Цены на газ будут пересматривать каждые полгода
Зачем нужно знать количество энергии газа
Украина закупает газ в Европе, где уже давно товаром являются энергетические единицы, а не объем. Это теплота сгорания (также называют – теплотворность или калорийность) газа.
Согласно постановлению кабмина № 758, которое регулирует поставки газа населению, его цена должна определятся согласно данным агентства Platts European Gas Daily о цене газа на немецком хабе NetConnect Germany (NCG).
Цена публикуется в евро за МВт/ч, а не за объем, как обычно считают в Украине. Например, в ноябре 2015 года газ на NCG стоил 17,7 евро за 1 МВт/ч.
Кроме привычной украинцу единицы МВт/ч, которой мы измеряем электроэнергию, в котировках европейского агентства указаны британские термические единицы (British thermal unit – Btu), которые отличаются от европейских.
Этими цифрами легко оперировать, если знать, что в тысяче кубов европейского газа примерно 9,5-10 МВт/ч. Следовательно, тысяча кубов в ноябре 2016 года обошлась бы в 170-180 евро.
В Украине электроэнергия измеряется в кВт/ч, а услуги отопления – в Гкал. Таким образом, любой потребитель сможет перевести энергию потребленного газа в электричество или тепловую энергию. Это позволит сравнить их стоимость и выбрать самый экономный вариант энергоносителя.
Как переводить одни энергетические единицы в другие
Информацию о качестве украинского газа в каждой области еще с мая 2014 года ежемесячно публикует Укртрансгаз (УТГ). Там же можно найти ФХП газа по 285 маршрутам следования.
Например, в декабре калорийность газа рознилась от 8,15 Мкал на кубометр в Закарпатской области до 8,28 Мкал на кубометр в Сумской области.
Почему у разных операторов ГРС разное качество газа, которое меняется во времени?
«Природный газ от разных источников транспортируется по магистральным газопроводам в общем потоке. Смешивание газа происходит естественным образом без каких-либо вмешательств», – отвечают в УТГ.
Качество газа зависит от изменения соотношений газа от различных источников. Это соотношение меняется в зависимости от режима работы ГТС и сезона.
На сайте УТГ теплотворность газа представлена в килокалориях (ккал) на кубический метр. Их легко можно перевести в другие единицы, воспользовавшись индексами перевода, опубликованными в обосновании постановления НКРЭКУ.
Таким образом, теплотворность одного кубометра газа, к примеру в Киеве и Киевской области, будет равна примерно 0,0082 Гкал (8,2 Мкал), 9,5 кВт/ч и 34,4 МДж.
Какие характеристики имеет газ из разных источников
Наиболее качественный газ в Европе. В первую очередь потому, что поставляется с небольшим разлетом калорийности.
В Европе газ разделен на две категории – более качественный газ группы H и менее качественный – группы L. Последняя используется во Франции, Нидерландах, Бельгии и частично – в Германии. Газ этой категории транспортируют по отдельным трубопроводам.
В Украине, по данным УТГ, в трубе смешивается газ из трех источников с разной теплотворностью.
Нижняя теплота сгорания
Газ, добытый в Украине
Газ ОАО «Газпром», поступающия для транзита
Газ, импортированный из европейских стран
Как сообщает Метрологический центр НАК «Нафтогаз», в Германии работают установки, автоматически смешивающие газ для получения ресурса с одинаковыми характеристиками.
В Украине нет технических возможностей регулировать смешивание газа. Потому такой большой разлет по качеству.
Для примера, вот так выглядит платежка за газ в Польше. Там указан объем поставляемого газа и его теплотворность в кВт/ч.
Как видно, в Польше теплотворность газа рассчитывается, исходя из показателя 11,28 кВт/ч на кубометр, что отличается от среднеукраинского – 9,5 кВт/ч на кубометр.
Показатели отличаются, потому что в Европе для расчета используется высшая теплота сгорания. Эта же методика прописана в постановлении НКРЕКУ о вводе энергетических единиц. А УТГ в своей статистике указывает низшую теплоту сгорания.
Кто и как контролирует качество газа
В соответствии с Газовым кодексом, который вступил в силу в октябре 2015 года, пробы газа берутся во всех точках входа и выхода газа из ГТС не реже, чем раз в неделю.
При поставке газа потребителю, его анализ осуществляет оператор ГТС – Укртрансгаз. Проба газа берется на газораспределительной станции, после чего оператор ГРС (облгаз) поставляет газ напрямую потребителю.
Также на газораспределительных станциях в газ добавляется одорант для запаха – 16 грамм этилмеркаптана на тысячу кубометров. За эту операцию также отвечает УТГ.
По данным УТГ, в компании работают 65 химико-аналитических лабораторий. Кроме того, оператор ГТС использует 47 автоматических потоковых хромографов, которые позволяют определять ФХП газа в режиме реального времени.
При взятии проб, газ анализируется при стандартных условиях эксплуатации газовых приборов – при температуре в 20 градусов Цельсия (293,15 К) и давлении 101,325 кПа ( 760 мм ртутного столба).
Киевгаз устанавливает системы телеметрии в столичных домах
Можно ли намешать в газ воздух
В народе существует две версии того, как газораспределяющие компании «бодяжат» газ.
По одной из них в газ просто добавляется воздух. Это не возможно из-за опасности такой смеси. Природный газ в газопроводах можно безопасно транспортировать лишь с концентрацией воздуха, не превышающей 5 %.
Когда воздуха в газе от 5 до 15 %, в газопроводе образуется взрывоопасная смесь. Для ее взрыва достаточно незначительного импульса. Им могут стать блуждающие токи в газопроводе.
При концентрации воздуха в газе от 15 до 60 %, газ превращается в пожароопасную смесь, которая может вспыхнуть по тем же причинам.
При пожаре воздух в трубе начнет выгорать. Его концентрация обязательно опустится меньше 15 %. И тогда смесь станет взрывоопасной.
Если бы оператор ГТС или операторы ГРС разбавляли газ воздухом, по всей Украине каждый день гремели бы взрывы.
Можно ли разбавить газ азотом
Это вторая версия плохого качества газа. Разбавить газ азотом вполне реально. Но, не выгодно.
То есть, цена азота в 2,5 раза выше, чем цена природного газа для промышленности, и в 3,5 раза – чем цена для населения. Это не считая затрат, необходимых для установки оборудования по закачке азота в газовую трубу.
Если концентрация азота в природном газе превышает 7,5 %, то пламя на конфорке или в горелке котла «сорвет». Прибор потухнет, что чревато утечкой газа, пожаром или взрывом.
Почему газ горит желтым/красным пламенем
Единственной причиной этому является давление в трубе. От него же зависит ухудшение качества газа.
Как указывает на своем сайте НАК «Нафтогаз», давление не может быть постоянным и зависит от многих факторов. Например, в пиковые часы потребления, когда люди перед работой и после нее зажигают конфорки, давление падает.
Давление в трубе зависит от погоды и от высоты точки потребления. Например, количество газа (еще называют плотность или густота газа) в одном кубометре в Одессе ( 49 м над уровнем моря) на 6 % больше, чем в городе Яремче Ивано-Франковской области ( 585 м над уровнем моря).
В целом плотность газа меняется на 1 % каждые 88,5 м над уровнем моря.
Давление в трубе, кроме прочего, будет зависеть от удаленности потребителя от газораспределительного пункта (ГРП). Чем дальше потребитель – тем меньше у него плотность газа. Оператор ГРС обязан обеспечить рабочее давление всем потребителям.
На качество газа влияют вентиляция – наличие воздуха, с которым смешивается газ для горения. Для нормальной работы газовых приборов необходимо тройное замещение воздуха в течении часа.
Можно проверять качество газа по-народному – засекая время закипания литра воды в стандартной кастрюльке. Проблема в том, что это время практически всегда будет разным.
Нардепы предлагают по-новому устанавливать газовые счетчики
Каким должно быть качество газа
Качество газа в Украине регламентирует ГОСТ 5542 «Газы горючие природные для промышленного и коммунально-бытового назначения. Технические условия».
В соответствии с этим документом, минимально допустимое значение низшей теплоты сгорания газа – 7,6 Мкал/куб. м (31,8 МДж/куб. м или 8,8 кВт/ч/куб. м) с допустимым отклонением в 5 %.
Такая теплотворность должна быть у газа при стандартных условиях – при температуре в 20 градусов Цельсия (293,15 К) и давлении 101,325 кПа ( 760 мм ртутного столба).
Как сообщает «Нафтогаз», потребитель имеет право заказать у оператора ГРС (облгаза) проверку на соответствие русурса ГОСТу.
Если газ не соответствует стандарту, оператор ГРС должен заплатить штраф потребителю. Если соответствует, заказчик-потребитель обязан оплатить стоимость экспертизы.
Что такое число Веббе
Для определения качества газа у потребителя, которое зависит от теплотворности и давления, используется так называемое число Воббе (Wobbe index). Это отношение теплоты сгорания к квадратному корню относительной плотности газа.
Формула представлена так.
В ней «Q» – объемная теплота сгорания, а «p» – относительная густота газа, «В» – собственно число Воббе.
Если число Воббе выше стандартного значения, кислород воздуха не успевает взаимодействовать со всем объемом газа. Тогда происходит создание оксида углерода (СО) и сажи.
Если число Воббе ниже стандартного значения, газовые приборы не работают в номинальной мощности. Тогда может случиться отрыв пламени.